PEFT共聚酯的热氧化分解行为研究
黄洛玮,王树霞,2,戴钧明,2,王玉合,司 虎
(1.中国石化仪征化纤有限责任公司研究院,江苏 仪征 211900; 2.江苏省高性能纤维重点实验室,江苏 仪征 211900)
随着社会经济的快速发展和化石能源的不断消耗,环境污染和石油资源短缺逐渐成为石油化工工业所面临的重大问题[1]。由于生物质资源的丰富性和可再生性,生物基材料被认为是新型绿色化学材料的未来[2]。聚2,5-呋喃二甲酸乙二醇酯(PEF)具有与聚对苯二甲酸乙二醇酯(PET)相似的结构,且拥有更好的气体阻隔性能、机械性能和热稳定性,因此PEF被认为是PET完美的工业替代品[3]。
PEF目前仍处于工业化研究中,尚未建成成熟的工业生产线。PEF的五元环非对称结构使得其在制备时聚合较慢,在没有合适高效催化剂的情况下,易发生开环、氧化、降解等副反应。通过在PET大分子中部分引入PEF链段制备聚对苯二甲酸-2,5-呋喃二甲酸乙二醇共聚酯(PEFT),可在一定程度上降低共聚酯的制备难度,且能使共聚得到的PEFT获得一定程度上的性能提升,有效降低其工业化生产难度。
热稳定性是PEF突出的热性能之一。尽管PEF的合成研究已经在世界范围内成为热点之一,但是目前有关PEF热分解行为的研究还未见详细报道。有些方法如黏度降法[4]、热重法[5]等曾被用来评价PET的热稳定性能,但是不同方法得出的结果不尽相同。表观活化能(Ea)决定了聚合物热氧化分解中所需的最小能量[6],可以用来评价PEFT的热稳定性能和抗老化性能。
作者采用热重(TG)分析法,研究了自制的不同对苯二甲酸(PTA)和2,5-呋喃二甲酸(FDCA)质量比的PEFT的热氧化分解行为,并使用Kinssinger法、Ozawa法和Coats-Redfen法对PEFT的热氧化分解反应的Ea和反应机理进行了分析。
1 实验
1.1 试样
PEFT切片:共5个试样,FDCA(相对FDCA与PTA总质量)质量分数分别为0,25%,50%,75%,100%,各试样的常规性能如特性黏数([η])、色度(亮度L、红绿度a、黄蓝度b)、二甘醇(DEG)含量见表1,自制。

表1 PEFT切片的常规性能Tab.1 Conventional properties of PEFT chips
1.2 TG测试
采用美国Perkin-Elmer公司制造的TGA-7型热重分析仪对PEFT试样的热氧化分解进行测试。试样质量为3.0 mg,在空气氛围中由50 ℃加热至650 ℃,空气流量为20 mL/min,升温速率(β)分别为5,10,15,20 ℃/min。根据试样质量随温度的变化绘制TG曲线,同时经计算机计算热失重速率并绘制微商热重(DTG)曲线。
2 热氧化分解反应的Ea的计算方法
反应动力学的分析基于反应速率(ν)的一般通式如式(1):
ν=dw/dt=kTf(w)
(1)
式中:w为试样质量变化率;t为时间;T为温度;f(w)取决于反应机理的数学函数;kT为温度相关的速率常数。
对于kT,Arrhenius提出了Ea的概念,并通过式(2)揭露kT与T的关系:
(2)
式中:A为指前因子;R为一般气体常数,其值为8.314 J/(mol·K)。
结合式(2),式(1)可以变换为式(3):
(3)
但是,式(3)中f(w)和A因反应机理的不同很难确定为某一数值。为了得到确定的Ea,式(3)必须变换为其他形式,使f(w)和A可以忽略不计或表达为某一确定函数。本文通过TG测试中的β和T,采用了3种方法来计算Ea。
2.1 Kinssinger法
Kinssinger法[7-8]假设f(w)为:
f(w)=(1-w)n
(4)
式中:n为反应级数。
通过对公式(3)两边进行微分变形并简化可以最终得到公式(5):
(5)
式中:Tmax是指最大分解速度温度,可以由DTG曲线中的峰值得到;wmax是指最大分解速度温度下的质量变化率。
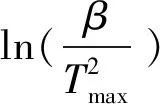
2.2 Ozawa法
Ozawa法[9-11]通过对式(3)进行积分得到函数g(w)的计算式(6):
(6)
式中:Ti是指初始分解温度。

(7)
对于某一w下,以lgβ对1/T作图可以得到斜率为-0.456 7Ea/R的线性关系图。
2.3 Coats-Redfen法
Coats-Redfen积分公式也经常被用来作为式(6)的近似解[13-14]:
(8)
g(w)取决于不同的反应机理,不同反应动力学模型下的g(w)函数如表2所示。

表2 不同反应机理的反应动力学模型g(w)函数Tab.2 g(w) function of reaction kinetic model with different reaction mechanism
3 结果与讨论
3.1 一定β下PEFT的TG和DTG曲线
在β为15 ℃/min时,不同FDCA/PTA质量比的PEFT试样的TG和DTG曲线见图1。从图1可见,各PEFT试样的热氧化分解反应均分为两个阶段,第一阶段为共聚酯的热氧化分解,第二阶段为第一步碳化产物的分解。

图1 β为15 ℃/min时PEFT试样的TG和DTG曲线Fig.1 TG and DTG curves of PEFT samples at β of 15 ℃/min
PEFT试样的Ti和Tmax见表3。1#试样和2#试样的Ti和Tmax比较接近,3#试样和4#试样的Ti和Tmax比较接近,但随FDCA含量提高,PEFT试样的Tmax呈下降趋势。其中,1#试样(FDCA质量分数为0时即PET)的Tmax最高,5#试样(FDCA质量分数为100%时即PEF)的Tmax最低,这是由于呋喃结构中五元环稳定性比苯环差,C—C、C=C、C=O,C—O的键能参数分别为346,610,749,360 kJ/mol,破坏呋喃环所需键能在1 730~2 286 kJ/mol,破坏苯环所需键能在2 076~2 286 kJ/mol,所以随FDCA含量提高,PEFT试样的Ti和Tmax有所下降。FDCA质量分数为25%的2#试样的Ti略高于PET的原因是当高分子链中含有少量含氧五元杂环时,由于其电负性比苯环大,在链段中会形成分子间氢键。因此,当FDCA含量较低时,热氧化分解初期分子间氢键对PEFT热氧化分解起主导作用,从而表现出Ti比PET略高。分子间氢键的作用对PEFT热稳定性整体下降的趋势进行了一定程度的补偿,因此表现出Ti和Tmax随FDCA含量提高而下降。

表3 β为15℃/min时PEFT试样的Ti和TmaxTab.3 Ti and Tmax of PEFT samples at β of 15 ℃/min
3.2 不同β下PEFT的TG和DTG曲线
不同β下2#试样的TG和DTG曲线见图2,通过TG和DTG曲线可得到2#试样的Ti和Tmax,同样方法可以得到其余试样的Ti和Tmax,列于表4。从图2和表4可知,随着β的增加,PEFT试样的TG曲线和DTG曲线都向着较高温度方向偏移,PEFT试样的Ti和Tmax随着β的增加而变大,这一现象是由于热滞后引起的[15]。PEFT在升温过程中发生热氧化降解反应,传热需要一定时间,当β增加时,PEFT内部不能及时升温分解和挥发,导致测试结果偏大,且β越大时,热滞后现象越明显。
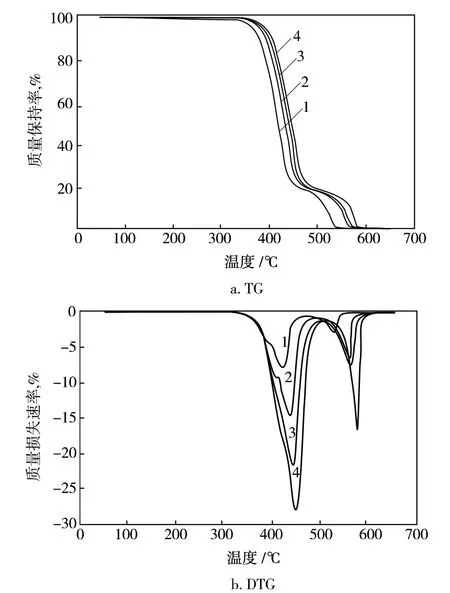
图2 不同β下2#试样的TG和DTG曲线Fig.2 TG and DTG curves of sample 2# at different β1—5 ℃/min;2—10 ℃/min;3—15 ℃/min;4—20 ℃/min

表4 不同β下PEFT试样的Ti和Tmax Tab.4 Ti and Tmax of PEFT samples at differentβ
3.3 Kinssinger法求Ea


图3 基于Kinssinger法PEFT试样的线性拟合曲线 of PEFT samples by Kinssinger method●—1#试样;■—2#试样;▲—3#试样;▼—4#试样;◆—5#试样
3.4 Ozawa法求Ea
PEFT的热氧化分解可分为共聚酯的氧化分解和碳化物分解两个阶段,第一阶段的w为0~80%,第二阶段的w为80%~100%,第一阶段下热氧化分解下的Ea可代表PEFT的热稳定性能。Ozawa法计算得到PEFT的Ea见表5。从表5可知,Ozawa法的计算结果与Kinssinger法的计算结果有所差异,这是因为不同共聚酯在Tmax处的w不同。由w为10%~80%的Ea平均值可知,4#试样的Ea最大,1#试样(PET)的Ea最小,2#试样和4#试样的Ea比较接近,3#试样的Ea在PEFT共聚酯中最小。另外,在热氧化分解第一阶段中(w为0~80%),Ea随着w的升高而增加,这可以解释为在空气氛围下,PEFT逐渐由低Ea的降解反应向高Ea的氧化反应过渡,转化后期氧化降解的残余物分解需要更高的Ea,这表示在低w时可能存在单一的反应机理,而在较高w时反应机理很复杂,存在多步反应。

表5 Ozawa法得到不同w下PEFT试样的Ea Tab.5 Ea of PEFT samples at different w obtained by Ozawa method
3.5 Coats-Redfen法求Ea
在Coats-Redfen法中,不同PEFT试样在不同反应动力学模型下的Ea见表6~10,通过比较不同动力学模型函数下拟合曲线的相关系数(r2)发现,一级反应模型下的拟合程度较好,1#,2#,3#,4#,5#试样的r2分别为0.98,0.99,0.97,0.99,0.99,且Ea数值最接近Kinssinger法和Ozawa法,此时1#试样(PET)的Ea为139.8 kJ/mol,5#试样(PEF)的Ea为205.7 kJ/mol,4#试样的Ea最大为233.9 kJ/mol,1#试样(PET)的Ea最小,这与Ozawa法得出的结论一致。这个现象是由于PEF材料的氧气阻隔性较好,是PET的4.6倍[16],这导致PEFT在热氧分解反应时,其表面优先与氧气进行热氧化降解反应,其内部由于与氧气阻隔而使得热氧降解反应产生了延迟。这表现为尽管PEFT热氧化降解反应在较低温度下发生,但Ea却提高了,反应速率变慢了。因此,PEFT在较高FDCA含量下表现出了较高的Ea,而PEF由于缺少了PET稳定结构,随热氧化降解反应迅速分解挥发,Ea又略有下降。

表6 Coats-Redfen法得到的不同动力学模型下1#试样的EaTab.6 Ea of sample 1# under different kinetic models obtained by Coats-Redfen method
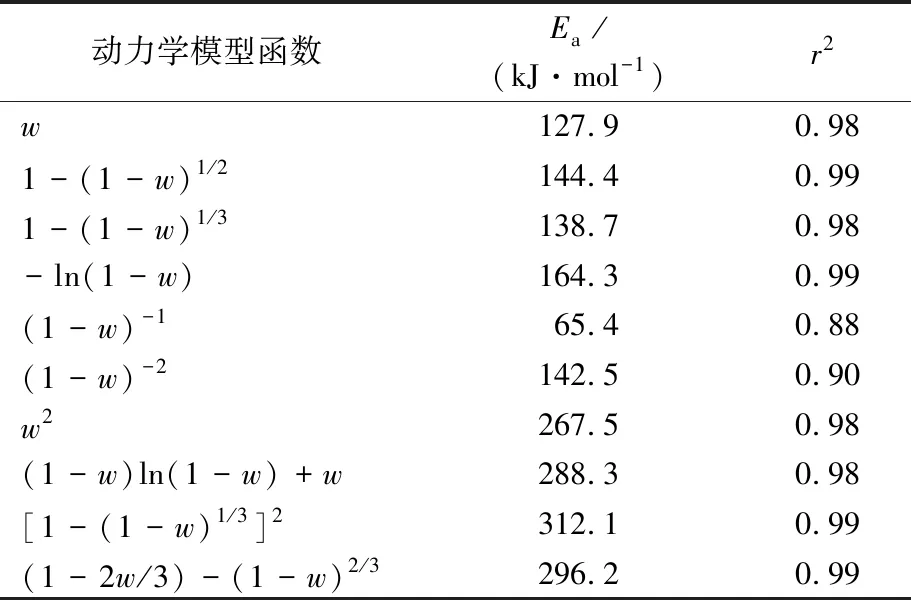
表7 Coats-Redfen法得到的不同动力学模型下2#试样的EaTab.7 Ea of sample 2# under different kinetic models obtained by Coats-Redfen method

表8 Coats-Redfen法得到的不同动力学模型下3#试样的EaTab.8 Ea of sample 3# under different kinetic models obtained by Coats-Redfen method

表9 Coats-Redfen法得到的不同动力学模型下4#试样的EaTab.9 Ea of sample 4# under different kinetic models obtained by Coats-Redfen method
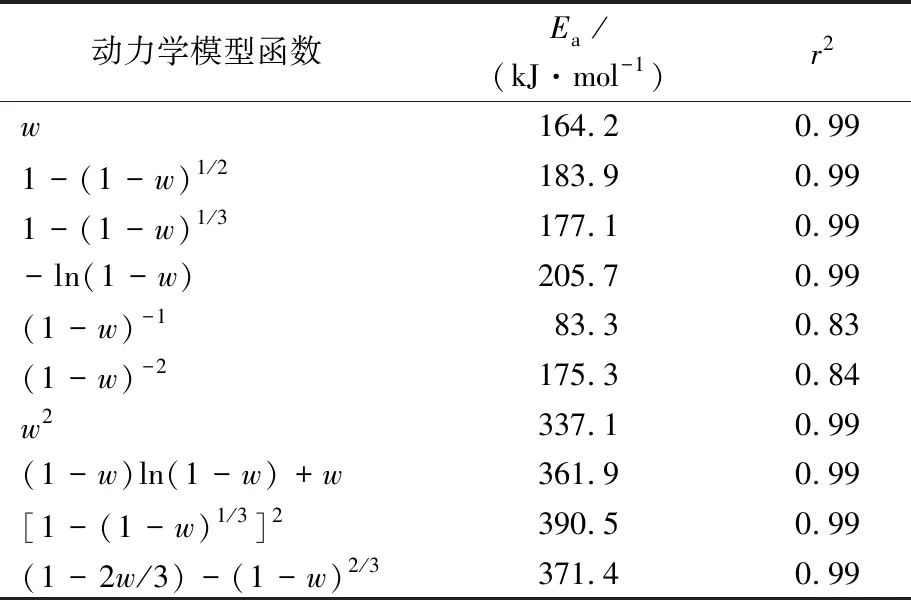
表10 Coats-Redfen法得到的不同动力学模型下5#试样的EaTab.10 Ea of sample 5# under different kinetic models obtained by Coats-Redfen method
4 结论
a. PEFT的热氧化分解过程分为两个阶段:第一阶段主要是为共聚酯的热氧化降解,w为0~80%;第二阶段为第一阶段碳化物的分解,w为80%~100%。PEFT的Ti和Tmax随着FDCA含量的增加而降低,随着β的增加而变大。
b. Kinnsinger法计算结果为5#试样(PEF)的Ea最大、3#试样的Ea最小。该方法得到的是在Tmax下PEFT的Ea大小,并不能显示Ea随w的整体变化趋势。
c. Ozawa法和Coats-Redfen法计算结果一致, 4#试样(FDCA质量分数为75%的PEFT)的Ea最大,PET的Ea最小。通过Coats-Redfen法可知,PEFT的热氧化降解更接近一级反应,此时1#试样(PET)的Ea为139.8 kJ/mol,5#试样(PEF)的Ea为205.7 kJ/mol,4#试样的Ea为233.9 kJ/mol。

