中度嗜盐菌抑制马铃薯干腐病病原菌活性的筛选及活性菌株的鉴定
胡英杰,沈 硕*,贾鹏莉,陈菲儿
(1.青海大学,青海 西宁 810016; 2.青海大学农林科学院,青海 西宁 810016;3.青海省马铃薯育种重点实验室,青海 西宁 810016;4.青藏高原生物技术教育部重点实验室,青海 西宁 810016)
马铃薯干腐病是马铃薯储藏期和生长期常见的病害,该病由一种或多种镰刀菌共同作用引起[1],发病后会使贮藏期的损失最高达到60%。部分镰孢菌能产生毒素和其他类型的次生代谢产物,如镰孢菌素A和B、萎蔫酸、脱氢萎蔫酸、串珠菌素、赤霉素等。这些有害的次级代谢产物不仅危害人畜[2],还会严重地制约我国马铃薯产业的发展。目前,对马铃薯干腐病的防治主要以化学药剂为主,但化学防治会造成环境中常见的3R问题[3-4]。因此,微生物源生防制剂的研究以及应用,受到国内外学者的广泛关注[5-6]。
国内外研究发现解淀粉芽孢杆菌(Bacillusamyloliquefaciens)对苹果环腐病和梨贮藏病害具抑制活性[7-8];枯草芽孢杆菌(Bacillussubtilis)对辣椒炭疽病和小麦根腐病具有抑制活性[9-10];贝莱斯芽孢杆菌(Bacillusvelezensis)对小麦赤霉病具有抑制活性[11]。嗜盐菌是一种可在高盐的极端环境下生存的菌株类群,根据其最适生长盐度划分,中度嗜盐菌的最适生长盐度为3%~15%[12-13]。与轻度嗜盐菌和极端嗜盐菌相比,中度嗜盐菌环境适应能力相对突出,分布更加广泛,营养要求相对较低[14-15],从而可以将其发展为新型的生防制剂。生长在极端环境下的嗜盐芽孢杆菌,在长期的进化选择和环境选择压力下,形成了特殊的环境适应机制和基因类型[16],可能会产生某些具有生物学活性的代谢产物以及其独特的种群特点。目前,中度嗜盐菌抑制马铃薯干腐病病原菌的研究较少,本文选取本课题组前期从青海茶卡盐湖地区样品中分离纯化的部分嗜盐菌菌株,进行抑制马铃薯窖藏病原菌活性的筛选及活性菌株的鉴定,并对其发酵液萃取物的抑菌活性进行研究,期望从中发现具有抑制马铃薯窖藏病害新活性的嗜盐菌菌株,为进一步防治马铃薯窖藏病害提供新的生防制剂和生防菌剂,并为马铃薯干腐病的防治提供新的生防途径。
1 材料与方法
1.1 供试材料
1.1.1 供试病原菌 供试马铃薯病原菌青9A-4-13和青9A-5-10分离自青薯9号病薯薯块,由青海大学农林科学院生物技术研究所提供,纯化后保存至4 ℃冰箱。
1.1.2 供试中度嗜盐菌 21株中度嗜盐菌菌株分离自茶卡盐湖湖水和湖泥样品,由青海大学农林科学院生物技术研究所提供,纯化后保存至4 ℃冰箱。
1.1.3 供试培养基 PDA培养基[17]:马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水定容至1 000 mL,pH 7.0。LB培养基[18]:牛肉膏5.0 g 、蛋白胨10.0 g、NaCl 5 g、蒸馏水定容1 000 mL。
1.2 试验方法
1.2.1 菌株的活化 将分离纯化后的中度嗜盐菌划线接种于LB培养基上,平板倒置放入37 ℃的培养箱中培养1 d。将保存的马铃薯窖藏病原菌青9A-4-13和青9A-5-10接种于PDA培养基,4~7 d 后用6 mm的打孔器在菌落边缘切下菌饼,用小镊子将菌饼接种至PDA培养基,于28 ℃的培养箱中培养5~7 d。
1.2.2 中度嗜盐菌抑制马铃薯干腐病病原菌活性菌株的筛选 采用平板对峙法[19],用6 mm的打孔器在培养7 d的病原菌青9A-4-13和青9A-5-10上打孔,将切下的菌饼置于PDA 培养基中央。同时,以十字划线法,在距离菌落边缘3 cm处上下左右分别点接接种中度嗜盐菌菌株,每处理重复3次,放置于28 ℃的培养箱中培养7 d,观察生长情况,计算抑制率公式为:
抑制率=(C-T)/C×100%
式中:T为处理组菌落直径(mm);C为对照组菌落直径(mm)。
1.2.3 活性菌株稳定性的评价 将初筛得到的活性菌株分别与病原菌对峙培养7 d和14 d后,测量活性菌株的抑菌带宽度,且计算14 d抑菌带宽度缩小率,确定活性菌株的稳定性。计算公式如下:
抑菌带宽度缩小率=(S7-S14)/S7×100%
式中:S7为7 d抑菌带宽度值,S14为14 d抑菌带宽度值。
菌株稳定评价标准:抑菌带宽度缩小率≥70%为不稳定,用“-”表示;50%≤抑菌带宽度缩小率<70%为较不稳定,用“-”表示;20%≤抑菌带宽度缩小率<50%为较稳定,用“+”表示;抑菌带宽度缩小率<20%为稳定,用“++”表示。
1.2.4 中度嗜盐菌萃取物的制备 将活化好的嗜盐菌菌株接入装有800 mL LB液体培养基的锥形瓶中,放置于摇瓶柜中,在37 ℃下,以180 r/min的转速,振荡培养7 d,收获发酵液。分别用正己烷、氯仿、乙酸乙酯和正丁醇挨次对该嗜盐菌菌株发酵液进行等体积萃取,萃取液经减压浓缩,获得不同有机溶剂的萃取物。
萃取物经DMSO(<0.1%)预溶,用无菌水分别将不同萃取物配制成浓度100 mg/mL的萃取物溶液,溶液经无菌滤纸过滤后,备用。
1.2.5 中度嗜盐菌提取物对马铃薯干腐病病原菌的抑制作用 采用生长速率法[20],将4种萃取相溶液加入PDA液体培养基,混合均匀后倒入培养皿中,使其终浓度为2、5、10 mg/mL。用直径6 mm的打孔器切下病原菌菌饼,接种至PDA平板中,置于培养箱中37 ℃恒温培养7 d,每处理重复3次。计算抑制率,公式如下:
抑制率=(C-T)/C×100%
式中:T为处理组菌落直径(mm);C为对照组菌落直径(mm)。
1.2.6 活性菌株形态鉴定 取经活化的菌株,观察菌株生长的菌落形态特征(形状、大小、光泽、隆起形状、透明度、边缘等)及菌体形态特征(包括革兰氏染色、芽孢形态及运动性)对菌株进行形态学鉴定。
1.2.7 活性菌株的生理生化特征 参照《常见细菌系统鉴定手册》[21]以及《伯杰氏细菌鉴定手册(第8版)》[22]对菌株进行革兰氏染色、甲基红、吲哚、厌氧生长、接触酶、糖、醇类发酵、过氧化氢酶、硝酸盐还原、明胶液化等生理生化特征的鉴定。
1.2.8 活性菌株的分子生物学鉴定 活性菌株A10201的DNA提取,采用生工生物工程(上海)股份有限公司的柱式细菌DNA提取试剂盒的程序操作。选择细菌的16S rDNA通用引物F27 (5′-AGAGTTTGATCCTGGCTCAGG-3′)和P1541(5′-AAGGAGGTGGTGATCCAGCCG CA-3′)。PCR 扩增体系:10×Buffer 2.5 μL,dNTP (10 mol/L) 2 μL,模板DNA 1 μL,引物各1 μL,Taq DNA聚合酶0.2 μL,水补足至25 μL。PCR反应条件:94 ℃ 5 min,变性94 ℃ 40 s,退火55 ℃ 45 s,延伸72 ℃ 80 s,35个循环,72 ℃ 10 min。反应结束后,取5 μL PCR产物进行琼脂糖凝胶电泳检测(由生工生物工程(上海)股份有限公司进行测序)。所得到的16S rDNA序列在网站https://www.ezbio cloud.net/上进行序列对比,通过MEGA 7.0软件,构建系统发育树。
2 结果与分析
2.1 中度嗜盐菌抑制马铃薯干腐病病原菌活性菌株的筛选
采用平板对峙法,对21株中度嗜盐菌抑制马铃薯干腐病病原菌的活性进行测定。结果显示,其中有9株嗜盐菌对马铃薯干腐病病原菌具有较高的抑制活性,菌株A10201和A20105对病原菌均表现出较强的抑制作用(表1)。在平板对峙7 d后,菌株A10201对青9A-4-13、青9A-5-10的抑制率分别为41.74%和50.93%,菌株A20105对青9A-4-13、青9A-5-10抑制率分别为50.73%和52.37%,该两株嗜盐菌的抑制效果较其他嗜盐菌显著。比较该两种嗜盐菌对马铃薯干腐病病原菌青9A-4-13、青9A-5-10的抑制率发现,嗜盐菌对青9A-5-10的整体抑制率更高,将青9A-5-10作为靶标病原菌。
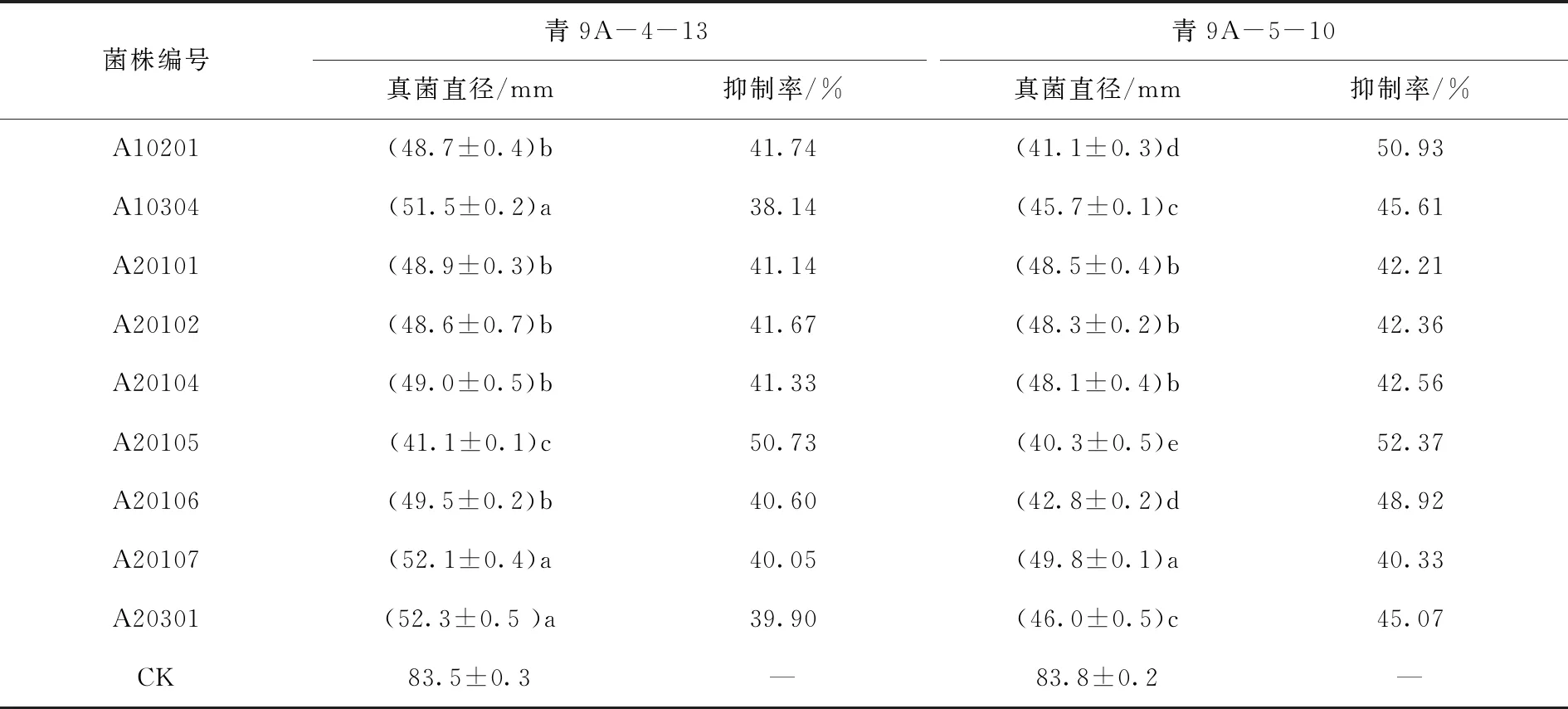
表1中度嗜盐菌对马铃薯干腐病病原菌的抑制活性Tab.1 Inhibitory activity of moderate halophiles on the pathogenic bacteria of potato dry rot
2.2 中度嗜盐菌抑制稳定性评价
通过抑菌活性的初筛,得到两株抑菌活性最高的拮抗菌,为了确定它们抑菌活性的稳定性,进行复筛和抑制作用稳定性的评价,结果如表2所示。从表2可知,菌株A20105虽然具有较高的抑制活性,但抑制稳定性表现较差,在第14天时抑菌带宽度缩小率为63.04%,而菌株A10201在第14天时抑菌带宽度缩小率为13.94%,表现出更高的稳定性。因此,在活性菌株形态鉴定以菌株A10201为主。
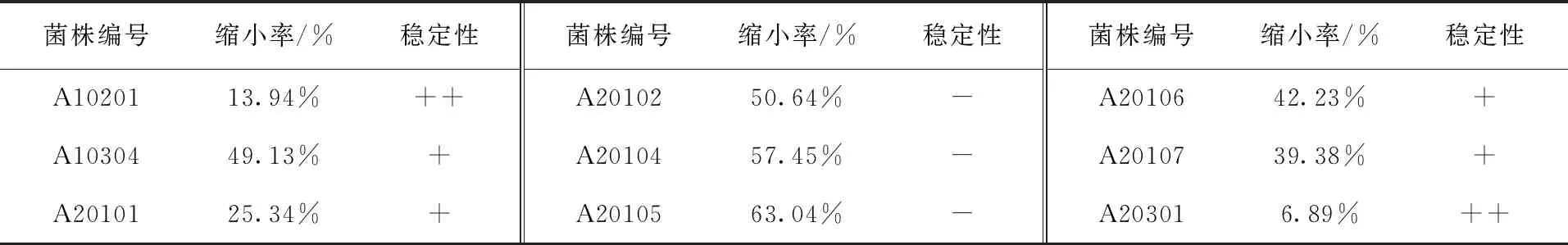
表2中度嗜盐菌对马铃薯病原菌青9A-5-10抑制稳定性Tab.2 Inhibition stability of moderate halophiles on potato pathogens Qing 9A-5-10
2.3 菌株A10201和A20105发酵液萃取物抑菌作用
表3为生长速率法对发酵液萃取物的抑菌作用测定结果,从表3可知,菌株A10201和A20105的发酵液萃取物对指示病原菌均有抑制活性。随着发酵液萃取物浓度的升高,病原菌菌落半径逐渐减小,而对病原菌抑菌率升高,在10 mg/mL浓度下时均达到最高的抑制率。其中,在10 mg/mL浓度下,菌株A10201的乙酸乙酯、正己烷、氯仿、正丁醇萃取物对病原菌的抑菌率分别达71.10%、46.59%、71.60%、78.57%。菌株A20105在10 mg/mL浓度下,乙酸乙酯、正己烷、氯仿、正丁醇萃取物对病原菌的抑菌率达62.50%、38.34%、67.44%、79.85%。结果均表明正丁醇萃取物的抑菌活性最高。
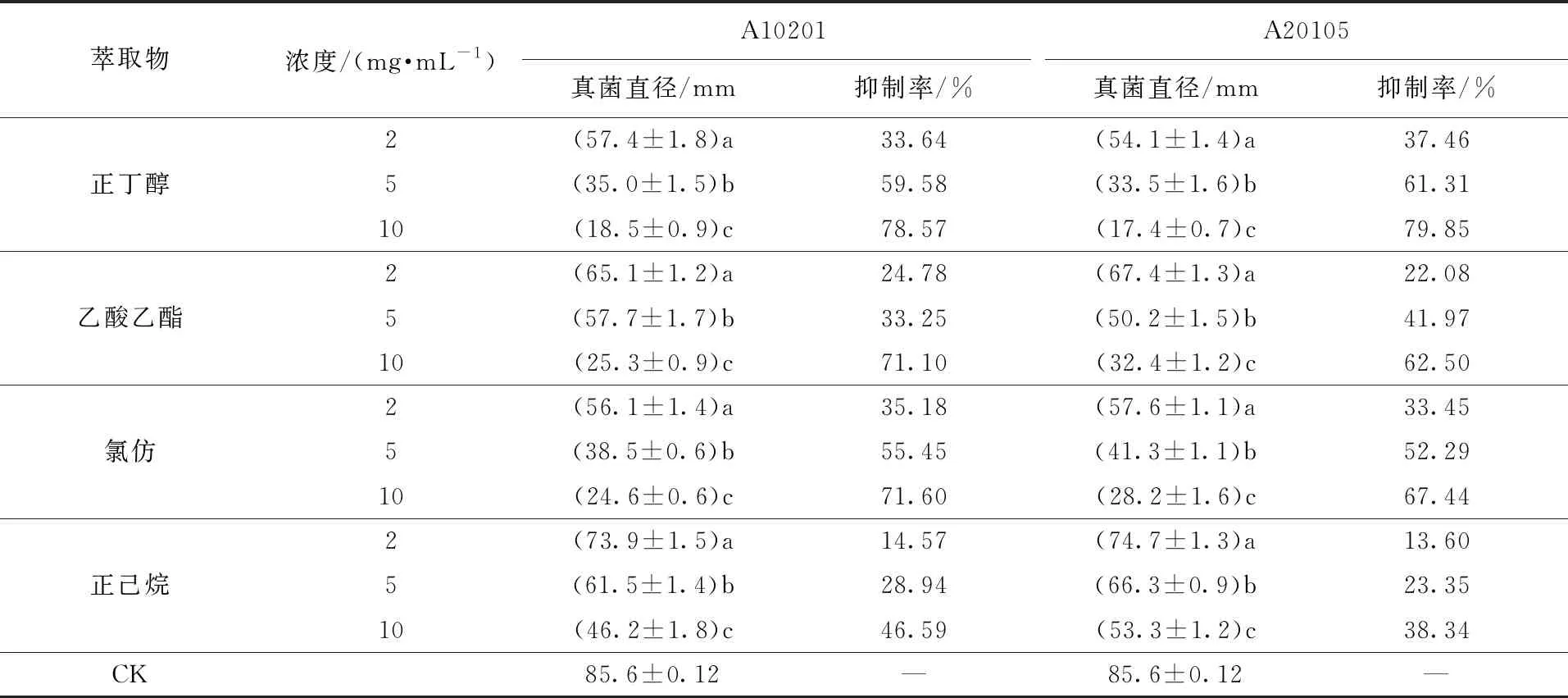
表3中度嗜盐菌发酵液提取物对马铃薯病原菌青9A-5-10的抑制率Tab.3 Inhibition rate of broth extracted from moderate halophiles on potato pathogens Qing 9A-5-10
2.4 菌株A10201的鉴定
2.4.1 菌株A10201的形态学鉴定 在 LB 固体培养基平板上,A10201菌落呈乳白色,边缘不整齐,直径2~6 mm,细胞呈杆状,能在20~ 41 ℃条件下生长,革兰氏染色呈阳性菌(图1)。
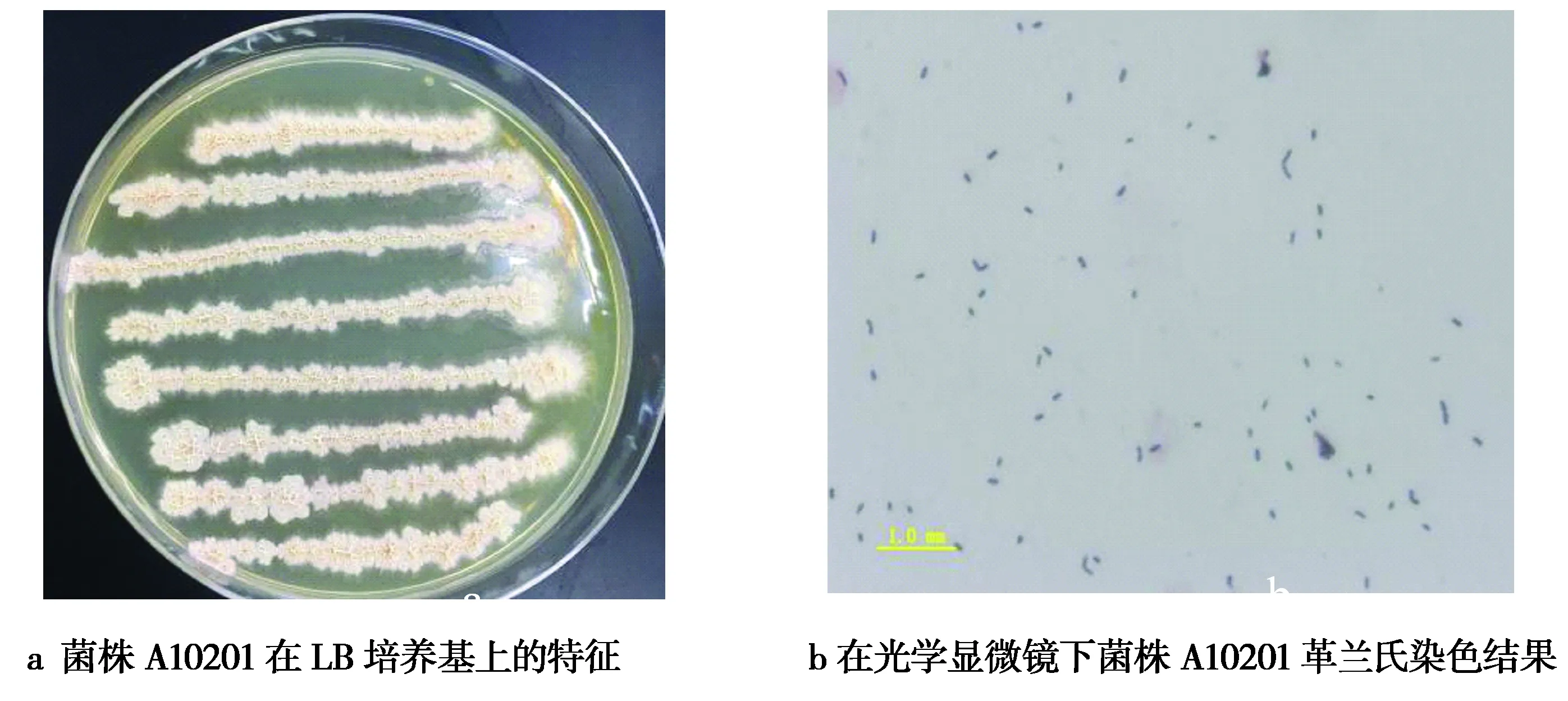
图1 菌株A10201的培养性状及革兰氏染色特征Fig.1 Culturural characteristics and Gram staining characteristics of strain A10201
2.4.2 菌株A10201的生理生化特征 菌株A10201的生理生化特征结果如表4所示。

表4菌株A10201的生理生化特性Tab.4 Physiological-biochemical characteristics of strain A10201
由表4可知,革兰氏染色、硝酸盐还原试验、过氧化氢酶试验、厌氧生长试验、接触酶试验、明胶液化试验、乙酰甲基甲醇试验、甲基红试验、淀粉水解试验呈阳性,柠檬酸盐、吲哚、溶菌酶试验呈阴性。此外,菌株A10201能利用葡萄糖、果糖、蔗糖,但不能利用乳糖。
2.4.3 菌株A10201的分子生物学鉴定及其系统发育树的构建 将菌株A10201测序得到的16S rDNA序列提交至网址(https://www.ezbiocloud.net/)与数据库中已知的16S rDNA序列进行比较,并下载与菌株A10201的16S rDNA序列同源性大于95%的序列,使用Mega(7.0)软件,根据Neighbor-Joining方法构建系统发育树(图2)。结合菌株A10201的形态特征、生理生化特征和16S rDNA序列分析结果,最终将菌株A10201鉴定为地衣芽孢杆菌(Bacilluslicheniformis),Genbank登录号为MF157551。
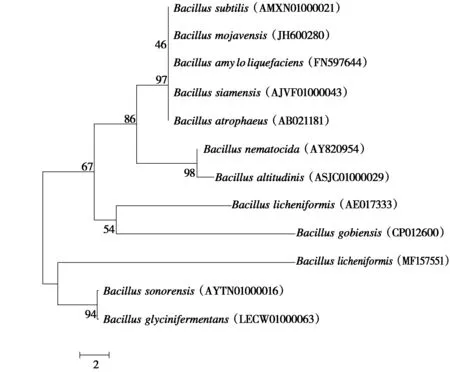
图2 菌株A10201基于16S rDNA序列的系统发育树Fig.2 Phylogenetic tree of strain A10201 based on 16S rDNA sequence
3 结论与讨论
随着大量微生物农药的开发与应用,生物防治已成为一个热门的研究领域[23]。本研究经过抑菌活性初筛,得到两株对马铃薯干腐病具有较高抑制活性的中度嗜盐菌菌株A10201和A20105。稳定性评价结果显示,菌株A10201的稳定性更高,更具有应用价值。经鉴定,菌株A10201为地衣芽孢杆菌(Bacilluslicheniformis),地衣芽孢杆菌属于枯草芽孢杆菌近缘种[24-25],芽孢杆菌是一种存在广泛的非致病生防菌,对人畜健康,环境适应力强,极具生防潜力。由于其性能稳定、易于贮存是真菌病害防治中应用最多的生防微生物。
本研究通过发酵萃取试验得出正丁醇相萃取物对指示病原菌抑菌作用最好,在10 mg/mL浓度下抑菌率达78.57%。其抑菌机理可能是在代谢过程中产生大量抗菌物质,如抗菌蛋白、几丁质酶等[26],该类蛋白类物质主要作用于致病菌的细胞壁、细胞膜,所以在真菌类病害上的应用较多[27]。或者,地衣芽孢杆菌产生拮抗作用,与病原菌竞争营养与空间等来抑制病原菌的生长,并诱导寄主植物本身产生抗性以及对寄主植物的促生作用等。由此可知,地衣芽孢杆菌A10201的抑菌机理还有待进一步研究。同时,研究结果表明该地衣芽孢杆菌A10201对马铃薯干腐病具有较强抑制作用,对环境适应能力强,具有较强的生防效果。此研究结果将为防止马铃薯窖藏病害和马铃薯保鲜制剂的开发提供科学理论依据和技术支持。

