长颚斗蟋长翅和短翅型雄成虫营养物质的积累与分配差异
曾 杨,张 斌,贺一原,赵 鑫,朱道弘
(中南林业科技大学昆虫行为与进化生态学实验室,长沙 410004)
飞行能力的获得使昆虫在觅食、求偶、扩散及逃避敌害等方面的效率大大提高,无疑是昆虫如此繁盛的主要原因之一(Roff,1986)。然而,在许多种类昆虫中均发现翅的退化现象,其中,翅多型现象极为典型,即同种昆虫中部分个体拥有飞行能力,为长翅或有翅型;而部分个体的飞行能力丧失,为短翅或无翅型。翅多型现象在直翅目、膜翅目、同翅目等10多目昆虫中均有报道,包括一些重要的农林害虫,如蚜虫、褐飞虱、蝽类等(张增全,1983;刘树生和吴晓晶,1994;张保常和赵章武,2009;朱道弘,2009;Xuetal.,2015)。
研究表明,飞行能力的退化使昆虫在其他生活史特征上的获益得到提高,包括若虫发育、成虫的繁殖能力和寿命等方面,其中,繁殖能力的提高已被许多研究所证实(Roff,1990;Zera and Denno,1997)。对雌虫而言,不具飞行能力的短翅或无翅型雌虫的繁殖器官发育成熟时间要早于具飞行能力的长翅或有翅型,且前者总的繁殖能力亦显著高于后者。如一种螽斯Eobianaengelhardtisubtropica,短翅型雌成虫的产卵前期显著短于长翅型;且短翅型的产卵量亦显著高于长翅型(Ando and Higaki,2003)。而对于雄虫的研究结果则较为复杂,一些种类如灰飞虱Laodelphaxstriatellus(Mishiroetal.,1994)和丽斗蟋Velarifictorusornatus(Zhaoetal.,2010)两型雄虫的精巢和繁殖附腺发育并无明显差异,而另一些种类如曲脉姬蟋Modicogryllusconfirmatus(Tanaka,1999)和始红蝽Pyrrhocorisapterus(Socha and Sula,2008)短翅型雄虫的繁殖器官发育要快于长翅型。另外,有研究证实短翅型雄虫在繁殖行为方面优势更高,如沙蟋Gryllusfirmus短翅型雄虫发出求偶声的比例高于长翅型,从而获得更多的交配机会(Mitraetal.,2011);钻形蚱Tetrixsubulata短翅型雄虫的单次交配持续时间显著长于长翅型(Steenmanetal.,2015)。因此,翅多型昆虫可在不同环境条件下羽化为不同翅型成虫,兼顾扩散与快速繁殖的优势,增加了对变化生境的适应能力。
虽然飞行和繁殖间的权衡关系已被许多研究所证实,但这种权衡的生理机制尚未明了。一些学者通过比较两型雌虫体内的主要营养物质成分,发现两型雌虫体内不同营养物质的积累和分配存在显著差异。如沙蟋G.firmus长翅型雌虫体内脂类物质的含量较高,而短翅型雌虫体内糖类物质含量更高(Zeraetal.,1994)。丽斗蟋V.ornatus长翅型雌虫在羽化后早期优先将营养物质分配在飞行肌的发育,而短翅型雌虫则主要将营养物质分配于卵巢的发育(赵吕权等,2012)。进一步的研究表明,这种营养物质的合成与分配差异受保幼激素所调控,如沙蟋G.firmus长翅型雌虫在保幼激素浓度较低时,体内合成较多的甘油三酯,而保幼激素浓度升高则导致磷脂的合成代谢增加(Zhao and Zera,2002);保幼激素浓度升高导致丽斗蟋V.ornatus在卵巢发育上的营养物质分配增加,相反,降低保幼激素浓度则抑制其在卵巢发育方面的营养物质投入(赵吕权等,2012)。这些研究结果为揭示飞行和繁殖权衡的生理机制提供了重要信息。虽然许多研究表明短翅型雄虫在繁殖方面的优势显著高于长翅型,但雌虫和雄虫在繁殖方面的能量投入存在明显差异。一方面,雌虫繁殖器官发育所需的能量远高于雄虫。如丽斗蟋V.ornatus雌虫卵巢发育成熟后可重达100 mg,约占总体重的40%,而雄虫精巢和附腺发育成熟后总重约30 mg,占总体重的15%左右(Zhaoetal.,2010)。另一方面,雄虫通常在繁殖行为方面需投入较多的能量,包括求偶鸣叫、争夺雌虫的打斗行为、抱对行为及多次交配等。这种两性间繁殖投入的能量差异可能导致雌雄虫在营养物质的合成和分配方面不一致,其调控机制亦可能存在差异。然而,目前对于雄虫飞行和繁殖权衡的生理机制研究较少,对上述科学问题尚未解答。
长颚斗蟋Velarifictorusaspersus在我国分布广泛,其成虫具翅二型现象,若虫在长光周期和较高温度条件下羽化成虫的长翅型比例较高,而短光周期和较低温度条件下短翅型成虫比例较高(曾杨等,2010)。长翅型雌虫在成虫早期阶段快速发育飞行肌,短翅型雌虫则快速发育卵巢,其产卵前期显著短于长翅型,且产卵量显著高于长翅型(曾杨等,2012)。长翅型雌虫体内总脂含量显著高于短翅型,且优先将营养物质分配于飞行肌的发育,而短翅型雌虫则主要将营养物质分配于卵巢的发育(康乙玲,2019)。同期内,长翅型雄虫亦快速发育飞行肌,而短翅型雄虫则快速发育繁殖附腺,且短翅型雄虫的求偶鸣叫次数和多次交配能力显著高于长翅型,在配偶争夺的打斗中短翅型雄虫的获胜率亦显著高于长翅型(Zeng and Zhu,2012;Zengetal.,2016)。显然,长颚斗蟋短翅型雌雄虫在繁殖方面的能量投入存在差异,因此,为解析这种差异是否会导致雄虫在营养物质的积累和分配方面出现改变,本研究检测了羽化后一周内两型雄成虫虫体及飞行和繁殖器官内的蛋白质、总脂和糖原含量,分析了雄虫在营养物质积累与分配方面是否存在飞行与繁殖的权衡关系,研究结果将为揭示雄虫飞行与繁殖权衡的生理机制提供初步证据。
1 材料与方法
1.1 供试昆虫
长颚斗蟋供试昆虫来源于2009年8月下旬采自海南省海口市郊区林地的成虫,于实验室人工气候室(宁波江南仪器厂,GX-HE302-300)内光周期为16L∶8D,温度为25℃的条件下饲养所建立的人工种群。饲养方法参照曾杨等(2010),新孵化的若虫以50头/容器,饲养于塑料容器(长×宽×高=13 cm×13 cm×8.5 cm) 内,容器顶部开孔,并粘以纱网,利于通风和透光,并防止昆虫逃跑。容器内放置一定数量的折叠滤纸,以增加蟋蟀的活动空间。以昆虫饲料(Oriental Yeast Co.,日本) 饲养,并辅以胡萝卜片,饲料每2 d更换1次,确保食物充足及新鲜。每个容器内放入一装满水的塑料管(直径4.3 cm,长5.5 cm),塞以脱脂棉,作为蟋蟀的水源,每5 d换水1次。待若虫生长至末龄阶段,每天检查成虫羽化情况,将不同翅型的羽化雄成虫分别放置不同容器饲养,提供充足的食物(昆虫饲料+胡萝卜片)和水,作为后续实验虫源。由于两型雄虫在羽化后早期阶段飞行和繁殖器官发育方面的差异较为明显,且长翅雄虫在羽化10 d后开始降解飞行肌并脱翅(Zeng and Zhu,2012),因此,本研究选取了羽化后7 d内的两型雄成虫作为研究材料。
1.2 翅二型雄成虫虫体内总脂、糖原和蛋白质含量的检测
为使两型雄成虫的体型大小一致,实验开始前用游标卡尺对雄成虫的头幅进行测量,分别取羽化后1,3,5和7 d头幅相近(头幅宽度差小于5%)的长、短翅雄成虫各20头,以电子天平(梅特勒-托利多仪器,AL104)称量其鲜重,而后,置于干燥箱(天津泰斯特仪器有限公司,WGL-125B)内,于100℃温度条件下烘干24 h后称其干重。烘干后的整虫置于离心管内加缓冲液捣碎,参照赵吕权等(2012) 的方法提取总脂、糖原和蛋白质。蛋白质采用考马斯亮蓝法测定:取待测样品加入PBS溶液定容至1 mL,再加入1 mL考马斯亮蓝溶液混合均匀,常温下静置10 min,于分光光度计585 nm处测定其吸光度,以牛血清为标准样品制作标准曲线,计算样品中蛋白质含量。总脂采用磺基磷酸香醛素方法(sulphophosphovanillin method)测定(Lorenz,2003):取待测样品加入正己烷定容至1 mL,再加入85%浓硫酸1 mL于100℃的水浴锅(上海皓庄仪器有限公司,NDK-24W)中煮沸10 min,常温冷却后再加入5 mL磷酸香草醛溶液,于分光光度计530 nm处测定其吸光度,以胆固醇为标准样品制作标准曲线,计算样品中脂类含量。糖原采用蒽酮法测定:取待测样品加入1 mL蒽酮溶液于100℃的水浴锅中煮沸10 min,常温冷却后在分光光度计630 nm处测定其吸光度,以葡萄糖为标准样品制作标准曲线,计算样品中糖原含量,设置20个重复。
1.3 翅二型雄成虫飞行肌与繁殖器官内总脂、糖原和蛋白质含量的检测
分别取羽化后1,3和7 d 头幅相近的长、短翅雄成虫各10头置于-20℃的冰箱冷冻24 h(冷冻处理使飞行肌极易剥离)。常温下解冻5 min后对成虫进行解剖,小心取出雄成虫的精巢、附腺和飞行肌。组织样品按1.2节中的方法提取和测定总脂、糖原和蛋白质。
1.4 数据分析
利用SPSS13.0软件进行数据分析。数据均以平均值±标准误表示;日龄对雄虫体重及各营养物质含量的影响采用单因素方差分析(ANOVA),长、短翅型雄虫间的数据差异显著性比较采用t检验法。
2 结果
2.1 翅二型雄成虫体重变化的差异
对羽化后1,3,5和7 d翅二型长颚斗蟋雄成虫的体重鲜重和干重称量结果如图1所示。成虫羽化后第1天,长翅雄成虫的鲜重和干重均略高于短翅雄成虫,但无显著性差异(P>0.05,t检验)。羽化后3 d内长翅雄成虫的体重有所增加,而后略有下降,统计分析表明不同日龄长翅雄成虫的体重无显著差异(ANOVA,鲜重:F=0.18,P=0.91;干重:F=0.03,P=0.99)。而短翅雄成虫在羽化后7 d内鲜重和干重均显著增加(ANOVA,鲜重:F=2.80,P=0.04;干重:F=5.03,P=0.003)。
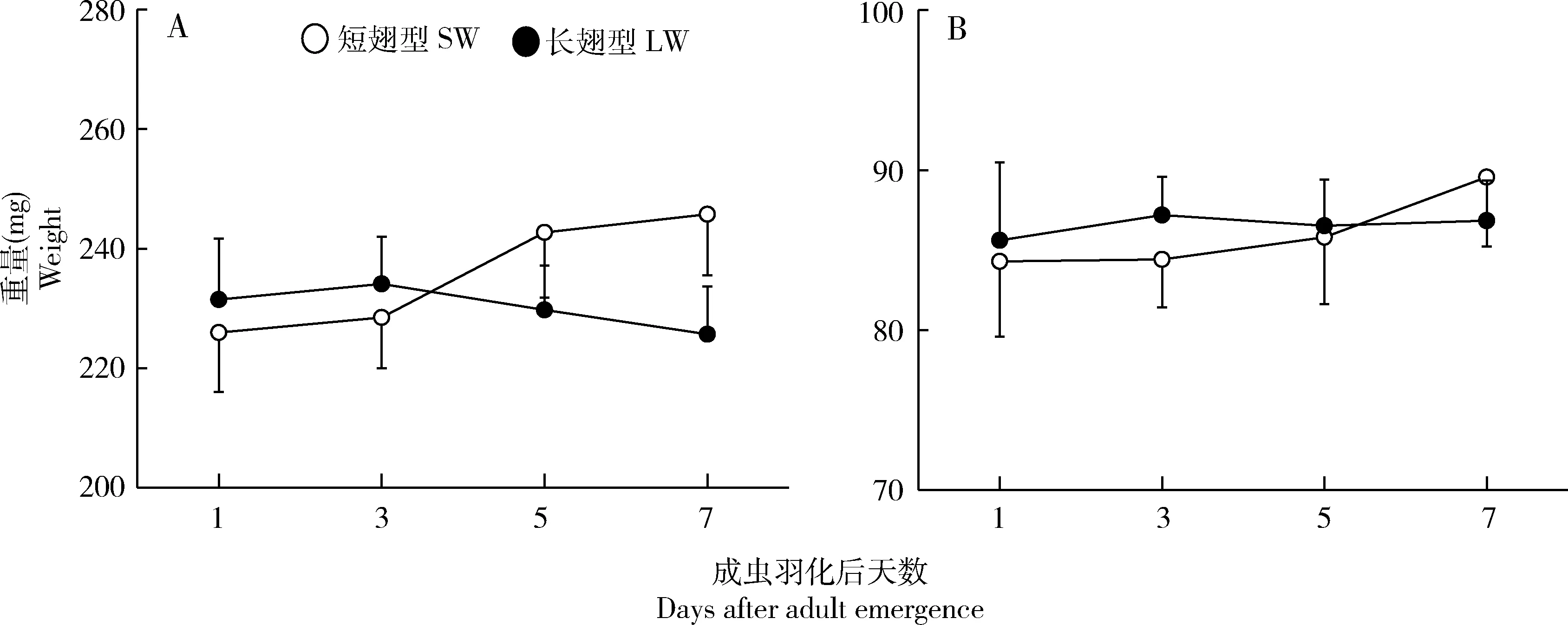
图1 长翅和短翅型长颚斗蟋雄成虫羽化后鲜重(A)和干重(B)的动态变化Fig.1 Temporal changes in fresh weight (A) and dry weight (B) in the long-winged (LW)and short-winged (SW) male adults of Velarifictorus aspersus图中数据为平均值±标准误(n=20)。Data in the figure are mean±SE (n=20).
2.2 翅二型雄成虫体内蛋白质、总脂、糖原绝对含量的差异
对羽化后1,3,5和7 d翅二型长颚斗蟋雄成虫蛋白质、总脂、糖原含量的检测结果如图2所示。羽化后5 d内,长翅雄成虫体内的蛋白质含量显著增加,随后基本维持稳定(ANOVA,F=3.70,P=0.02),而短翅雄成虫体内的蛋白质含量在羽化后的7 d内缓慢增加,但各日龄间无显著差异(ANOVA,F=0.44,P=0.72)。对长、短翅雄成虫间的比较分析表明,各日龄长翅雄成虫体内的蛋白质含量均显著高于短翅雄成虫(P<0.05,t检验)。与蛋白质含量的检测结果相反,羽化当日长、短翅雄成虫体内的总脂含量无显著差异(P>0.05,t检验)。羽化后3 d内长翅雄成虫体内的总脂含量显著上升(ANOVA,F=4.61,P=0.005),随后基本维持恒定;而短翅雄成虫体内的总脂含量在羽化后逐渐增加(ANOVA,F=14.77,P<0.001),在羽化后的第5和7天,短翅雄成虫体内的总脂含量均显著高于长翅雄成虫(P<0.05,t检验)。两型雄虫羽化后体内糖原的含量均略有上升,但各日龄间无显著差异(ANOVA,短翅型:F=0.42,P=0.73;长翅型:F=0.95,P=0.42),且相同日龄的不同翅型雄成虫间亦无显著差异(P>0.05,t检验)。
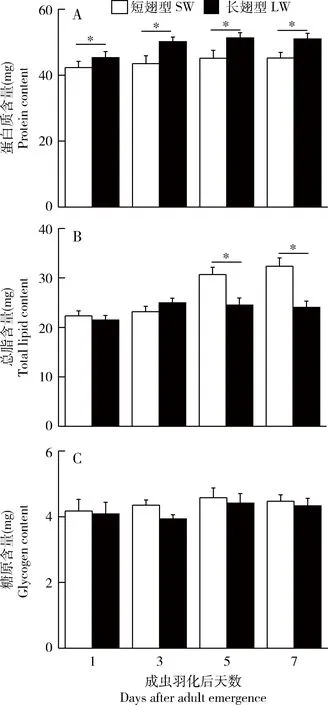
图2 长翅和短翅型长颚斗蟋雄成虫羽化后体内蛋白质(A)、总脂(B)和糖原(C)含量的动态变化Fig.2 Temporal changes in the contents of proteins (A),total lipids (B) and glycogen (C) in the long-winged (LW)and short-winged (SW) male adults of Velarifictorus aspersus after emergence图中数值为平均值±标准误(n=20);柱上星号代表不同翅型间存在显著差异(P<0.05,t检验)。Data in the figure are mean±SE (n=20).The asterisk above bars indicates significant difference between these two wing morphs (P<0.05,t-test).
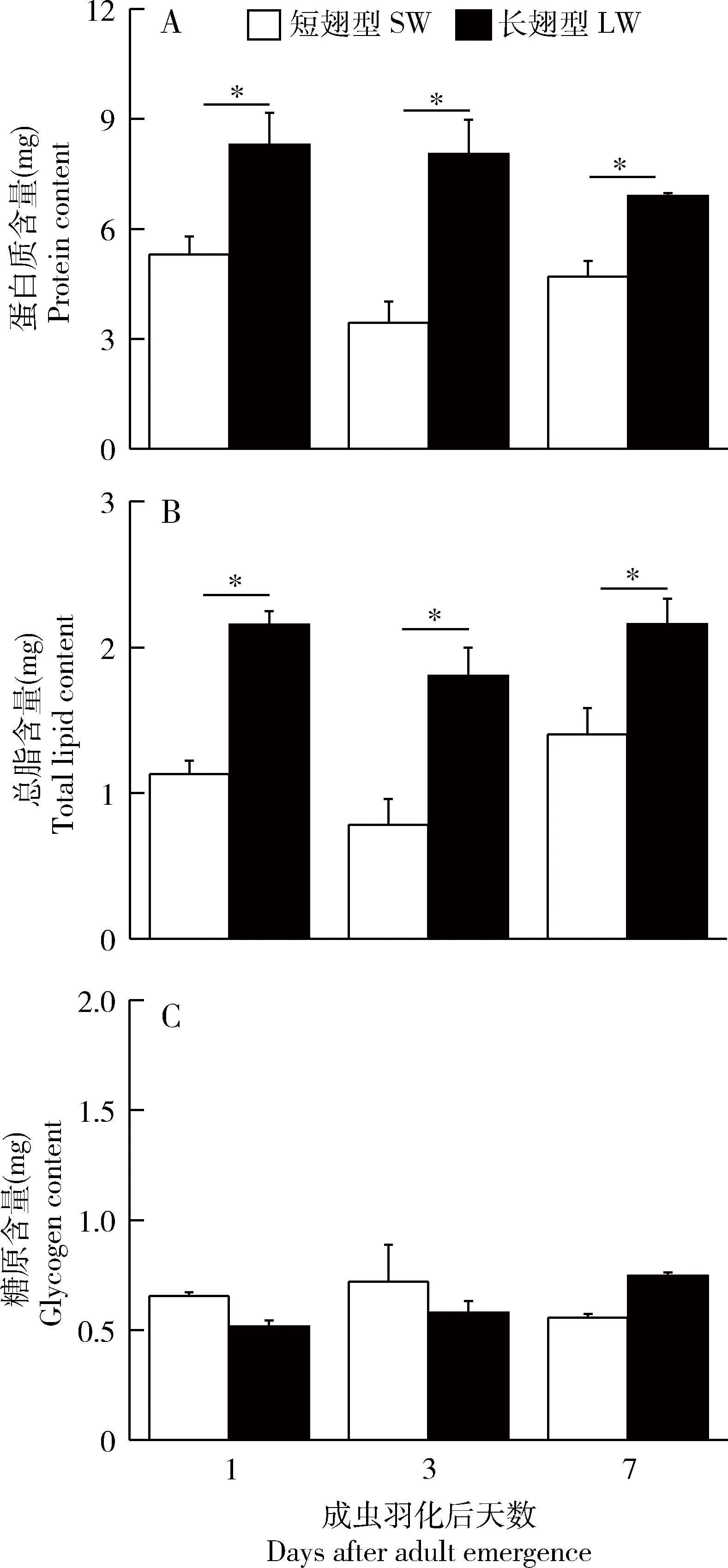
图3 长翅和短翅型长颚斗蟋雄成虫羽化后飞行肌内蛋白质(A)、总脂(B)和糖原(C)含量的动态变化Fig.3 Temporal changes in the contents of proteins (A), total lipids (B),and glycogen (C) in flight muscles of the long-winged (LW) and short-winged (SW) male adults of Velarifictorus aspersus after emergence图中数值为平均值±标准误(n=10);柱上星号代表不同翅型间存在显著差异(P<0.05,t检验)。Data in the figure are mean±SE (n=10).The asterisk above bars indicates significant difference between these two wing morphs (P<0.05,t-test).图4和5同The same for Figs.4 and 5.
2.3 翅二型雄成虫飞行肌内蛋白质、总脂和糖原含量的差异
对羽化后1,3和7 d翅二型雄成虫飞行肌内蛋白质、总脂、糖原含量的测定结果如图3所示。羽化后第1天,长翅雄成虫飞行肌内的蛋白质含量为8.29±0.87 mg,而短翅雄成虫飞行肌内的蛋白质含量为5.30±0.49 mg,统计分析表明,长翅雄成虫飞行肌内的蛋白质含量显著高于短翅型(P<0.001,t检验,t=-4.32)。羽化后第3和7天,长翅雄成虫飞行肌内的蛋白质含量亦显著高于短翅雄成虫(P<0.05,t检验)。与蛋白质含量的检测结果相似,长翅雄成虫飞行肌内的总脂含量在成虫羽化后前7 d内均显著高于短翅型(P<0.05,t检验),但两型雄成虫飞行肌内糖原的含量无显著性差异(P>0.05,t检验)。
2.4 翅二型雄成虫精巢和附腺内蛋白质、总脂、糖原含量的差异
对羽化后1,3和7 d翅二型雄成虫精巢内蛋白质、总脂和糖原含量的检测结果显示,两型雄成虫精巢内的蛋白质在羽化后前7 d均无显著变化(ANOVA,短翅型:F=2.24,P=0.12;长翅型:F=3.03,P=0.06),且各日龄两型雄成虫间均无显著差异(P>0.05,t检验)(图4:A)。而总脂和糖原的含量在羽化后显著增加(ANOVA,P<0.05),但两型雄成虫间无显著差异(P>0.05,t检验)(图4:B,C)。羽化后第1天,两型雄成虫附腺内蛋白质和总脂的含量无显著性差异(P>0.05,t检验);羽化后7 d内两型雄成虫附腺内蛋白质和总脂的含量均显著增加(ANOVA,P<0.05),但短翅雄成虫的增加速率高于长翅雄成虫,羽化后第3和第7天,短翅雄成虫附腺内的蛋白质和总脂含量均显著高于长翅雄成虫(P<0.05,t检验)(图5:A,B)。羽化后第1和3天,短翅雄成虫附腺内糖原的含量亦显著高于长翅雄成虫(P<0.05,t检验)(图5:C)。

图4 长翅和短翅型长颚斗蟋雄成虫羽化后精巢内蛋白质(A)、总脂(B)和糖原(C)含量的动态变化Fig.4 Temporal changes in the contents of proteins (A), total lipids (B),and glycogen (C) in testes of the long-winged (LW) and short-winged (SW) male adults of Velarifictorus aspersus after emergence
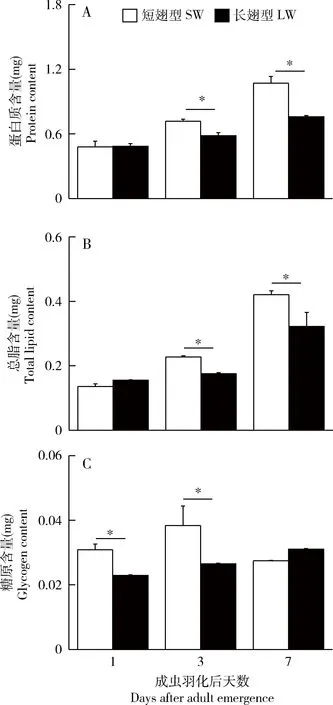
图5 长翅和短翅型长颚斗蟋雄成虫羽化后附腺内蛋白质(A)、总脂(B)和糖原(C)含量的动态变化Fig.5 Temporal changes in the contents of proteins (A), total lipids (B),and glycogen (C) in accessory glands of the long-winged (LW) and short-winged (SW) male adults of Velarifictorus aspersus after emergence
3 讨论
翅二型昆虫在成虫早期阶段的生活史策略存在差异,即长翅成虫飞行扩散,短翅成虫快速繁殖。许多研究表明,短翅雌成虫羽化后体重快速增加,为繁殖发育提供充足的营养物质,而长翅成虫羽化后体重增加缓慢,使飞行更为节约能量(Zera and Denno,1997;Ando and Higaki,2003)。Crnokrak和Roff(1995)对翅二型沙蟋Gryllusfirmus雄虫的研究结果亦表明,短翅雄虫在羽化后7 d内体重的增加显著高于长翅雄虫。与上述研究结果相似,长颚斗蟋翅二型雄虫在羽化后早期阶段体重的变化趋势存在差异,短翅雄虫的体重在羽化后7 d内显著增加,而长翅雄虫的体重基本保持一致(图1)。两型成虫体重变化的差异性可能来源于两方面的原因:其一,长翅成虫具有发达的飞行肌,因而需消耗更多的营养物质以维持飞行肌。如Zera和Mole(1994)的研究证实,长翅型蟋蟀的呼吸代谢显著高于短翅型,因此短翅型成虫的食物转化率要高于长翅型。其二,翅二型成虫所摄取的食物量存在差异。本课题组曾证实长颚斗蟋长翅型雄虫的取食量要显著低于短翅型(Zengetal.,2014)。对两种翅二型蟋蟀G.rubens和G.firmus成虫取食量和体重的比较发现,G.rubens两型成虫的取食量无差异,而长翅型G.firmus的取食量显著高于短翅型,导致G.rubens短翅型成虫的体重显著高于长翅型,而G.firmus两型成虫的体重无差异(Zera and Mole,1994)。
脂类和糖是动物体内主要的能源物质,其中,脂类是许多直翅目昆虫种类飞行的主要燃料物质(Rankin and Burchsted,1992)。由于长翅型成虫在羽化后需合成大量的飞行能源物质,因此,其体内的总脂含量应高于短翅型,如蟋蟀G.firmus长翅雄虫体内的总脂含量显著高于短翅雄虫(Zeraetal.,1994)。然而本研究中,长颚斗蟋两型雄虫在羽化后第1天体内总脂含量并无显著差异,但短翅雄虫在羽化后总脂含量的增加显著高于长翅型(图2:B),说明长颚斗蟋两型雄虫在若虫期所合成的脂类物质总量相近,但短翅雄虫在成虫期所合成的脂类物质总量要高于长翅型,这与Zera等(1994)的研究结论相反。这可能与不同种类昆虫的飞行能力存在差异有关。如蟋蟀G.rubens在人工吊飞数小时后,长翅型成虫仍未转向繁殖(Zera and Rankin,1989);而5 min的人工吊飞即可显著促进蟋蟀G.texensis长翅型成虫的繁殖发育,从而由飞行阶段转入繁殖阶段(Guerra and Pollack,2009)。并且,对野外捕获的不同种类翅二型蟋蟀的长翅型成虫卵巢发育检测结果与实验室人工吊飞一致(Bertram,2007;Zeraetal.,2007)。长颚斗蟋长翅成虫在进行人工吊飞30 min即由飞行转向繁殖(Zengetal.,2014),属于飞行能力较弱的种类,因此其体内合成的飞行能源物质可能较少。而长颚斗蟋短翅雄虫在繁殖行为方面的能量投入显著高于长翅型,包括求偶鸣叫、配偶争夺的打斗行为以及多次交配行为(Zeng and Zhu,2012;Zengetal.,2016),从而导致短翅雄虫体内总脂的含量更高。
长颚斗蟋翅二型雄虫不仅体内的能源物质含量存在显著差异,蛋白质的含量亦明显不同,羽化后第1天长翅雄虫体内的蛋白质含量显著高于短翅雄虫,且羽化后7 d内长翅雄虫体内的蛋白质含量增加亦显著高于短翅雄虫(图2:A),说明长颚斗蟋长翅型雄虫较短翅型雄虫不仅在若虫期合成更多的蛋白质,且成虫阶段亦需合成更多的蛋白质。对于长翅雄虫而言,发达的飞行肌是飞行所必需的器官,因而需要更多的蛋白质以构建肌蛋白。而Zera等(1994)对沙蟋的研究结果表明,长、短翅雌虫体内的蛋白质含量并无差异。对于雌虫而言,长翅雌虫发达的飞行肌内拥有大量蛋白质,但短翅雌虫在卵巢发育亦需大量蛋白质,因而体内的总蛋白质含量在不同翅型间并无差异。而雄虫的繁殖器官发育所需要的蛋白质远低于雌虫,如Socha和Sula(2008)对翅二型P.apterus的研究表明,羽化后5-14 d内长翅雌、雄成虫飞行肌内的蛋白质含量约400 μg,而同期内短翅雌虫卵巢内蛋白质含量亦在400~600 μg间,但短翅雄虫附腺内蛋白质的含量仅约100 μg,从而导致长翅雄虫体内总蛋白的含量高于短翅雄虫。
长颚斗蟋长翅雄虫飞行肌内的蛋白质、总脂的含量显著高于短翅型(图3),这与对其他翅二型昆虫的研究结果一致。如丽斗蟋长翅雌、雄成虫飞行肌内的蛋白质和甘油三脂均显著高于短翅成虫(赵吕权等,2012)。Socha和Sula(2008)对翅二型P.apterus的研究亦表明,长翅雌、雄成虫飞行肌内的蛋白质含量显著高于短翅成虫。由于长翅成虫具备飞行能力,因而需要大量的蛋白质以构建发达的飞行肌,同时,高含量的脂类可为飞行提供能源。雄性蟋蟀的繁殖器官包括精巢和附腺,长颚斗蟋两型雄虫精巢内蛋白质、总脂和糖原的含量均无显著差异,但附腺内的蛋白质、总脂和糖原含量均显著高于长翅雄成虫(图4和5)。对翅二型P.apterus雄成虫附腺和精巢内蛋白质含量的比较结果亦证实短翅雄成虫附腺内蛋白质的含量显著高于长翅雄成虫(Sochaetal.,2004)。上述结果说明短翅雄成虫优先将营养物质投资于繁殖器官的发育。
本研究证实了长颚斗蟋翅二型雄成虫在羽化后早期阶段,体内营养物质的积累和分配存在明显差异。长翅雄虫需合成较多的蛋白质用于发育飞行器官,而短翅雄虫则优先将营养物质分配于繁殖器官发育。有意思的是,短翅雄虫体内的脂肪含量高于长翅型,笔者推测可能由于长颚斗蟋长翅成虫飞行能力较弱所导致,虽然一些研究发现不同种类翅二型昆虫的长翅型成虫飞行能力存在差异,但不同飞行能力的长翅型成虫是否在营养物质的合成方面存在差异尚无直接证据。单次连续飞行时间是衡量昆虫飞行能力的重要指标,笔者已对长颚斗蟋成虫的飞行能力进行了初步调查,发现多数长翅成虫单次连续飞行的时间较短(1~10 min),而少部分长翅成虫连续飞行的时间长于30 min(未发表数据),因此,下一步将对不同飞行能力长翅成虫体内营养物质的合成进行检测,以验证上述推测。

