昆虫抗药性相关细胞色素P450基因的表达调控机制
朱 江,邱星辉
(1.中国科学院动物研究所,农业虫害鼠害综合治理研究国家重点实验室,北京100101;2.中国科学院大学,北京100049)
人类为防治害虫,相继研发了有机氯、有机磷、氨基甲酸酯、拟除虫菊酯、新烟碱以及二酰胺类等杀虫药剂。不同类型的杀虫剂在植物保护和虫媒疾病控制方面发挥重要作用的同时,也对地球上的生物带来了新的压力。昆虫作为自然界种类极其丰富的生物类群,为应对杀虫剂选择压,进化出多样化的抗药性机制,主要包括行为改变(行为抗性)、靶标的不敏感性(靶标抗性)、杀虫剂表皮穿透能力下降(穿透抗性)以及杀虫剂代谢解毒(代谢抗性)或扣押(sequestration)作用增强(Coetzee and Koekemoer,2013;Davidetal.,2013;Mugenzietal.,2019;Inghametal.,2020)。
细胞色素P450(简称P450或CYP)是存在于几乎所有生物体中的蛋白超家族,其悠久的进化历史(约35亿年)赋予了其种类和功能多样性的特征。昆虫P450参与许多外源性化合物(简称外源物)的生物转化,由其介导的杀虫剂代谢解毒作用增强是昆虫对不同类型杀虫剂产生抗性和交互抗性的重要原因(Lietal.,2007;Feyereisenetal.,2015)。抗性昆虫中P450的代谢解毒作用增强有两类可能的机制,一是P450催化活性增强,二是P450酶量增加。催化活性增强的根源在于P450结构的变化,可能涉及氨基酸替换、选择性拼接或形成嵌合体(Joussenetal.,2012;Ibrahimetal.,2015;Walshetal.,2018),而P450酶量增加涉及到P450基因拷贝数的增加以及P450基因的表达上调(Feyereisenetal.,2015)。
P450基因拷贝数增加涉及的分子事件包括基因复制(gene duplication)或基因扩增(gene amplification),即在基因组中产生一个或多个附加的P450基因(Emersonetal.,2008;Wondjietal.,2009;Puineanetal.,2010;Schmidtetal.,2010;Itokawaetal.,2011;Bariamietal.,2012;Kasaietal.,2014;Zimmeretal.,2018)。P450基因在转录层面的上调表达是P450介导抗药性的最普遍机制(Fujii-Kuriyama and Mimura,2005;Lietal.,2007;Feyereisenetal.,2015),昆虫抗药性相关P450基因的转录上调由顺式调控元件与反式作用因子相互作用得以实现 (Liuetal.,2015)。虽然目前人们对P450基因上调表达分子机制的认识还非常有限,但随着组学与生物信息学的快速发展以及分子生物学与生物化学研究手段的革新,近年来P450基因调控机制的研究取得了重要的进展,本文试图综述这一领域的主要研究发现。
1 调控区DNA序列多态性与顺式调控元件
真核生物的顺式调控元件是指能与特定转录因子结合而调控基因转录的DNA序列。P450基因调控区存在着许多顺式调控元件,包括启动子、增强子、沉默子和转座子(Chungetal.,2009)。P450基因的上调表达可能是由于调控区DNA序列的核苷酸插入、缺失或者碱基替换而增加调控元件与转录因子的结合能力,或产生新的调控元件(增强子、启动子),或破坏沉默子的结合位点(Feyereisenetal.,2015;Liuetal.,2015)。
通过比较抗性与敏感等位基因调控区的序列多态性,已鉴定了一些可以导致P450基因过量表达的顺式突变。黑腹果蝇DrosophilamelanogasterCyp6a2基因的过量表达与该基因5′侧翼区存在完整的CncC:Maf转录因子结合位点相关联(Misraetal.,2013),该结合位点的存在赋予Cyp6a2基因启动子更强的转录活性(Wanetal.,2014)。家蝇Muscadomestica拟除虫菊酯类抗性品系LPR的CYP6D1基因的5′侧翼区包含一段15 bp的插入,该15 bp插入破坏了一个转录抑制子mdGfi-1(为C2H2型锌指蛋白)的结合位点,从而降低了mdGfi-1对CYP6D1基因转录活性的抑制作用,导致CYP6D1 mRNA水平的增加(Gao and Scott,2006)。
桃蚜MyzuspersicaeCYP6CY3基因的过量表达与其启动子区的微卫星AC(n)重复的长度有关(Bassetal.,2013)。有趣的是,在棉蚜Aphisgossypii和豌豆蚜Acyrthosiphonpisum的CYP6CY3同源基因的启动子区也检测到保守的AC(n)重复(Panetal.,2019)。在烟蚜Myzuspersicaenicotianae基因组中至少有5个CYP6CY3基因拷贝,这些CYP6CY3基因上游调控区DNA序列包含AC(n)重复,并表现出AC(n)重复长度的多态性,当AC(n)重复长度达到94 bp时,可以增强CYP6CY3的启动子活性(Panetal.,2019)。致倦库蚊Culexquinquefasciatus拟除虫菊酯抗性相关的CYP9M10基因转录起始位点上游第27位的核苷酸发生了由鸟嘌呤向腺嘌呤的突变,由此增强了其转录活性(Itokawaetal.,2015)。褐飞虱Nilaparvatalugens吡虫啉抗性相关基因CYP6ER1 (Bassetal.,2011;Liangetal.,2018)和CYP6AY1(Pangetal.,2014)的启动子区DNA序列的改变与基因过量表达以及对吡虫啉的抗性相关。Mugenzi 等 (2019)发现不吉按蚊AnophelesfunestusCYP6P9b基因的5′侧翼区缺失3个碱基(ACC)与拟除虫菊酯抗性以及拟除虫菊酯杀虫剂选择压相关联。
转座子(transposable elements,TEs),也称跳跃基因(jumping gene),是顺式调控元件的丰富来源(Villanueva-Caasetal.,2019;Branco and Chuong,2020)。TEs可以改变昆虫基因组结构,影响基因的表达(Moschettietal.,2020)。外源物代谢相关的昆虫P450基因往往拥有更丰富的转座子(Chen and Li,2007)。有事例表明转座子插入可以上调P450的表达而产生抗药性。DDT抗性黑腹果蝇D.melanogasterCyp6g1基因的5′端非翻译区存在一个转座子插入[Accord,为长末端重复序列(long terminal repeat,LTR)类型],该转座子的存在与DDT抗性呈正相关(Dabornetal.,2002)。转座子Accord自身带有转录增强子,使Cyp6g1基因在果蝇的中肠和脂肪体等组织中特异性过量表达(Chungetal.,2007)。Schmidt等(2010)在果蝇DDT抗性品系Cyp6g1调控区插入的转座子Accord中发现了两个附加的转座子(P-element和HMS-Beagle),它们的存在进一步增强了Cyp6g1的表达。在加州拟果蝇DrosophilasimulansCYP6G1转录起始位点上游200 bp处插入一个全长为4 803 bp的非长末端重复(non-long terminal repeat,non-LTR)反转录转座子Doc,也能导致Cyp6g1的上调(Schlenke and Begun,2004)。Salces-Ortiz等(2020)通过RNA-seq和ATAC-seq在基因组层面分析了4种果蝇品系(SE-Sto,RAL-375,RAL-177和iso-1)转座子插入对马拉硫磷应答基因表达调控的影响,发现位于应答基因附近的转座子可能在外源物胁迫响应中发挥重要作用。
2 昆虫P450基因表达的调控因子与信号转导途径
真核生物基因的转录调控受很多因子的影响,涉及的信号转导途径也多样。以下介绍的是目前已鉴定的参与昆虫P450基因表达的调控因子与信号转导途径。
2.1 CncC:Maf/Keap1
转录因子Nrf2(nuclear factor erythroid 2 p45-related factor 2)是属于Cnc (cap‘n’collar) 碱性亮氨酸拉链家族(basic leucine zipper,b-ZIP)的转录活化子。在通常情况下,Nrf2与Keap1(Kelch-like ECH-associated protein 1,一种细胞骨架泛素连接酶)结合存在于细胞质中,而在应激情况下(如杀虫剂暴露),Nrf2与Keap1解离,并转移到细胞核中,与Maf(muscle aponeurosis fibromatosis,碱性亮氨酸拉链家族成员)形成杂合二聚体,并与基因上游特定的抗氧化物响应元件(antioxidant response element,ARE)结合而起始解毒酶(如P450、谷胱甘肽S-转移酶等)基因的表达。CncC:Maf/Keap1调控途径受到作为第二信使的活性氧(reactive oxygen species,ROS)的调控,ROS通过修饰Keap1中的特定半胱氨酸残基而影响 Nrf2的细胞定位或泛素化,导致Nrf2 在细胞核中累积,活化外源物响应基因的表达(Taguchietal.,2011)(图1)。
昆虫的Nrf2直系同源物CncC (cap ‘n’ Collar isoform-C)已知在昆虫生长发育和应激反应中发挥核心作用(Sykiotis and Bohmann,2008)。果蝇成虫CncC的过量表达和dKeap1(DrosophilaKelch-like ECH-associated protein 1)的消耗可以活化许多防御相关基因的表达,而dKeap1过量表达则抑制这些基因的转录(Misraetal.,2011)。双分子荧光互补分析发现,dKeap1通过与CncC的相互作用,形成的dKeap1-CncC复合物可以增强或抑制CncC的结合能力,因此对CncC活化某些基因的表达起增效作用,也可以拮抗CncC对另一些基因表达的活化,不同的外源物表现出对不同基因的选择性表达调控(Deng and Kerppola,2014)。
至今已在许多昆虫中发现了CncC:Maf/Keap1通路调控P450基因的表达(Palli,2020),表明这一表达调控途径普遍被昆虫利用以应对杀虫剂的选择压。理论上CncC/Maf表达量上调、Keap1量的变化或这些蛋白结构的改变,以及ARE序列的差异都可以导致P450的表达增加,但直到目前还没有发现因转录因子CncC,Maf或 Keap1突变导致P450介导的抗药性的报道(Wilding,2018)。RNAi研究表明,敲低果蝇CncC可以下调Cyp6a2和Cyp6a8的表达,从而降低DDT抗性品系对DDT的耐受性(Misraetal.,2013)。吡虫啉抗性马铃薯甲虫CYP6BJa/b,CYP6BJ1v1,CYP9Z25和CYP9Z29的过量表达受CncC和MafS (small Maf)的调控(Kalsi and Palli,2017);敲低MafS可以降低冈比亚按蚊AnophelesgambiaeCYP6M2的表达,增加对拟除虫菊酯杀虫剂和DDT的敏感性(Inghametal.,2017)。桔小实蝇BactroceradorsalisCYP473A3的表达增加可以导致阿维菌素抗性,抗性品系中MafB (large Maf)过量表达,敲低CncC和MafB,减低了CYP473A3的表达和对阿维菌素的抗性水平(Tangetal.,2019)。在有机磷与拟除虫菊酯抗性埃及伊蚊Aedesaegypti品系(Oiapoque),Nrf2的转录水平与敏感品系没有差异,但Keap1,CYP6BB2以及GSTX2基因表现为过量表达;Nrf2表达沉默导致Keap1,CYP6BB2以及GSTX2表达量减少,暴露于马拉硫磷的死亡率增加(Bottino-Rojasetal.,2018),该研究提出了一个Keap1表达与解毒酶基因表达以及抗药性正相关的事例。Lu等(2020)发现ROS可以通过CncC:Maf/Keap1通路调控斜纹夜蛾SpodopteralituraCYP6AB12的表达。
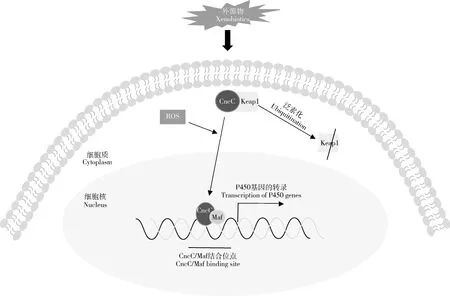
图1 CncC:Maf/Keap1-XRE信号通路调控昆虫P450基因表达(改自Palli,2020)Fig.1 The CncC:Maf/Keap1 pathway involved in the expression regulation of insect P450 genes (adapted from Palli,2020)CncC:cap ‘n’ collar isoform-C;Keap1:Kelch样环氧氯丙烷相关蛋白-1 Kelch-like ECH-associated protein 1;Maf:肌腱膜纤维瘤蛋白Muscle aponeurosis fibromatosis;ROS:活性氧Reactive oxygen species;XRE:外源物响应元件Xenobiotic responsive element.
2.2 GPCR/Gαs/AC/cAMP/PKA信号途径
G蛋白偶联受体(G-protein-coupled receptor,GPCR)是存在于细胞表面的膜结合蛋白,它通过与胞外信号的结合来调控胞内因子(如腺苷酸环化酶、磷脂酶和离子通道等),引发细胞响应而实现信号转导。GPCR在配体的刺激下构象发生变化,接着与G蛋白(一种由α和β-γ亚基组成的异三聚鸟嘌呤核苷酸结合蛋白)偶联,使得G蛋白的α亚基结合的二磷酸鸟苷(GDP)转化为三磷酸鸟苷(GTP),导致α与β-γ亚基亲和力降低而与β-γ亚基分离,进而分别与下游效应因子相互作用引发不同的胞内反应,从而转导配体信号(Lappano and Maggiolini,2011)。GPCR的基本功能是控制G蛋白亚基的活性状态,其中α亚基序列(Gα)根据其序列同源性和信号活性,分为Gαs,Gαi,Gαq/11和Gα12/13 4个家族(图2)。
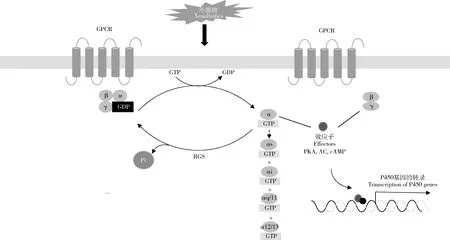
图2 GPCR/Gαs/AC/cAMP-PKA通路调控P450基因表达(改自Lappano and Maggiolini,2011)Fig.2 The GPCR/Gαs/AC/cAMP-PKA pathway involved in the expression regulation of insect P450 genes (adapted from Lappano and Maggiolini,2011)AC:腺苷酸环化酶Adenylate cyclase;cAMP:环磷酸腺苷Cyclic adenosine monophosphate;GPCR:G蛋白偶联受体G-protein-coupled receptor;GDP:二磷酸鸟苷Guanosine diphosphate;GTP:三磷酸鸟苷Guanosine triphosphate;Pi:磷酸Phosphate;PKA:蛋白激酶A Protein kinase A;RGS:G蛋白信号转导调节子Regulators of G-protein signaling.α,β,γ,αs,αi,αq/11和α12/13均为蛋白亚基。α,β,γ,αs,αi,αq/11 and α12/13 are subunits of protein.
在致倦库蚊抗性品系中发现4个GPCR (rhodopsin-like受体)基因与4个P450基因(CYP9M10,CYP9J34,CYP9J40和CYP6AA7)共同表达上调(Lietal.,2014)。对这4个GPCR基因进行RNAi处理,降低了致倦库蚊对氯菊酯的抗性,同时也降低了2个依赖环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的蛋白激酶A(protein kinase A,PKA)基因和4个抗性相关细胞色素P450基因的表达(Lietal.,2015)。采用cAMP抑制剂盐酸布比卡因和RNAi技术,研究了其下游PKA在致倦库蚊氯菊酯抗性中的作用,发现抑制GPCR信号通路第二信使cAMP和敲低PKA均能导致致倦库蚊4个抗性相关P450基因和2个PKA基因表达水平以及对氯菊酯抗性程度的降低(Lietal.,2015)。这些结果提示GPCR参与了抗性相关的P450基因的表达调控。敲低GPCR信号通路下游G蛋白α亚基(Gαs)基因能降低腺苷酸环化酶(adenylate cyclase,AC)和PKA以及抗性P450基因的表达,而敲低AC只降低了PKA和抗性P450基因的表达(Li and Liu,2017),表明降低GPCR信号通路中任意一个基因的表达均能增加致倦库蚊对氯菊酯的敏感性,同时也说明在GPCR通路中G蛋白α亚基(Gs alpha subunit protein,Gαs)位于AC的上游(Li and Liu,2017)。为明确GPCR通路中各个效应子的作用,Li和Liu(2019)在草地贪夜蛾SpodopterafrugiperdaSf9细胞中表达了致倦库蚊的GPCR(GPCR020021)、Gαs(Gαs006458)、AC(AC007240)和PKA(PKA018257),发现随着GPCR,Gαs或AC基因的表达增加,Sf9细胞cAMP产量增加,但cAMP的产量不因PKA表达的升高而变化。所有表达异源致倦库蚊GPCR基因的Sf9细胞表现出更高的PKA活性和更高的CYP9A32表达水平,对氯菊酯耐受性也显著提高;加入cAMP产生抑制剂(Bupivacaine HCl)和PKA活性抑制剂(H89 2HCl)可以显著降低cAMP 浓度和PKA活性,并增加氯菊酯对细胞的毒性(Li and Liu,2019)。
赤拟谷盗TriboliumcastaneumCYP4BN6和CYP6BQ11的组成型过量表达或诱导表达可以降低赤拟谷盗对敌敌畏和呋喃丹的敏感性,诱导过表达和RNAi证据显示这两个基因的表达受蛛毒素受体(latrophilin,Tclph)的调控:敌敌畏和呋喃丹可以诱导Tclph以及CYP4BN6和CYP6BQ11,沉默Tclph的表达导致CYP4BN6和CYP6BQ11表达量下降,增加赤拟谷盗对敌敌畏和呋喃丹的敏感性(Gaoetal.,2018;Xiongetal.,2019)。最近,Ma等(2020)发现G蛋白偶联受体Mthl10(LOC101899380) 在家蝇吡虫啉抗性品系中过量表达,并在转基因果蝇中证明了Mthl10在抗性相关P450基因的表达调控中发挥作用。
以上事例表明,昆虫可以利用通用的GPCR/Gαs/AC/cAMP/PKA信号通路调控抗性相关的P450表达,但受该信号转导途径调控的、可活化上述P450基因表达的靶标转录因子尚未明确。
2.3 MAPK/ERK-p38/CREB信号通路
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一类典型的丝氨酸/苏氨酸类蛋白激酶,在真核生物中非常保守,作为细胞内多种信号通路,对于细胞周期的运行和基因的表达具有重要的调控作用(Cristinaetal.,2010)。MAPK级联信号传导是由3个进化非常保守的激酶所组成,即MAPK、MAPK激酶(MAPKK)和MAPKK激酶(MAPKKK)。在外界环境的刺激下,MAPKKK通过磷酸化与Ras/Rho家族一个小的GTP结合蛋白和/或其他蛋白相互作用而被激活,MAPKKK的活化进而引起MAPKK磷酸化而激活,接着引起MAPK的磷酸化,从而将MAPK与细胞表面的受体以及胞外的信号联系到一起(Cargnello and Roux,2011)。在哺乳动物中主要有4种MAPK通路,即细胞外信号调节蛋白激酶(extracellular signal-regulated kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase 1/2/3,JNK1/2/3)、ERK5/BMK1和p38 (Cargnello and Roux,2011),它们可以被不同的外界条件所激活,形成不同的信号转导(图3)。
最近,Yang等(2020)发现MAPK/ERK-p38/CREB这一激酶激活的信号途径参与调控烟粉虱BemisiatabaciCYP6CM1基因的表达。CYP6CM1的过量表达可以导致烟粉虱对吡虫啉的抗性,而CYP6CM1的过量表达受bZIP超家族成员转录因子cAMP应答元件结合蛋白(cAMP-response element binding protein,CREB)的调控。丝氨酸MAPK途径的ERK和p38信号使烟粉虱的CREB蛋白第111位的丝氨酸磷酸化,磷酸化的CREB与CYP6CM1基因启动子区的CRE-like位点结合活化CYP6CM1的表达。在检测的吡虫啉抗性品系中p38和CREB 的表达水平较敏感品系高,敲低ERK或p38的表达,都可以降低CYP6CM1 mRNA和蛋白水平及烟粉虱对吡虫啉的抗性。
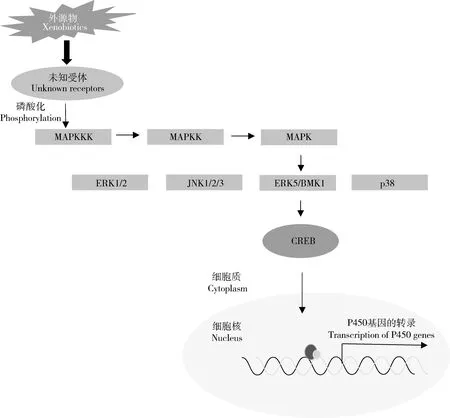
图3 MAPK/ERK-p38/CREB通路调控昆虫P450基因表达Fig.3 The MAPK/ERK-p38/CREB pathway involved in the expression regulation of insect P450 genesBMK:大丝裂原活化蛋白激酶Big mitogen-activated protein kinase;CREB:环磷腺苷应答元件结合蛋白cAMP-response element binding protein;ERK:细胞外信号调节激酶Extracellular signal-regulated kinase;JNK:c-Jun氨基末端激酶c-Jun N-terminal kinase;MAPK:丝裂原活化蛋白激酶Mitogen-activated protein kinase;MAPKKK:丝裂原活化蛋白激酶激酶激酶Mitogen-activated protein kinase kinase kinase;p38:p38丝裂原活化蛋白激酶p38 mitogen-activated protein kinase.
2.4 核受体
核受体是一类特殊的、古老的、配体依赖性转录因子超家族,具有保守的DNA结合结构域和配体结合结构域(Fahrbachetal.,2012),包括类固醇激素受体、非类固醇激素受体和孤儿核受体。在配体的作用下,核受体与共抑制子(co-repressor)解离并开始招募共激活子(co-activator),然后与靶基因上游的响应元件结合(King-Jones and Thummel,2005),启动P450基因的转录(图4)。
芳烃受体(aryl hydrocarbon receptor,AhR)是一种配体(如花椒毒素等外源物)激活的转录因子,AhR及其芳烃受体核转运蛋白(AhR nuclear transportor,ARNT)隶属于含bHLH结构域以及PAS结构域的转录因子家族(Guetal.,2000;Fujii-Kuriyama and Mimura,2005)。在未与配体结合的情况下,大部分AhR位于细胞质中,与热激蛋白90(heat shock protein 90,hsp90)以及热激蛋白90关联蛋白(hsp90-associated proteins)结合,形成复合物,使AhR维持在一种非活化可与配体结合的状态(Berg and Pongratz,2001)。配体与AhR结合后,AhR从复合物中游离出来并且转移至细胞核中,与ARNT形成异源二聚体。异源二聚体再与P450基因启动子上特有的XRE-AhR元件结合(Reyesetal.,1992),随后诱导P450基因的表达。在昆虫中,花椒毒素通过AhR信号转导途径诱导香芹黑凤蝶PapiliopolyxenesCYP6B1 (Brownetal.,2005)和虎凤蝶PapilioglaucusCYP6B4 (McDonnelletal.,2004)的表达。在埃及伊蚊氯菊酯诱导的CYP6家族基因的启动子区也发现了类似于外源物响应元件 (xenobiotic responsive element,XRE)的转录因子结合位点(Poupardinetal.,2008)。基于RNAi和转录因子共转染实验结果表明棉蚜CYP6AD2 (Pengetal.,2016)和烟蚜CYP6CY3 (Panetal.,2019)的表达受转录因子AhR/ARNT的调控,具体表现为通过饲喂双链RNA (dsRNA)对AhR和ARNT基因干扰,CYP6AD2或CYP6CY3表达显著降低,在sf9细胞中共转染AhR和ARNT基因可以增强CYP6AD2或CYP6CY3基因的启动子活性 (Panetal.,2019)。
DDT抗性果蝇品系差异表达基因的转录因子结合位点分析发现,共调控的多个基因都存在糖皮质激素受体(glucocorticoid receptor,GR)结合位点(Qiuetal.,2013)。在DDT抗性果蝇中发现了GR同源物雌激素相关受体(estrogen-related receptor,ERR)存在一个甘氨酸插入突变,导致果蝇Cyp6g2,Cyp9c1和Cyp12d1基因的组成型上调表达(Sunetal.,2015),这一结果表明核受体ERR在果蝇中参与某些P450的表达调控。
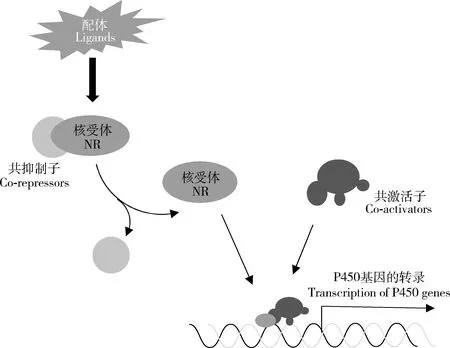
图4 核受体调控昆虫P450基因表达Fig.4 The nuclear receptor (NR) involved in the expression regulation of insect P450 genes
果蝇核激素受体96(nuclear hormone receptor 96,DHR96)与哺乳动物的孕烷X受体-组成型雄甾烷受体(pregnane X receptor-constitutive androstane receptor,PXP)是同源物(King-Jones and Thummel,2005)。研究表明,由DHR96介导的Cyp6g1(以及谷胱甘肽S-转移酶GstE1)上调表达可以增强果蝇对DDT的抗性(King-Jonesetal.,2006;Afscharetal.,2016)。DHR96功能缺失的果蝇对DDT敏感(King-Jonesetal.,2006;Afscharetal.,2016),而DHR96在马氏管中过量表达可以提高果蝇的DDT抗性(Afscharetal.,2016)。
Li等(2019)发现,小菜蛾Plutellaxylostella的孤儿核受体FTZ-F1和CYP6BG1在抗性种群中过量表达,且FTZ-F1和CYP6BG1的表达可以被氯虫苯甲酰胺诱导。进一步研究发现CYP6BG1基因的转录起始位点上游存在FTZ-F1的结合位点,往3龄幼虫注射dsRNA干扰FTZ-F1的表达也导致CYP6BG1表达量的下降(Lietal.,2019),这些实验结果表明CYP6BG1的表达受到FTZ-F1的调控。
3 昆虫P450表达的转录后调控机制
转录后调控是指真核生物的mRNA前体到成熟mRNA翻译起始前这一过程中的调控,包括mRNA剪切、编辑、转运和稳定性维持。近年来,非编码RNA对昆虫P450的调控作用的研究受到了学者越来越多的青睐。
小RNA (microRNA,miRNA)是一类长度大约为22个核苷酸的小非编码RNA,它通过其5′端的长度为2~8个核苷酸的种子序列(seed sequence)与靶基因mRNA的3′端非翻译区(untranslated region,3′UTR)互补匹配位点结合,导致mRNA降解或翻译抑制,由此调控许多基因的表达(Lucas and Raikhel,2013)。miRNA最有效的作用靶标是受体、激酶和转录因子等信号级联反应的成员,也有一些研究表明,miRNA可以调控抗药性相关的P450的表达。尖音库蚊CulexpipiensmiR-71(Hongetal.,2014)、miR-285(Tianetal.,2016)和miR-13664(Sunetal.,2019)分别通过调控靶基因CYP325BG3,CYP6N23和CYP314A1的表达而改变对溴氰菊酯的抗性。miRNA可能以簇的方式存在,同簇miRNA之间存在某种方式的内在调节机制,以网络调控的方式改变抗性相关的P450的表达。例如在拟除虫菊酯类杀虫剂抗性的淡色库蚊Culexpipienspallens雌性成虫中,MiR-2/13/71簇表达下调,由此调控CYP9J35和CYP325BG3的表达而导致抗药性,其中MiR-2/13/71簇的miR-2或 miR-13可以直接调控CYP9J35的表达和对溴氰菊酯的抗性(Guoetal.,2017)。烟蚜CYP6CY3的表达及烟蚜对尼古丁的抗性受到let-7和miR-100的调控(Pengetal.,2016),而miR-2b-3p可能降低小菜蛾CYP9F2 mRNA的表达水平(Etebarietal.,2018)。
除miRNA外,其他非编码RNA也可能参与P450的调控。例如在尖音库蚊中,piRNA(piwi-interacting RNA)-3878可以靶向CYP307B1来调控拟除虫菊酯杀虫剂抗性(Yeetal.,2017);小菜蛾氯虫苯甲酰胺抗性品系中CYP6B6-like基因的过量表达与11种长链非编码RNA (lncRNA,长度大于200 bp)的表达相关联,但这些lncRNAs是如何调控CYP6B6-like基因表达的尚不清楚(Zhuetal.,2017)。
4 昆虫P450基因表达的表观遗传调控
哺乳动物的P450的表达受DNA甲基化和组蛋白翻译后修饰的调控,如CYP2C19的表达受DNA甲基化的间接调控(Burnsetal.,2018),丙戊酸诱导的组蛋白乙酰化可抑制CYP19A1基因的表达(Chenetal.,2015)。有证据表明酯酶E4基因的DNA甲基化在桃蚜抗药性中发挥作用(Fieldetal.,1989;Hicketal.,1996;Field,2000),但至今有关表观遗传调控昆虫抗药性相关P450表达的报道很少。Mahmood等(2016)分析了家蝇多杀菌素抗性品系中差异表达的8个P450基因(CYP4G2,CYP6A1,CYP6A36,CYP6A37,CYP6D1,CYP6D3,CYP6G4和CYP12A2)的CpG岛的频数、所在位置和长度,发现其中7个P450存在1个CpG岛位点,而CYP12A2包含3个CpG岛。不同P450基因的CpG岛所在位置差异很大,CYP6A1,CYP6A36、CYP6A37和CYP6D3包含一个靠近5′区的CpG岛,CYP4G2和CYP12A2的 CpG岛靠近3′区,而CYP6G4的一个CpG岛位于基因序列的中间,为外显子区;3个与外源物代谢相关的P450基因(CYP6A1,CYP6D1和CYP6G4)具有一个相对更大的CpG岛。用组蛋白脱乙酰酶抑制剂可以诱导西方蜜蜂ApismelliferaP450基因(CYP9和CYP4G11)的表达,增强对吡虫啉的耐受性(Huetal.,2017)。
5 结语
虽然杀虫剂化学结构多样、作用靶标和作用方式有所不同,但在使用一段时间后,昆虫毫无例外地能产生抗药性(Denholmetal.,2002)。通过P450的过量表达以增强对杀虫剂的代谢解毒作用是昆虫应对杀虫剂胁迫使其种群保存下来的一个重要途径。抗性昆虫P450基因的过量表达可以是基因组DNA层面的基因重复与扩增,更普遍的是转录层面的表达上调。抗性昆虫P450转录上调机制复杂,可以是顺式调控元件、反式作用因子,或者顺式调控元件和反式作用因子共同作用的结果。现已发现几种不同类型的转录因子(如CncC、CREB和核受体等)和miRNA对昆虫P450表达的直接调控,也鉴定了间接调控P450表达的作用因子如GPCR及其下游效应子。现有的研究结果充分显示昆虫P450基因调控因子和信号转导通路的多样性和调控机制的复杂性,一些P450的表达调控甚至是多层面多途径的。外源物应激响应相关的转录因子CncC在调控解毒酶基因表达的中心地位及其在抗药性形成中的作用已得到很多事例的支持,其他参与抗药性调控的因子还有待发现。
在基因表达调控水平上,探讨昆虫发生什么遗传突变,利用何种调控因子或非编码RNA,以及经由哪些信号途径而获得抗药性,是值得并需要加强的研究方向。通过对P450转录调控机制的深入研究,不仅为认识昆虫适应性的进化机制提供新视角,还可以发现用于代谢抗性检测的分子标记以及害虫防治的新靶标,为昆虫抗药性监测、治理以及害虫可持续有效防控提供新的思路与手段。可以相信,综合采用比较基因组与转录组、全基因组关联分析(genome-wide association studies,GWAS)、染色质免疫共沉淀-测序(ChIP-Seq)、RNAi和规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR) 基因编辑等现代生物方法与技术,必将在更多的抗性昆虫中发现更多的调控元件、调控因子和调控途径,对P450表达调控机制有新的更全面的认识。

