弗里熊蜂蜜罐中糖液成分分析
苏 睿,秦加敏,董 坤,宋文菲,贾红伟,3,梁 铖,*
(1.云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661100;2.云南农业大学,昆明 650201;3.红河学院,云南蒙自 661100)
昆虫纲(Insecta)膜翅目(Hymenoptera)蜜蜂科(Apidae)的物种,主要以花蜜和花粉为食物(吴燕如,2000)。其中以蜜蜂属Apis的物种最为典型,能够将采集的花蜜带回巢内贮藏,进而酿造成蜂蜜,这一生物学行为有效保留了食物营养,防止变质,是其适应自然而进化出的重要生存策略(匡邦郁和匡海鸥,2003)。蜜蜂酿造蜂蜜是一段复杂的生物、化学和物理变化过程。蜜蜂在花蜜中添加生物酶,同时脱去多余的水分,在这一过程中花蜜中的蔗糖被生物酶转化为葡萄糖和果糖,与花蜜相比,蜂蜜含水量降低,pH值和化学组成发生了改变,含有更多的生物活性物质,如蜂王浆主蛋白(major royal jelly proteins,MRJPs)、氨基酸和酶(Lichtenberg-Kraag,2014;Eyeretal.,2016;Zhangetal.,2019)。目前在蜂蜜中发现的化学成分超过180种,且大部分都是在蜂蜜酿造过程中产生的(Lichtenberg-Kraag,2014)。研究发现蜂蜜中的化学组分与蜜蜂在采集花蜜和蜂蜜酿造过程中添加的酶有关,蜜蜂添加到蜂蜜中的生物酶是由其咽下腺和唾液腺产生的,其中最重要的酶包括淀粉酶(α-淀粉酶)、转化酶(α-葡萄糖苷酶)和葡萄糖氧化酶,而添加的量及酶的活性取决于很多因素,如工蜂的日龄、饲料、蜜蜂的生理状态、蜂群的强弱、温度以及蜂群的进蜜量(Al-Sherifetal.,2017)。因此,不同蜂蜜中酶的活力存在很大差异。最近的研究报道了西方蜜蜂Apismellifera和东方蜜蜂Apiscerana酿造的蜂蜜中特异性蛋白质电泳条带差异很大,且这种差异只与蜂种有关(Zhangetal.,2019),表明不同蜂种酿造的蜂蜜成分存在一定差异。
熊蜂属Bombus是蜜蜂科(Apidae)中的重要类群。目前全世界发现有熊蜂250种(Cameronetal.,2007),中国有125种(黄家兴和安建东,2018),其中云南分布有36种(梁铖等,2018)。熊蜂是众多野生植物和农作物的重要传粉昆虫(王晓峰等,2013;Ahmadetal.,2015;Sherry and Strang,2015;Zhangetal.,2015;Sapiretal.,2019),特别是对高山、高原植物及一些濒危植物的传粉具有重要作用(Kudoetal.,2011;Pradervandetal.,2014),在维系植物区系、生态系统稳定,以及促进绿色农业发展方面发挥着重要作用。熊蜂具有与蜜蜂相似的觅食生物学,但因其群势小,贮藏在蜜罐中的花蜜较少,目前有关熊蜂酿蜜生物学方面的研究鲜有报道。随着农业生产方式和种植结构的改变,繁育熊蜂为农作物授粉具有巨大的市场需求。国外已有多个熊蜂物种被人工驯化,用于设施农业授粉(Velthuis and Doorn,2006)。然而,目前中国对本土熊蜂的繁育和授粉应用尚处于发展阶段,市场上用于农作物授粉的熊蜂以欧洲地熊蜂Bombusterrestris为主。采用外来蜂种授粉,存在物种入侵带来的生态危机。据报道,外来蜂种授粉时与本土熊蜂抢夺食物资源和营巢场所,干扰生殖,传播病虫害,引发本土传粉蜂数量和分布区域缩减等潜在影响(Inoueetal.,2008;张体银等,2015;袁晓龙等,2018)。因此,加强对本土熊蜂的基础研究迫在眉睫。
弗里熊蜂Bombusfriseanus是云南优势物种,广泛分布于海拔1 200-4 400 m的山地,是多种植物的泛化传粉者(梁铖等,2018)。近年来其周年繁育技术已在国内获得成功,使得利用弗里熊蜂B.friseanus为农作物授粉成为可能(Liangetal.,2020)。在人工繁育研究过程中,发现弗里熊蜂B.friseanus会在蜜罐中存储糖液,这为本研究提供了基础。研究本土熊蜂的酿蜜生物学,了解其采集食物贮藏的特性和自身生长发育的营养需求,对科学配制人工饲料,奠定规模化繁育的基础,保护本土熊蜂的物种多样性具有重要意义。本研究利用白砂糖溶液饲喂弗里熊蜂B.friseanus,收集并检测了其贮藏在蜜罐中糖液的理化和生化指标,旨在解析熊蜂对其采集的食物是否具有酿造能力,为熊蜂生物学和繁育研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1供试蜂群:本实验分别于2018和2019年的7-9月进行。弗里熊蜂B.friseanus由云南省农业科学院蚕桑蜜蜂研究所农业授粉蜂研究实验室提供。实验蜂群放置于同一间暗室内饲养,暗室内温度28±1℃,相对湿度60%±5%,蜂群9群,蜂王正常产卵,每群工蜂数量约60头。
1.1.2设备与试剂:酶标仪(美国Bio-RAD xMarkTM)、电子天平(AL204,梅特勒-托利多仪器有限公司)、数显折射仪(ATAGO,Brix 0%~53%和58%~90%)、数显恒温水浴锅(上海双捷实验设备有限公司)、α-淀粉酶试剂盒(Solarbio)、DNS试剂(Solarbio)、精密pH试纸(0.5-14),氯化钠、乙酸钠、冰乙酸均为分析纯,标准品果糖(C6H12O6)、葡萄糖(C6H12O6)、蔗糖(C12H22O11)、麦芽糖(C12H22O11·H2O)和海藻糖(C12H22O11·2H2O)购自Sigma公司。
1.2 实验样品制备
准确称取500 g食品级一级白砂糖,加入500 g无菌纯净水,搅拌溶解煮沸,待冷却后,用无菌纯净水定量至1 000 g,配制成50%的糖溶液(现用现配),4℃保存备用。处理组实验样品的采集在饲养熊蜂的暗室内完成。预先用灭菌吸管移出实验蜂群蜜罐中的原有糖液,移走饲喂瓶饥饿处理3 h,而后将配制好的50%的糖溶液放入灭菌饲喂瓶内,饲喂实验蜂群直至采样。同时用相同配方的花粉饲喂蜂群以满足幼虫发育所需的蛋白质(蜂群中有大量幼虫存在时工蜂才会积极贮藏糖液)。24 h后用无菌吸管吸取工蜂贮藏在蜜罐中的糖液(图1),放入1.5 mL离心管。每次取样时每群熊蜂单独使用一支新的灭菌吸管,并且取完蜜罐中的所有糖液。每次采样时移走饲喂瓶停止饲喂,以免蜜罐中可能混入熊蜂刚刚贮藏的糖液,样品采集完成后再饲喂蜂群直至下一次采样。分别间隔1,2,3,4,5,6和7 d,历时28 d收集7组样品。同时在1.5 mL灭菌离心管中盛放上述50%的糖溶液,放置在同一蜂箱中,排除熊蜂取食,作为对照组。采集好的样品放入-20℃冰箱保存备用。

图1 弗里熊蜂的蜂巢及其贮藏的糖液Fig.1 Comb and sugar solution stored in wax cells of Bombus friseanus
1.3 pH值和总糖浓度检测
用1 mL吸管取1滴样品滴至pH试纸上,检测样品的pH值。用数显折射仪测定总糖浓度。
1.4 糖组分检测
处理组和对照组样品中糖种类及含量委托中国科学院昆明植物研究所分析测试中心进行检测。以果糖、葡萄糖、蔗糖、麦芽糖和海藻糖作为标准物质。色谱条件如下:Agilent 1100,配置蒸发光散射检测器ELSD;色谱柱:Waster Carbohydrate Analysis Column,4.6 mm×250 mm,4 μm;流动相:乙腈∶水(75∶25,v/v)等梯度洗脱;流速:1.0 mL/min;柱温:30℃;蒸发温度:80℃;雾化温度:60℃;载气:氮气,流速 1.7 mL/min;进样量:2 μL。以质量体积比浓度(mg/mL)为横坐标,以峰面积为纵坐标绘制标准工作曲线。根据标准品的保留时间确定样品中糖的种类,以外标法计算糖的含量。
1.5 α-淀粉酶活性检测
采用试剂盒检测α-淀粉酶活性。α-淀粉酶活性单位定义为:每g样品每分钟转化产生1 mg还原糖为1个酶活力单位(U/g FW)。预先配制pH 5.30的乙酸钠缓冲液:称取8.70 g乙酸钠(CH3COONa·3H2O)、1.45 g氯化钠,加蒸馏水充分溶解,冰乙酸调节pH,定容至50 mL。称取0.01 g样品,加入0.5 mL乙酸钠缓冲液,蒸馏水定容至10 mL,室温静置10 min,充分提取,稀释1倍即为待测样品原液。测定步骤依α-淀粉酶检测试剂盒进行。
1.6 转化酶活性检测
以0.1 g/mL的蔗糖溶液为转化酶底物,葡萄糖为标准物质制作标准曲线,参照张忠义等(2002)研究方法并改进。首先配制pH 4.60的HAc-NaAc缓冲液,4℃保存备用。取100 mg葡萄糖,蒸馏水稀释成1,0.5,0.25,0.125,0.0625和0.03125 mg/mL的葡萄糖标准溶液,-20℃保存备用。称取0.05 g样品加入5 mL HAc-NaAc缓冲液,室温静置10 min,充分提取,蒸馏水定容至100 mL,制成待测样品原液。
分别设空白管、标准管、对照管和测定管,测定步骤如下:①向6支标准管中分别加入75 μL葡萄糖标准溶液,空白管中加75 μL蒸馏水;②对照管和测定管中分别加入75 μL待测样品原液,并将其与蔗糖溶液置于45℃水浴10 min;③对照管中加入150 μL DNS试剂,其余管中分别加入75 μL蔗糖溶液,45℃水浴准确反应10 min;④对照管中加入75 μL蒸馏水,其余各管分别加入150 μL DNS试剂,90℃水浴10 min终止反应,立即用酶标仪测定A540。转化酶活性单位定义为:每g样品每分钟转化产生1 mg还原糖为1个酶活力单位(U/g FW)。
1.7 数据分析
实验结果以平均值±标准差(mean±SD)表示,用Excel 2010和SPSS 20.0分析数据。采用one-way ANOVA方差分析,用LSD多重比较法分析不同贮藏天数样品中浓度、糖组分、pH和两种酶活性的差异显著性,显著或极显著水平分别设为P<0.05或P<0.01;采用t检验分析贮藏在蜜罐中的糖液和对照组糖液的pH差异显著性;采用二元变量的Pearson系数分析糖组分含量与蔗糖或贮藏时间的相关性。
2 结果
2.1 弗里熊蜂蜜罐中贮藏不同时间的糖液pH值和浓度
熊蜂贮藏在蜜罐中1~7 d的糖液pH值平均为3.74±0.13(n=28),t检验发现,其极显著低于对照组(6.55±0.15,n=28,P<0.01),表明糖液经熊蜂贮藏后pH显著降低。糖液在蜜罐中贮藏1~7 d后,浓度由50.00%升高到61.20%~81.10%,平均浓度75.07%±5.29%(n=126)。单因素方差分析结果表明,贮藏6 d的平均糖浓度为78.43%±1.81%,与贮藏4,5和7 d时的糖浓度差异不显著(P>0.05),但显著高于贮藏1,2和3 d时的浓度(P<0.05)(图2);Pearson相关性分析表明,浓度与贮藏时间显著正相关(Pearsonr=0.40,P<0.01,n=126),随贮藏时间延长浓度升高。
2.2 弗里熊蜂蜜罐中贮藏不同时间的糖液糖组分
对实验收集的样品进行糖组分检测,结果显示熊蜂贮藏在蜜罐中的糖液与对照组相比,糖组分及含量发生了显著改变(图3)。经过HPLC检测分析,对照组1~7 d的糖溶液中只检出蔗糖,且含量恒定为50.00%,而蜜罐中贮藏1~7 d的糖液样品中均检测到果糖、葡萄糖、蔗糖、麦芽糖和海藻糖5种糖。以贮藏3 d时为例,蜜罐和对照组的糖组分色谱图分别如图3(B)和图3(C)所示。
贮藏在蜜罐中不同时间的糖液组分含量如表1所示。单因素方差分析表明,贮藏4 d后果糖含量最高(26.97%±0.69%),贮藏5 d后葡萄糖含量最高(20.87%±0.10%),二者极显著高于其他贮藏时间(P<0.01);贮藏1 d时的蔗糖含量最低(16.94%±0.89%),极显著低于贮藏6 d时(35.78%±0.06%,P<0.01);贮藏1~4 d时的麦芽糖含量极显著高于贮藏 5~7 d时的(P<0.01),而贮藏1~4 d时的海藻糖含量极显著低于贮藏5~7 d时(P<0.01)。贮藏4~5 d后己糖(葡萄糖和果糖)含量(平均41.73%)极显著高于贮藏1~3 d和6~7 d时的(P<0.01)。
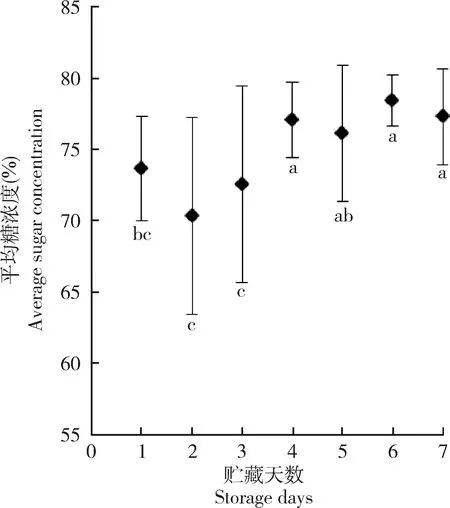
图2 弗里熊蜂蜜罐中贮藏不同天数的糖液平均浓度Fig.2 Average concentrations of sugar solution in wax cells stored by Bombus friseanus for different days图中误差线下方标注的不同小写字母表示贮藏不同天数的糖液平均糖浓度经LSD法检验差异显著(P<0.05)。Different lowercase letters below the error bars show that the average sugar concentrations of sugar solution during different storage days were significantly different (P<0.05) by LSD test.
相关性分析表明,总糖中果糖、己糖(果糖和葡萄糖)、麦芽糖含量分别与蔗糖含量具有极显著负相关关系(果糖:Pearsonr=-0.976,P=0.000;己糖:Pearsonr=-0.738,P=0.001;麦芽糖:Pearsonr=-0.719,P=0.001),换言之,在酿蜜过程中果糖和麦芽糖含量随着蔗糖含量的升高而降低。然而,葡萄糖和海藻糖含量与蔗糖含量变化不相关(葡萄糖:Pearsonr=0.109,P=0.676;海藻糖:Pearsonr=0.403,P=0.108)。另外,总糖中果糖和麦芽糖含量与贮藏时间极显著负相关(果糖:Pearsonr=-0.768,P=0.000;麦芽糖:Pearsonr=-0.875,P=0.000),随贮藏时间的延长含量降低;葡萄糖、蔗糖和海藻糖含量分别与贮藏时间呈极显著正相关(葡萄糖:Pearsonr=0.684,P=0.002;蔗糖:Pearsonr=0.665,P=0.004;海藻糖:Pearsonr=0.672,P=0.003),随贮藏时间的延长含量升高。
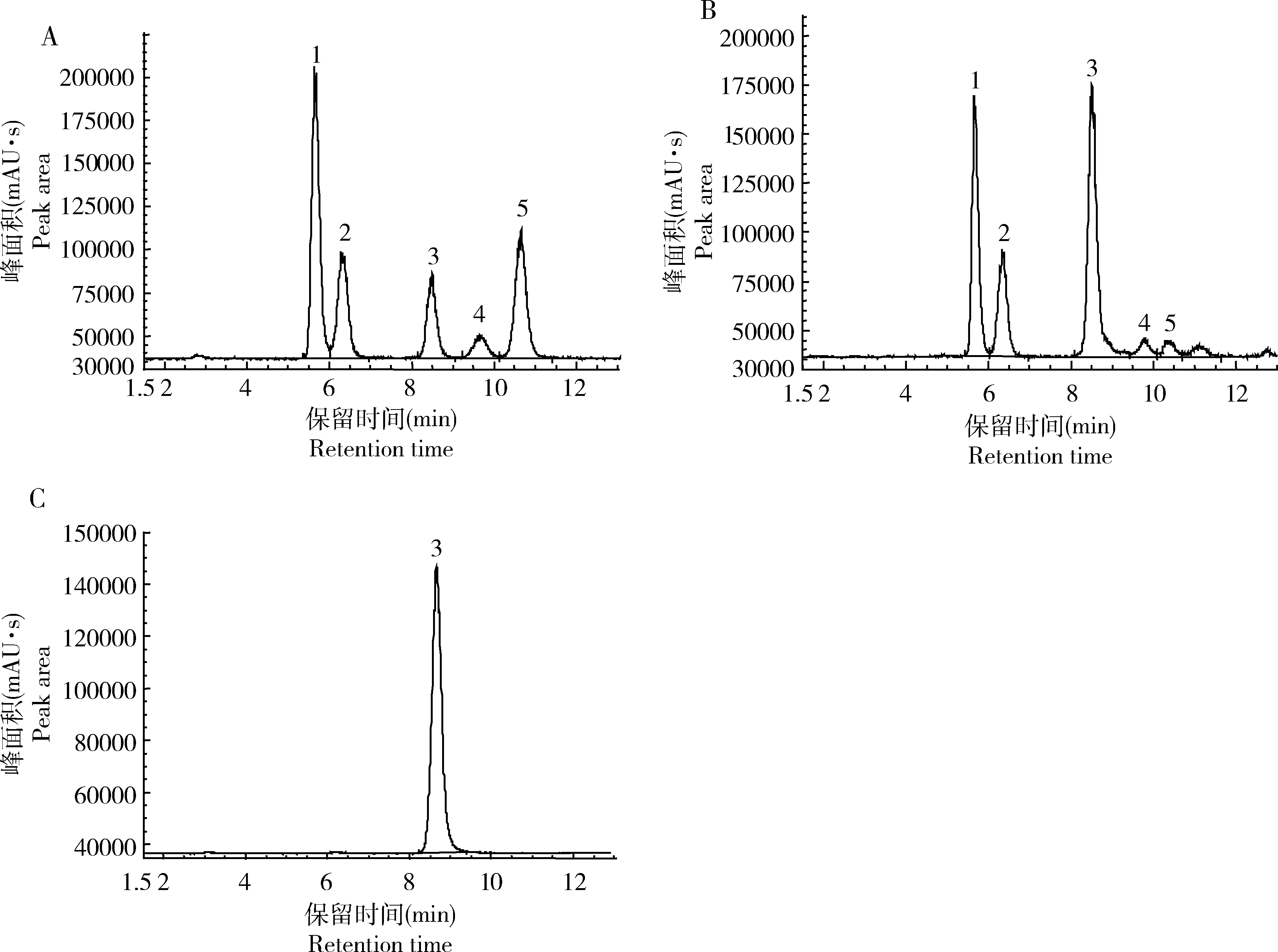
图3 贮藏在弗里熊蜂蜜罐中3 d的糖液和对照组第3天糖液的碳水化合物色谱图Fig.3 Chromatograms of carbohydrates in sugar solution stored in wax cells of Bombus friseanus and in the control group for 3 dA:糖的标准品色谱图Chromatogram of standard sugar;B:熊蜂在蜜罐中贮藏3 d的糖液的碳水化合物色谱图Chromatogram of carbohydrates in sugar solution stored in wax cells of bumblebees for 3 d;C:对照组第3天糖液的碳水化合物色谱图Chromatogram of carbohydrates in sugar solution in the control group for 3 d.波峰Peaks:1:果糖Fructose;2:葡萄糖Glucose;3:蔗糖Sucrose;4:麦芽糖Maltose;5:海藻糖Trehalose.
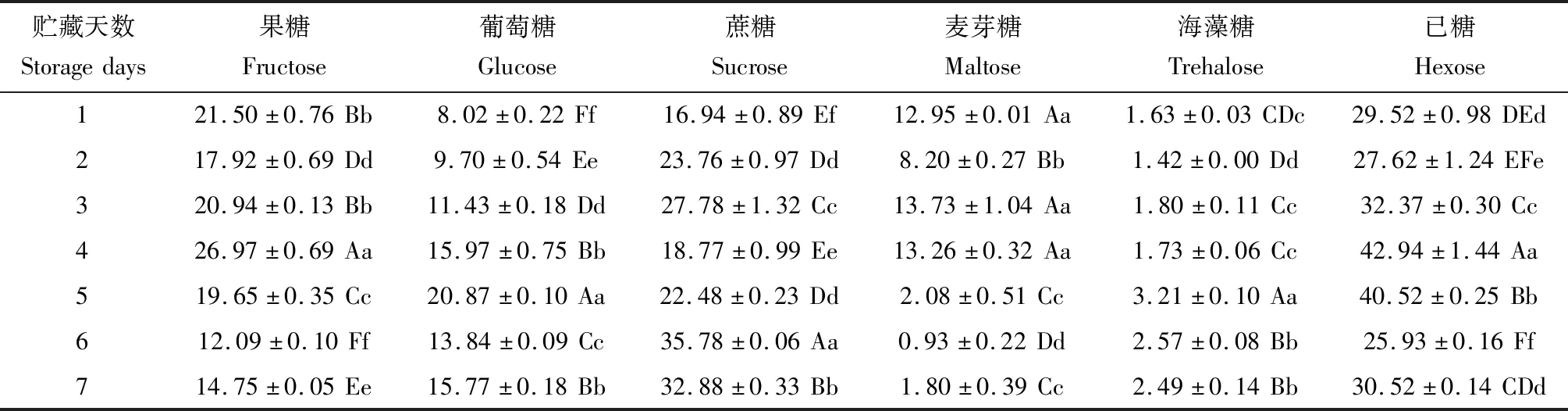
表1 弗里熊蜂蜜罐中贮藏不同天数的糖液中糖组分含量(%)变化Table 1 Changes in the contents (%) of sugar components in sugar solution stored in wax cells of Bombus friseanus for different days
2.3 弗里熊蜂蜜罐中贮藏不同时间的糖液中α-淀粉酶和转化酶的活性
分析发现贮藏6 d的糖液中α-淀粉酶活性高达82.86 U/g FW(n=131),极显著高于贮藏1~5 d和7 d时的样品(P<0.01);除了贮藏6 d的糖液样品,其余样品中α-淀粉酶活性差异不显著(P>0.05)(表2)。
贮藏在蜜罐中1~7 d时的糖液,转化酶活性差异不显著(P>0.05,表2),所有样品转化酶活性在21.17~38.05 U/g FW之间(n=126),转化酶活性平均为27.01~28.85 U/g FW。
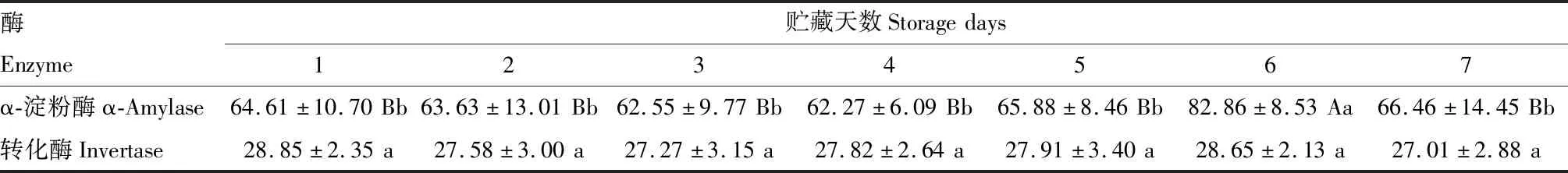
表2 贮藏在弗里熊蜂蜜罐中不同天数的糖液中α-淀粉酶和转化酶的活性(U/g FW)Table 2 The α-amylase and invertase activities (U/g FW) in sugar solution stored in wax cells of Bombus friseanus for different days
3 讨论
蜜蜂科中,熊蜂和蜜蜂是亲缘关系较近的两个属(Hines,2008),但熊蜂的贮蜜量及贮蜜积极性远不如蜜蜂,可能是由于二者的生物学差异所致。蜜蜂为社会性昆虫,贮藏蜂蜜有两方面的重要意义:(1)确保蜂群安全越冬;(2)度过漫长的恶劣环境,例如缺乏蜜源的高温夏季;而熊蜂为不完全社会性昆虫,以交尾后的子代蜂王滞育越冬,贮藏蜂蜜仅仅是为了度过短期低温阴雨天气。本研究发现,饲喂50%的白砂糖溶液后,弗里熊蜂B.friseanus积极取食并将糖液贮藏在蜜罐中,当蜂群壮大至80头工蜂时,贮藏糖液的蜜罐多达120个,尽管贮藏糖液的蜜罐比例大约只有30%~60%,但每个蜜罐中贮藏的糖液的体积在0.1~2.0 mL间,其中贮藏在工蜂巢房中的糖液较少,而贮藏在工蜂筑造的蜜罐中的糖液较多。弗里熊蜂B.friseanus在云南的垂直分布范围最广,主要采集豆科(Fabaceae)、唇形科(Lamiaceae)和菊科(Asteraceae)植物的花蜜和花粉(Liangetal.,2020),面临的生境更加复杂,贮蜜可能是其在进化过程中适应极端天气的重要生存策略。
在流蜜期,花蜜经蜜蜂酿制后,含水量降至18%左右,成熟蜂蜜中的总糖含量升高至75%以上,主要包括葡萄糖、果糖、蔗糖和麦芽糖及少量的松三糖和棉籽糖等(邢晶晶,2009)。本实验中,蜜罐中糖液的糖组分比对照组更加丰富,由单一的蔗糖变成了果糖、葡萄糖、麦芽糖和海藻糖,浓度由50.00%升高至81.10%,pH值由6.55降至3.74,表明糖液经熊蜂取食并贮藏在蜜罐后发生了一系列复杂的物理和化学变化。研究发现蜂蜜的高渗环境可使细胞脱水,造成生理干燥,从而抑制病菌生长(Mandal and Mandal,2011;Kwakman and Zaat,2012;Libonattietal.,2014)。弗里熊蜂B.friseanus酿造后的糖液浓度很高,具有高渗特性,因此酿造后的糖液可能也有一定的抑菌作用,这对于糖液的短期保存与防腐具有重要意义。
据报道,蜜蜂酿蜜初始蔗糖含量越高,蔗糖降解速率越快(Lichtenberg-Kraag,2012)。本实验中,与蔗糖的起始含量50%相比,熊蜂贮藏1 d后的糖液中蔗糖含量下降最快,与蜜蜂酿蜜生物学相似。西方蜜蜂A.mellifera和东方蜜蜂A.cerana酿造的蜂蜜以果糖和葡萄糖为主,糖组分一般包括约38%的果糖、31%的葡萄糖,低于5%的蔗糖以及其他的二糖和三糖(Doner,1977)。黄纹无刺蜂Trigonaventralis蜂蜜中蔗糖含量仅0.80%(梁馨文等,2018)。本研究发现,糖液经弗里熊蜂B.friseanus贮藏4~7 d后,其中蔗糖平均含量为28.27%,果糖为17.58%,葡萄糖为16.67%,表明弗里熊蜂B.friseanus酿造的蜂蜜中蔗糖仍占优势,进一步表明蜂蜜中的糖组分及其比例与物种有关。此外,弗里熊蜂B.friseanus酿造蜂蜜的后期蔗糖含量不降反升,可能是由于糖液贮藏后期熊蜂群发育快速,内勤蜂消耗了蜜罐中的糖液,外勤蜂重新将饲喂瓶中的新鲜糖溶液添加到蜜罐中,导致样品中的蔗糖含量波动,进而影响其他糖组分的含量变化。综上所述,显示蜜蜂科的不同物种酿蜜生物学不同。
本实验蜜罐中的麦芽糖含量随着蔗糖含量的增加而显著降低(Pearsonr=-0.72,P<0.01),尤其贮藏5,6和7 d的样品最明显(表1),可能是熊蜂分泌并添加了某种异构酶使得蔗糖和麦芽糖相互转化。据报道,单糖被昆虫吸收到血液后,会在脂肪体细胞中合成海藻糖,同时转化成糖原贮藏在细胞中(Kuniedaetal.,2006)。另外,酵母、霉菌、藻类、低等维管植物等生物体中也广泛存在海藻糖,已经证实海藻糖对多种生物活性物质具有非特异性保护作用(赵晓峰和吴荣书,2004)。一些微生物体内存在海藻糖合酶,可以将麦芽糖转化成海藻糖和葡萄糖(吴傲等,2019)。因此,本研究在蜜罐中检测到的海藻糖可能来源于熊蜂体内,通过熊蜂吞吐糖液而添加,也可能来源于熊蜂消化道内的共生菌。处理组均检测到α-淀粉酶和转化酶,对照组均未检测到这两种酶,说明蜜罐糖液中的生物酶是由弗里熊蜂B.friseanus在取食糖液或者酿造蜂蜜的过程中添加的。蜜蜂的工蜂在采集花蜜和酿造蜂蜜的过程中,混入其唾液腺和咽下腺的分泌物,其中淀粉酶和转化酶使得蜂蜜的化学组分高度复杂(Al-Sherifetal.,2017)。淀粉酶能提高蜜蜂对二糖的利用率,使工蜂飞行更长的时间,对花粉的预消化也十分重要(Hrassniggetal.,2005)。前人研究表明,蜂蜜中转化酶的本质为α-葡萄糖苷酶(White and Maher,1953),具有水解蔗糖、麦芽糖和海藻糖的作用,将其转化为葡萄糖和果糖(Kubotaetal.,2004;Parvanovetal.,2012),且在蜂蜜贮藏过程中继续作用,使蔗糖含量持续下降,转化糖含量相应升高,增加蜂蜜的渗透压。因此,本研究蜜罐样本中检测到的果糖和葡萄糖是由于熊蜂添加的转化酶的作用。
Lichtenberg-Kraag(2014)论证了在蜜蜂酿造的蜂蜜成熟过程中蔗糖浓度与转化酶活性之间存在极显著相关性,蜂蜜中剩余的蔗糖含量越高,检测到的转化酶活性就越低。本研究弗里熊蜂B.friseanus贮藏在蜜罐1~7 d的糖液中转化酶活性差异不显著(P>0.05),平均27.01~28.85 U/g FW,而蔗糖含量却随贮藏时间的延长显著升高(表2),推测弗里熊蜂B.friseanus贮藏在蜜罐中的糖液的蔗糖浓度与转化酶活性之间可能不存在显著相关性;此外,除了贮藏6 d后的糖液中α-淀粉酶活性显著升高至82.86 U/g FW外,其余几天的样品α-淀粉酶活性差异不显著(P>0.05)(表2)。但东方蜜蜂A.cerana和西方蜜蜂A.mellifera酿造的蜂蜜中淀粉酶和转化酶含量在工蜂采集花蜜以及随着在蜂巢中酿造时间(7 d内)的延长而显著增加(宗德琴等,2015;叶梦迪等,2017)。Al-Sherif等(2012)对咽下腺的研究表明,卡尼鄂拉蜂Apismelliferacarnica和埃及蜜蜂Apismelliferalamarckii的工蜂在不同的生活阶段,咽下腺分泌的转化酶、葡糖氧化酶和淀粉酶的量不同。已有研究人员提出花蜜的粘度决定了蜜蜂分泌的唾液量,从而影响酶的分泌量(Lichtenberg-Kraag,2014)。另外,蜂群内的条件如空间大小、蜂群密度以及蜜蜂的遗传差异也能够影响蜂群之间转化酶和淀粉酶的活性差异(Lichtenberg-Kraag,2014)。因此,本研究蜜罐中糖液的α-淀粉酶和转化酶的活性整体上没有随着在蜂巢中贮藏时间的延长而显著升高或者下降,可能是因为熊蜂的酶体系与蜜蜂存在很大差异,分泌酶的活动更加复杂以及熊蜂的个体遗传差异和特殊的贮蜜行为。据报道,熊蜂能够快速评估糖浓度发生改变的花朵,并能够快速地将花朵的颜色、气味等信号与花朵的热量值或“可获得的净能量”联系起来(Cnaanietal.,2006;Nachevetal.,2013)。实验中观察到,与蜜蜂持续性贮蜜不同,熊蜂为阶段性贮蜜,在蜜罐中贮藏3~4 d后,熊蜂会选择性地取食浓度较高的糖液,继而再次将饲喂瓶中新鲜的浓度较低的糖溶液贮藏到空的蜜罐中,这种特殊的贮蜜方式决定了蜜罐样品中糖液的浓度、糖组分及α-淀粉酶和转化酶活性是波动变化的,而不是线性升高或下降。
总而言之,弗里熊蜂B.friseanus将蔗糖溶液贮藏在蜜罐中,脱去多余水分,添加生物酶,经过一段时间转化成含有多种糖组分、成分多样的糖溶液,表明其具有酿造蜂蜜的能力。

