益生菌联合奥替溴铵治疗腹泻型肠易激综合征有效性与安全性的meta分析
郑俊佳,黄彬,张竞超,龙莎
肠易激综合征(Irritable bowel syndrome,IBS)为消化系统的常见病和多发病,是一种慢性、周期性、复发性的功能性肠病,其特征是腹痛伴有排便习惯改变或腹胀[1]。其发病机制尚未明确,可能与肠蠕动障碍、肠通透性改变、内脏高敏感性及肠道菌群失调等因素相关。IBS分为腹泻型、便秘型、混合型和不定型,其中腹泻型发病率较高[2]。长期腹泻,除了影响患者健康外,肠易激综合征还与生活质量受损、工作效率降低、健康和经济成本增加有关[1]。
奥替溴铵是一种选择性钙通道拮抗剂,在临床中常用于胃肠道痉挛的治疗。有研究[3-4]报道,奥替溴铵可用于缓解腹泻型肠易激综合征(D-IBS)的症状。益生菌也常被用于D-IBS的治疗,可改善D-IBS的肠道菌群,有研究[5]显示,单用益生菌能改善D-IBS的疗效,但研究结论不一致。近年来,益生菌联合奥替溴铵的随机对照试验(randomized controlled trial,RCT)报道也渐渐增多,由于纳入的样本量偏少,临床治疗效果评价不一致,使得此方案的疗效和不良反应发生率都不明确。因此,本研究使用Meta分析系统评价益生菌联合奥替溴铵治疗D-IBS的有效性和安全性,为临床治疗提供循证参考。
1 资料与方法
1.1 资料
1.1.1 研究对象 患者符合《肠易激综合征诊断和治疗的共识意见(2007,长沙)》[6]或国际公认的罗马Ⅲ[7]等IBS诊断标准,且以腹泻型为主要临床表现;患者性别、年龄、病程不限。
1.1.2 干预措施 试验组患者给予奥替溴铵+益生菌;对照组患者给予奥替溴铵,治疗疗程均大于等于4周,对于两组药物使用频次、药物剂量等不作限制,但治疗组和对照组使用奥替溴铵的剂量、频次、疗程等需一致。
1.1.3 纳入标准 (1)研究类型:数据库已公开发表的关于益生菌联合奥替溴铵治疗D-IBS的随机对照研究;(2)研究对象为人;(3)纳入文献为中文或英文的全文文献。
1.1.4 排除标准 ①非RCT研究;②治疗结局指标或对照组不符合要求的文献;③重复发表的文献;④数据缺失或前后不一致的文献。
1.1.5 结局指标 ①总有效率;②治疗后肿瘤坏死因子-α浓度;③治疗后白细胞介素-8水平;④腹泻改善时间;⑤腹部不适改善时间;⑥不良反应发生率。疗效判定标准[8]:显效表现为腹泻症状消失,腹部不适现象也消失,排便恢复正常;有效表现为腹泻症状基本消失,腹部不适缓解,排便也减少;无效表现为治疗前后症状不显著改变。治疗总有效率=(显效+有效)/总人数×100%。
1.2 方法
1.2.1 文献检索 计算机检索EMBASE、Pubmed、Cochrane Library、万方、中国生物医学文献数据库、维普及中国知网。中文检索词为“奥替溴铵”、“肠易激综合征”、“腹泻型肠易激综合征”、“益生菌”、“酵母菌”、“乳酸杆菌”、“双歧杆菌”及“大肠杆菌”。英文检索词为“Otilonium Bromide”、“probiotics”、“bifidobacterium”、 “saccharomycetes”、“lactobacillus”、“escherichia coli”、“irritable bowel syndrome”、 “IBS”及“D-IBS”。检索时限均为各数据库建库起至2020年11月。中文数据库检索策略: #1奥替溴铵;#2 益生菌 or 酵母菌or 乳酸杆菌 or 双歧杆菌or 大肠杆菌;#3 肠易激综合征;#1 and #2 and #3。英文数据库检索策略:#1(“Otilonium Bromide”) and #2(“probiotics”or “saccharomycetes” or “lactobacillus” or “bifidobacterium” or “escherichia coli”) and #3(“irritable bowel syndrome”or“IBS” or“D-IBS”)。
1.2.2 资料提取与质量评价 由2位研究人员根据纳入及排除标准单独完成文献筛选、资料提取并进行交叉核对,若存在争议时通过分析讨论或根据第三方的建议解决。文献提取主要包括三方面内容①文献基本信息,如第一作者、发表年份;②患者基本信息,如性别比例、年龄;③研究的主要信息,如样本量、干预措施、疗程及结局指标。依照Cochrane 协作网提供的偏倚风险评估工具,从以下方面:随机序列;分配隐藏;对研究者和受试者实施盲法;对结局指标的盲法;结果数据报告的完整性;选择性报告研究结果和其他偏倚来源对文献质量进行评价。
1.3 统计学分析
文献中提取的数据使用Microsoft Excel 电子表格记录,运用RevMan5.3进行meta分析。根据P值和I2,对纳入的研究进行统计学异质性分析。当纳入的研究之间无明显异质性,即满足P≥0.1且I2≤50%,则使用固定效应模型分析;当存在明显异质性,即满足P<0.1且I2>50%,则使用随机效应模型,并进行敏感性分析。此外,二分类变量使用相对危险度RR及其 95%CI表示,连续性变量使用标准化均数差SMD及其95%CI表示,并以P<0.05为差异有统计学意义。最后利用漏斗图分析主要指标总有效率评价发表偏倚。
2 结果
2.1 文献检索结果
初步检索得到文献147篇,删除重复文献后剩39篇,阅读标题和摘要,排除临床非RCT研究、研究主题不一致和与干预对照措施不符后剩20篇文献,进一步阅读全文,排除结局指标不符、前后数据不一致后,最终纳入10篇文献,共计956例患者。纳入文献基本信息见表1。文献检索流程见图1。

表1 纳入文献的基本信息
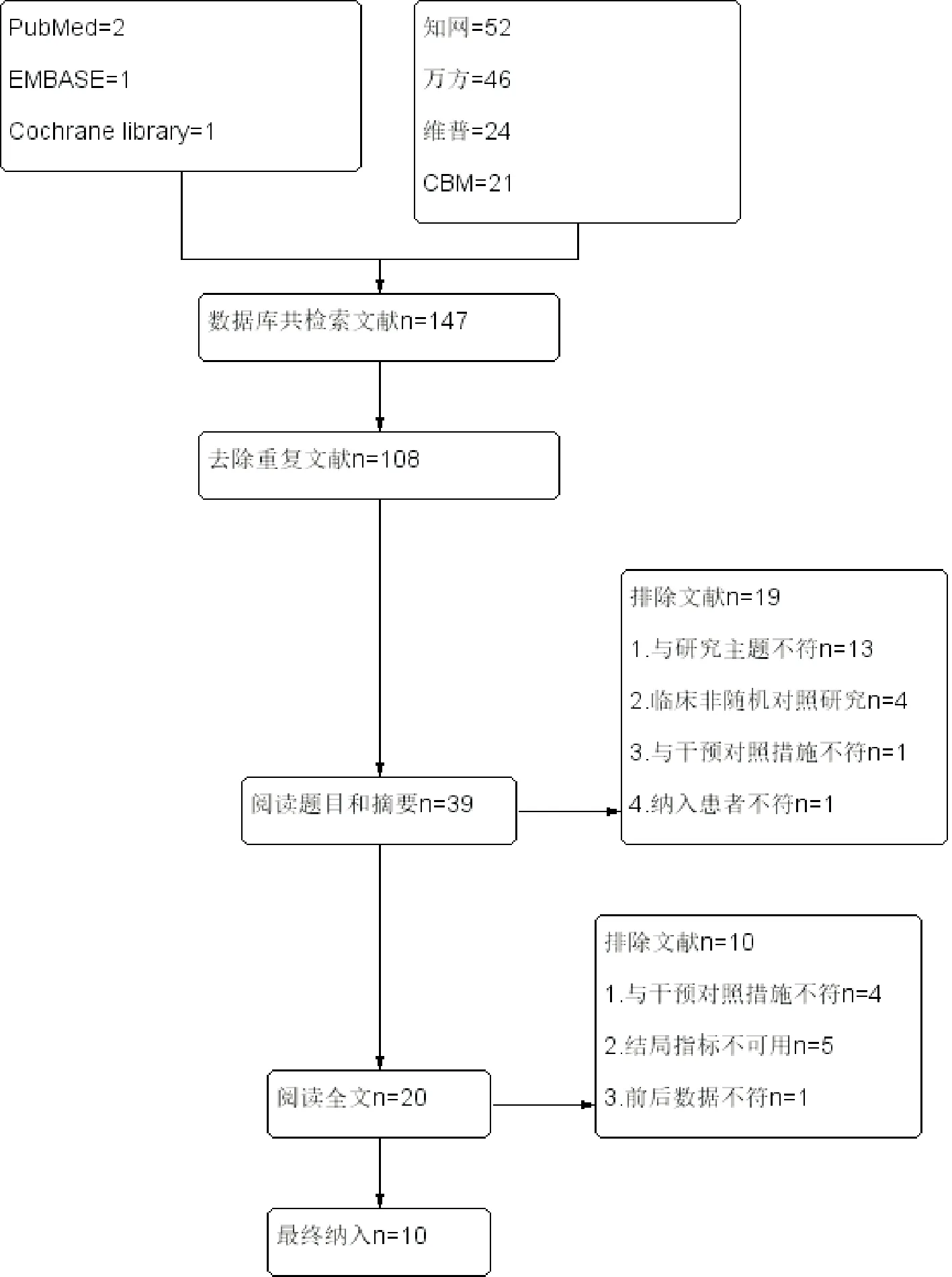
图1 文献筛选流程
2.2 纳入文献的质量评价
纳入的10篇文献都是临床随机对照研究,有4篇[11-13,15]采用了随机数字表法,2篇[8,17]报道了患者签订知情同意书。纳入研究[8-17]均采用了统计学软件SPSS进行统计,试验组与对照组例数一致,均完整报告了结果数据,但都没有提及是否设计了盲法、分配隐藏和是否存在其他偏倚来源,详见图2、图3。

图2 纳入文献风险评估条形图

图3 偏倚风险图
2.3 Meta分析结果
2.3.1 总有效率 共有7篇文献[8,10,12,14-17]研究描述了总有效率,各研究间不存在明显异质性(P=0.17,I2=33%),因此采用了固定效应模型,见图4。该结果显示,总有效率试验组较对照组明显提高,差异有统计学意义[RR=1.25,95%CI:1.16~1.34,P<0.000 01]。
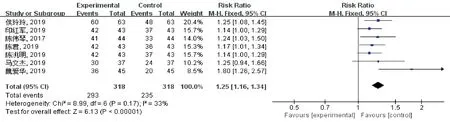
图4 两组患者总有效率meta分析森林图
2.3.2 治疗后肿瘤坏死因子-α浓度 共有3篇文献[9、11、15]研究描述了治疗后肿瘤坏死因子-α浓度,各研究间存在明显异质性(P<0.000 01,I2=94%),因此采用了随机效应模型,见图5。该结果显示,治疗后肿瘤坏死因子-α浓度试验组较对照组明显降低,差异有统计学意义[SMD=-2.28,95%CI:-3.47~-1.10,P=0.000 2]。
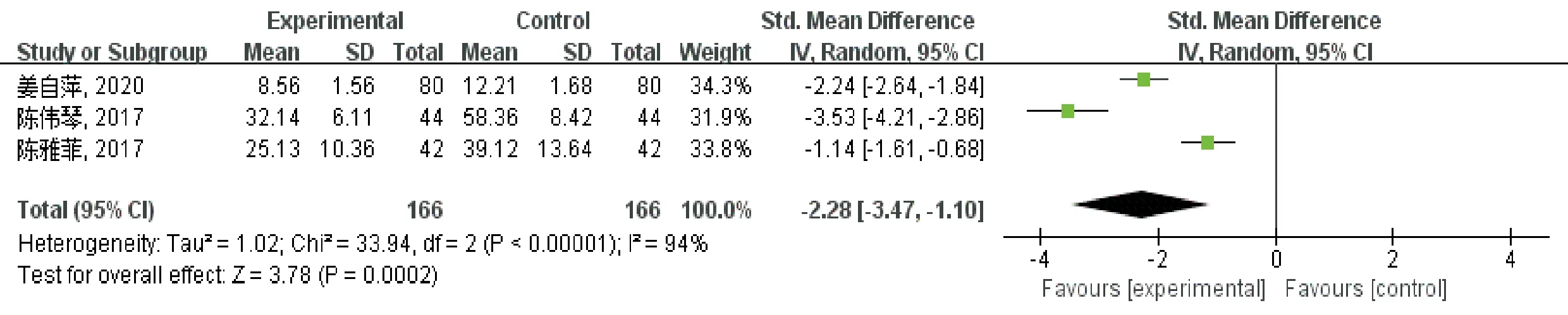
图5 治疗后肿瘤坏死因子-α浓度meta分析森林图
2.3.3 治疗后白细胞介素-8水平 共有2篇文献[9,15]研究描述了治疗后白细胞介素-8水平,各研究间存在明显异质性(P=0.01,I2=85%),因此采用了随机效应模型,见图6。该结果显示,治疗后白细胞介素-8水平试验组较对照组明显降低,差异有统计学意义[SMD=-2.16,95%CI:-3.14~-1.17,P<0.000 1]。

图6 治疗后白细胞介素-8水平meta分析森林图
2.3.4 腹泻改善时间 共有5篇文献[8,10,12,16-17]研究描述了腹泻改善时间,各研究间存在明显异质性(P=0.01,I2=68%),因此采用了随机效应模型,见图7。该结果显示,腹泻改善时间试验组较对照组明显降低,差异有统计学意义[SMD=-1.29,95%CI:-1.66~-0.92,P<0.000 01]。

图7 腹泻改善时间meta分析森林图
2.3.5 腹部不适改善时间 共有5篇文献[8,10,12,16-17]研究描述了腹部不适改善时间,各研究间不存在明显异质性(P=1,I2=0%),因此采用了固定效应模型,见图8。该结果显示,腹部不适改善时间试验组较对照组明显降低,差异有统计学意义[SMD=-1.79,95%CI:-2.01~-1.56,P<0.000 01]。
2.3.6 不良反应发生率 共有3篇文献[9,13-14]研究描述了不良反应发生率,各研究间不存在明显异质性(P=0.64,I2=0%),因此采用了固定效应模型,见图9。该结果显示,试验组与对照组间不良反应发生率比较,差异无统计学意义[RR=0.48,95%CI:0.18~1.29,P=0.14]。
2.4 敏感性分析
在总有效率中逐组去除研究后,发现剩余研究间仍然不存在明显异质性,试验组较对照组总有效率仍明显增高,且RR值变化不大,差异有统计学意义。当去除魏爱华组研究[12]时, I2 值变化较大,但均<50%,总体而言各研究之间不存在明显异质性,说明益生菌联合奥替溴铵治疗D-IBS的 Meta分析结果较为可靠稳定,详见表2。在腹泻改善时间中,去除马文杰组研究[16]后,发现剩余研究间不存在明显异质性(P=0.59,I2=0%),试验组腹泻改善时间仍显著低于对照组,差异有统计学意义[SMD=-1.46,95%CI:-1.70~-1.22,P<0.000 01]。其他指标因纳入文献较少,故不作敏感性分析。
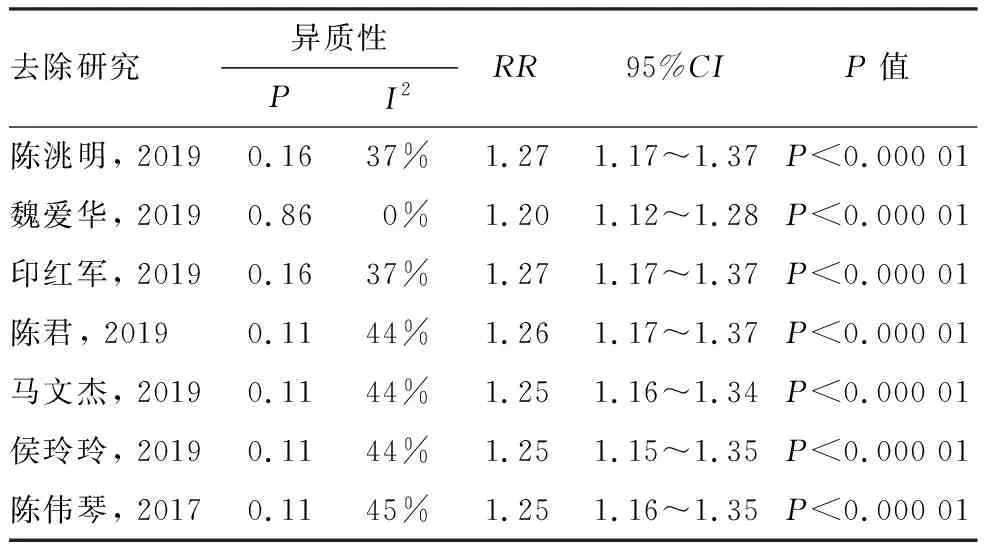
表2 总有效率敏感性分析结果
2.5 发表偏倚分析
把纳入研究的 RR 值作为横坐标,纵坐标为RR 值对数标准误 SE(log[RR])的倒数,对益生菌联合奥替溴铵治疗D-IBS的总有效率进行漏斗图分析。据图10可以发现研究散点基本落在漏斗图内,因此说明发表偏倚较小。其中[10]和[17]项研究的RR、RR 值对数标准误 SE(log[RR])的倒数一致,故两项研究的散点在漏斗图中重合。

图10 总有效率漏斗图
3 讨论
IBS是一种慢性功能性胃肠病,其特征是反复出现腹痛和异常的排便习惯,而没有结构和生化异常[18]。但其具体发病机制和病因尚未完全明确,因此IBS的治疗主要是对症治疗,以减轻和缓解症状。治疗IBS常用的药物是平滑肌松弛剂、止泻剂、止痛药物和益生菌制剂等。目前尚无一种药物可充分治愈IBS,而与药物联合使用,效果较好[19]。因此,临床上多采用2种或2种以上不同作用机制的药物联合治疗,以提高治疗效果。
奥替溴铵不仅是钙离子通道的阻滞剂,还是毒蕈碱受体和速激肽 NK-2受体的拮抗剂,其对胃肠道平滑肌选择性较高,因此能产生较好的解痉作用。其在欧洲、中美洲、亚洲(中国、印度、巴基斯坦、韩国和菲律宾)、中东和非洲(埃及、法属非洲国家)的40多个国家/地区已投放市场30多年[1],有研究[20]表明,口服奥替溴铵后,奥替溴铵血浆浓度一直很低,<1%的药物被尿液清除,97%被粪便清除。由于奥替溴铵在结肠环形肌中蓄积[21],因此认为其在胃肠道平滑肌水平起作用,而全身吸收最小。D-IBS的患者因易腹泻,药物随大便排出体外,导致治疗效果不佳[22]。
相关研究[23]认为,D-IBS主要是患者餐后结肠运动增强,排便次数增多,其发生可能与胃肠道菌群失调相关。奥替溴铵是治疗胃肠道痉挛和运动障碍的药物,但是其无法对胃肠道内部菌群产生影响,对于治疗D-IBS效果不明显。益生菌能够帮助改善肠道的菌群失调,补充有益菌,帮助改善肠道的微生态平衡,还能够促进人体的营养的吸收和利用,提高人体的免疫能力,使胃肠道运动恢复正常[24]。当胃肠道功能恢复后,奥替溴铵便能起到原有作用。
另外,D-IBS虽不是炎症性肠病,但患者会出现肠道短期感染现象,导致肿瘤坏死因子-α水平和炎症因子的升高,造成肠道平滑肌功能发生异常[25]。相关研究也表明[26],肠道菌群与炎性因子具有相关性,IBS 患者肠道菌群失调,会导致微生态结构紊乱,破坏肠黏膜和正常的细胞增殖分化活动,进而诱发炎症反应,使白细胞介素-8等促炎因子表达升高,进而加快 IBS 病理进展。因此,奥替溴铵和益生菌联合用药起到了协同的作用[2],肠道微生态的平衡,更有助于对奥替溴铵的吸收,使药物达到理想的效果,提高了临床疗效,更好地改善患者的症状。
本Meta分析结果显示,益生菌联合奥替溴铵在总有效率方面显著优于对照组。益生菌联合奥替溴铵在治疗后肿瘤坏死因子-α浓度、治疗后白细胞介素-8水平、腹泻改善时间及腹部不适改善时间上均低于对照组。在安全性上,不良反应发生率比较没有统计学意义。综上所述,益生菌联合奥替溴铵较于对照组能显著提高腹泻型肠易激综合征的疗效,改善临床症状,且不增加不良反应的发生。然而,本研究尚存在较多局限:(1)仅纳入了中文文献,尚缺乏国外的研究数据,有待进一步补充;(2)纳入文献数量有限,质量参差不齐,且样本量较小;(3)多数文献随机序列生成方式描述不详,所有文献均未对分配隐藏和盲法及其他偏倚来源作具体描述;(4)所有文献未提及是否存在退出及随访情况,大多数文献未报道患者是否签署知情同意书;(5)研究的益生菌种类较少,且用量和疗程等方面存在差异。所以,此结论希望以后能有更多大样本、高质量的RCT来进一步证实。

