IPN智能水凝胶药物缓释体系的设计及评价
王欣雅,吉木色,甘秋兰,黎千榕,张尚文,胡 婕,文治杰,胡 燕
(1.中南民族大学药学院,湖北 武汉 430074; 2.中南民族大学民族药学国家级实验教学示范中心,湖北 武汉 430074)
1 引 言
水凝胶(hydrogels)是一种能在水中溶胀,并能保持三维立体结构的聚合物材料[1-2]。其具有良好的溶胀性能和物理机械性能,在组织工程骨架材料、药物载体材料、3D打印材料等多方面均有重要的应用[3-4]。
海藻酸钠(sodium alginate, SA),由M单元(β-D-甘露糖醛酸)和G单元(α-L-古罗糖醛酸)残基按1,4键连接而组成[5],如图1所示。易与二价阳离子如Ca2+发生交联反应,形成的水凝胶具有良好的生物相容性、生物活性和可降解性[6-7]。但在以往的研究中发现,单一的SA水凝胶在肠道弱碱性环境中结构不稳定,易瓦解,限制了其在口服药物输送方面的应用。
壳聚糖(chitosan, CS)广泛存在于甲壳类动物的外壳中,是大自然中除纤维素外丰度最大的一种碱性多糖[8-9],如图2所示。CS分子中存在很强的氢键作用,使其存在溶解性差、透光度低等缺点,一定程度上限制了其应用范围[10-11]。羧化壳聚糖(carboxylated chitosan, CMCS)是由CS羧甲基化得到,是CS最重要的衍生物之一,具有优良的乳化性、成膜性、保湿性等特点[12],在医药领域常被用为药物载体材料[13],也是制备水凝胶的常用材料。
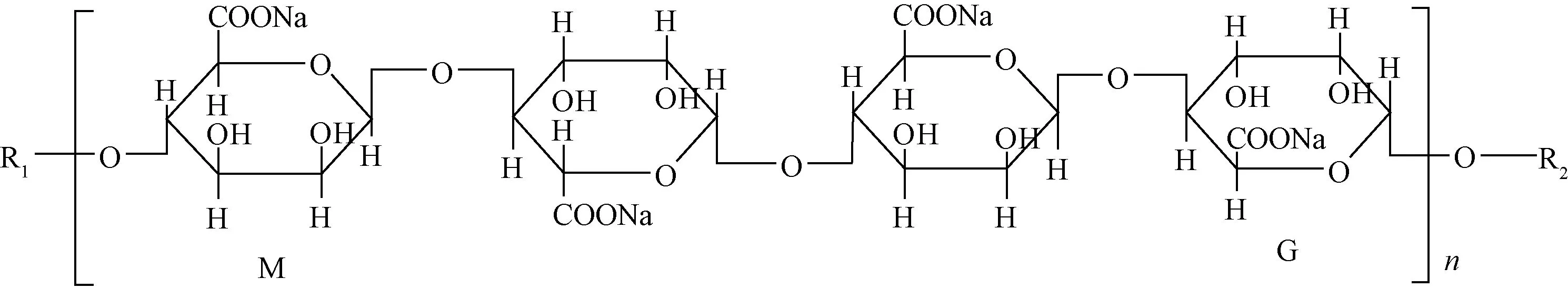
图1 SA的分子结构Fig. 1 Molecular structure of SA
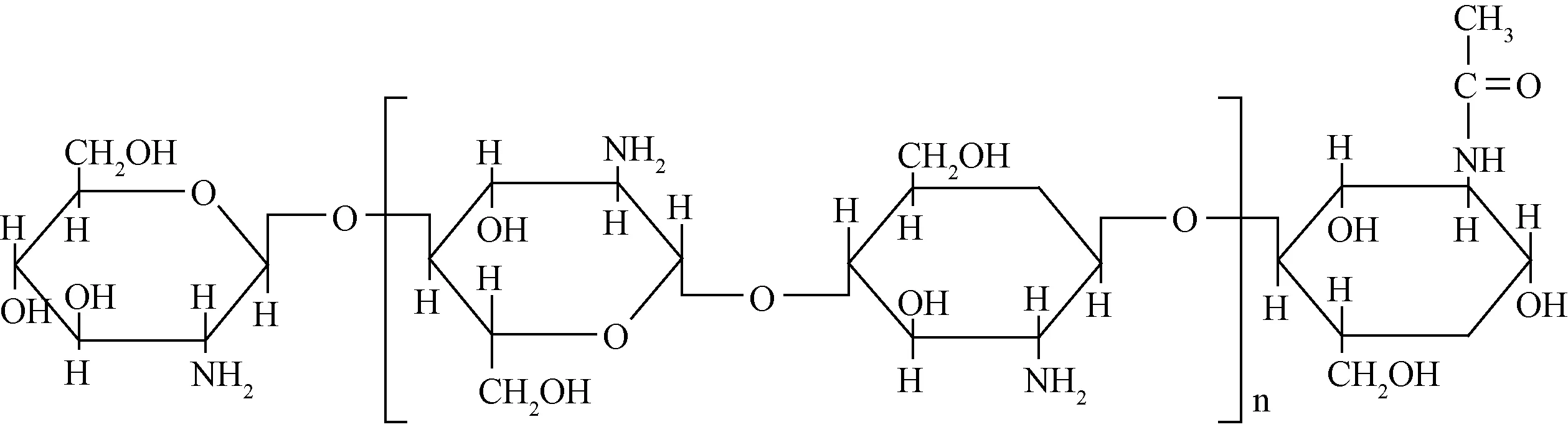
图2 CS的分子结构Fig. 2 Molecular structure of CS
本实验以价廉易得的SA和CS为原料,利用高碘酸钠氧化SA引入醛基与CS的水溶性衍生物CMCS形成共价键进行化学交联,同时将SA和钙离子进行物理交联形成互穿网络,外层再以复凝聚法形成聚电解质缓释膜,通过整合SA和CS及其衍生物的性能优点,以克服单一SA水凝胶突释漏释及网络易瓦解的缺陷,从而得到一种新型的稳定性佳、修饰性良好的缓释载药体系。由于制备原料都具有环境敏感基团,决定了形成的复合水凝胶具有良好的pH敏感性[14-15]。根据其特点,拟通过模拟胃肠道口服给药的方式,依据其对pH值的敏感度调节该水凝胶对各药物的释放速率,从而达到定位缓控释的目的。
2 实 验
2.1 原料
试验原料为化学纯的海藻酸钠(SA);食用级壳聚糖(CS)(MW=1×105);分析纯的羧化壳聚糖(CMCS)、无水氯化钙、磷酸二氢钾(KH2PO4)、氢氧化钠(NaOH)、冰醋酸、牛血清白蛋白(BSA)、考马斯亮蓝G-250、吲哚美辛和盐酸二甲双胍;85%浓盐酸(HCl)和磷酸(H3PO4)。
2.2 复合水凝胶的制备
称取10 g SA加入到100 mL 50%乙醇溶液中,待完全分散均匀后加入3 g高碘酸钠,室温避光搅拌6 h,加入5 mL乙二醇后反应0.5 h终止氧化反应。将反应后的溶液装入透析袋(Cut off Mw=8000~14000)中,用蒸馏水透析72 h。高碘酸钠氧化SA的反应机制如图3所示。抽滤后将滤液进行浓缩,将浓缩液放入-80 ℃冰箱中预冻12 h,冷冻干燥,即得氧化海藻酸钠(OSA)。

图3 SA的氧化反应Fig. 3 Oxidation of SA
称取一定量的OSA、SA、CMCS溶于装有蒸馏水的圆底烧瓶中,搅拌至溶解。用滴制法将混合溶液滴加到0.2 mol/L CaCl2溶液中,搅拌30~50 min,得到球形凝胶珠。将凝胶珠转移至CS溶液中交联,用去离子水洗涤3次后,吸水纸拭去凝胶珠表面残留的水分,置于塑料板上室温风干即得复合水凝胶,其制备原理如图4所示。
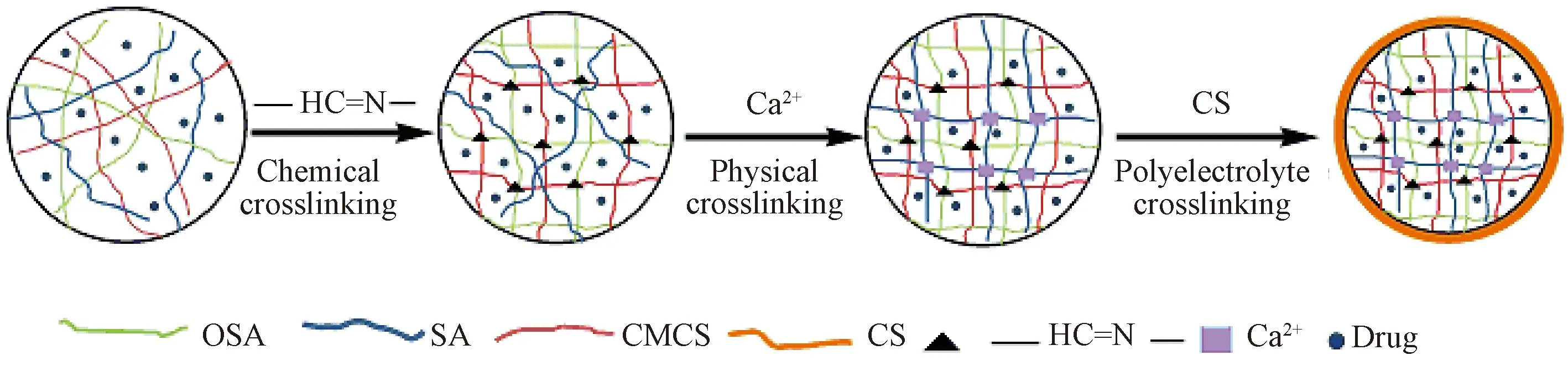
图4 复合水凝胶制备原理图Fig. 4 Preparation mechanism of the composite hydrogels
2.3 复合水凝胶的结构表征
用数码相机记录新鲜制备、室温干燥及溶胀后三种状态下凝胶珠的外部形貌。
取冷冻干燥后水凝胶样品,采用JEOL JSM-6700F型扫描电镜(SEM)观察水凝胶内部结构。
取冷冻干燥后水凝胶样品置于红外灯下干燥,按1∶99与溴化钾混合,研磨后压片,制得透明试样薄片,将此片放入Spectrum One, Perkin Elmer型红外光谱仪(FTIR)的样品池中,以4000~400 cm-1为范围进行波数扫描,得到红外吸收光谱。
取冷冻干燥后水凝胶样品通过TG 209F3型热重分析仪(TG)进行热稳定性分析,以10 ℃/min 的升温速率,从40 ℃升温至500 ℃得到热重曲线。
取冷冻干燥后水凝胶样品,采用X’Pert PRO 型X射线衍射仪(XRD)测定冷冻干燥后水凝胶样各个样品的晶型结构。电压为40 kV,扫描速度为1 °/min,衍射角2θ=4~40°。
2.4 复合水凝胶的溶胀度测试
称取一定质量室温干燥后的水凝胶样品,37 ℃水浴中,前2 h放于模拟胃液(SGF,pH=1.2),后换为模拟肠液(SIF,pH=7.4),每30 min记录一次质量,直至凝胶的质量不再变化,按式(1)计算溶胀率(SR)。
SR=(mt-m0)/m0
(1)
式中:mt为各时间点凝胶珠的质量,m0为干燥的凝胶珠的质量。
2.5 复合水凝胶的载药与释药测试
分别以大分子蛋白类药物牛血清白蛋白(BSA),小分子水溶性药物盐酸二甲双胍(MH),及小分子水不溶性药物吲哚美辛(IDM)为模型药物,探索了复合水凝胶的载药与释药行为。载药具体方法如下:称取一定质量的药物溶于装有去离子水(IDM为乙醇水溶液,无水乙醇:水的比例为1∶1),待完全溶解后(药物浓度为10 mg/mL),加入OSA,SA与CMCS,搅拌均匀后按照2.2.2项同法制备载药水凝胶。
在模拟胃肠液中研究复合水凝胶的释药行为。称取一定质量室温干燥后的水凝胶置于锥形瓶中,加入50 mL SGF溶液,37 ℃,80 rpm的条件下进行试验,每隔0.5 h取样1 mL,同时补充1 mL SGF溶液,2 h后换为SIF溶液,按相同的方法进行取样。
以BSA为模型药物,利用Bradford法,将取出的样品按一定比例用考马斯亮蓝染液进行染色,于595 nm波长下进行紫外检测。根据标准曲线计算BSA含量。用时间与累积释药率绘图,即得到BSA的释放曲线。
以MH和IDM为模型药物时,分别在233和320 nm波长下进行紫外检测并计算释药量,同样绘制释药曲线。
累积释药率(Qn)按下式进行计算:
Qn(%)=[V0Cn+V∑C(n-1)]/W×100%
(2)
式中,Cn为第n次取样时样液中药物浓度(μg/mL),V为每次取样体积,本实验中为1 mL,V0为释药介质体积,本实验为50 mL,W为载药量(μg)。
3 结果与讨论
3.1 复合水凝胶的表征
新鲜制备的水凝胶为浅黄色球状,直径约为5 mm(图5a)。凝胶室温干燥后脱去大量水分,颜色变深,体积明显缩小至2 mm左右(图5b)。溶胀后的凝胶外部颜色逐渐变浅,直径约8 mm,随着溶胀时间的延长,凝胶外层结构开始瓦解,但凝胶内部并未完全溶胀,结构保持完整,如图5c所示。

图5 复合水凝胶 (a.新鲜状态;b.干燥状态和c.溶胀状态)的外观形貌照片Fig. 5 Morphologies of composite hydrogels in different state. (a. in fresh state; b. in dried state; c. in swollen state)
图6为复合水凝胶在不同放大倍数下的SEM照片,从图6a可以看出凝胶内部的结构很不规则,部分区域成片层状;图6b、c可以看出凝胶内部的空间很大并且形成了孔洞结构。但孔洞较大,对药物的释放会有一定的阻滞作用,特别是对于大分子药物的释放会有很好的缓释作用。

图6 不同放大倍数(a×30;b×45;c×100)下复合水凝胶的扫描电镜照片Fig. 6 SEM images of composite hydrogels with different magnification (a×30;b×45;c×100)
从图7可见,CMCS在3464 cm-1处是-NH和-OH的伸缩振动重叠,2946 cm-1处为-CH2的伸缩振动,1658 cm-1处是C=O的伸缩振动峰[16]。SA在3417 cm-1处的吸收峰属于O-H的伸缩振动峰,2929 cm-1处为SA大分子六元环上C-H键的伸缩振动峰,1610和1417 cm-1处的吸收峰分别归属于海藻酸的COO-的对称伸缩振动和不对称伸缩振动,1032 cm-1处对应于拉伸的糖醛酸G链和M链的-C-O振动吸收峰。复合水凝胶在接近1653 cm-1处的吸收峰可归属为-C=N-的伸缩振动,说明OSA与CMCS发生了化学交联[17]。
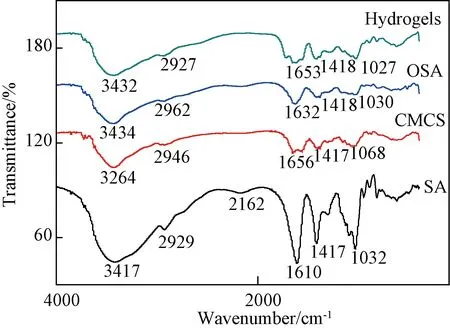
图7 复合水凝胶的红外光谱图Fig. 7 FTIR spectra of the composite hydrogels
图8(a)为复合水凝胶质量随温度的失重累积量,图8(b)为热重曲线对温度的一阶导数曲线,即试样随温度的质量变化率。凝胶样品中含有自由水、中间水和结合水,升温导致凝胶样品的质量逐渐下降。从图可见,OSA在200~280 ℃之间出现明显失重、CMCS在220~450 ℃范围内出现明显失重,且失重速率较快;OSA-CMCS复合水凝胶在200~350 ℃之间出现明显失重,且失重速率缓慢。这说明OSA-CMCS复合水凝胶的热稳定性较原料OSA、CMCS有所提高。
复合水凝胶的XRD图谱见图9。从图可见,SA在14°处出现明显的衍射峰,CS在20°处出现明显的衍射峰,CMCS在20°处也出现明显的衍射峰,说明制备复合水凝胶的三种原料SA、CMCS、CS均具有晶形结构,而复合水凝胶的XRD曲线并未出现尖锐的衍射峰,说明制备的复合水凝胶由于物理和化学交联作用的发生,无定型结构增加。
3.2 复合水凝胶的溶胀性能探究
图10(a)中溶胀率随CMCS的浓度呈现线性变化。其中,1%CMCS的溶胀率最大,可达32,但其达到最大溶胀率后迅速下降,凝胶的稳定性较同组其他样品较差;综合考虑溶胀率和溶胀时间等因素,得出3% CMCS凝胶溶胀行为最佳,其最大溶胀率可达30,溶胀时间达8 h。图10(b)中前5 h凝胶的最大溶胀率随OSA的浓度呈现规律性变化。其中,当OSA浓度为2%时,复合水凝胶的平衡溶胀率最大,7 h时达到17后缓慢下降。图10(c)中,当OSA∶SA的比例为1∶1时,复合水凝胶在7 h时达到最大溶胀率32。

图8 复合水凝胶的热重分析图 (a)热重曲线;(b)微分热重曲线Fig. 8 TG curve (a) and DTG curve (b) of OSA, CMCS, and the composite hydrogels
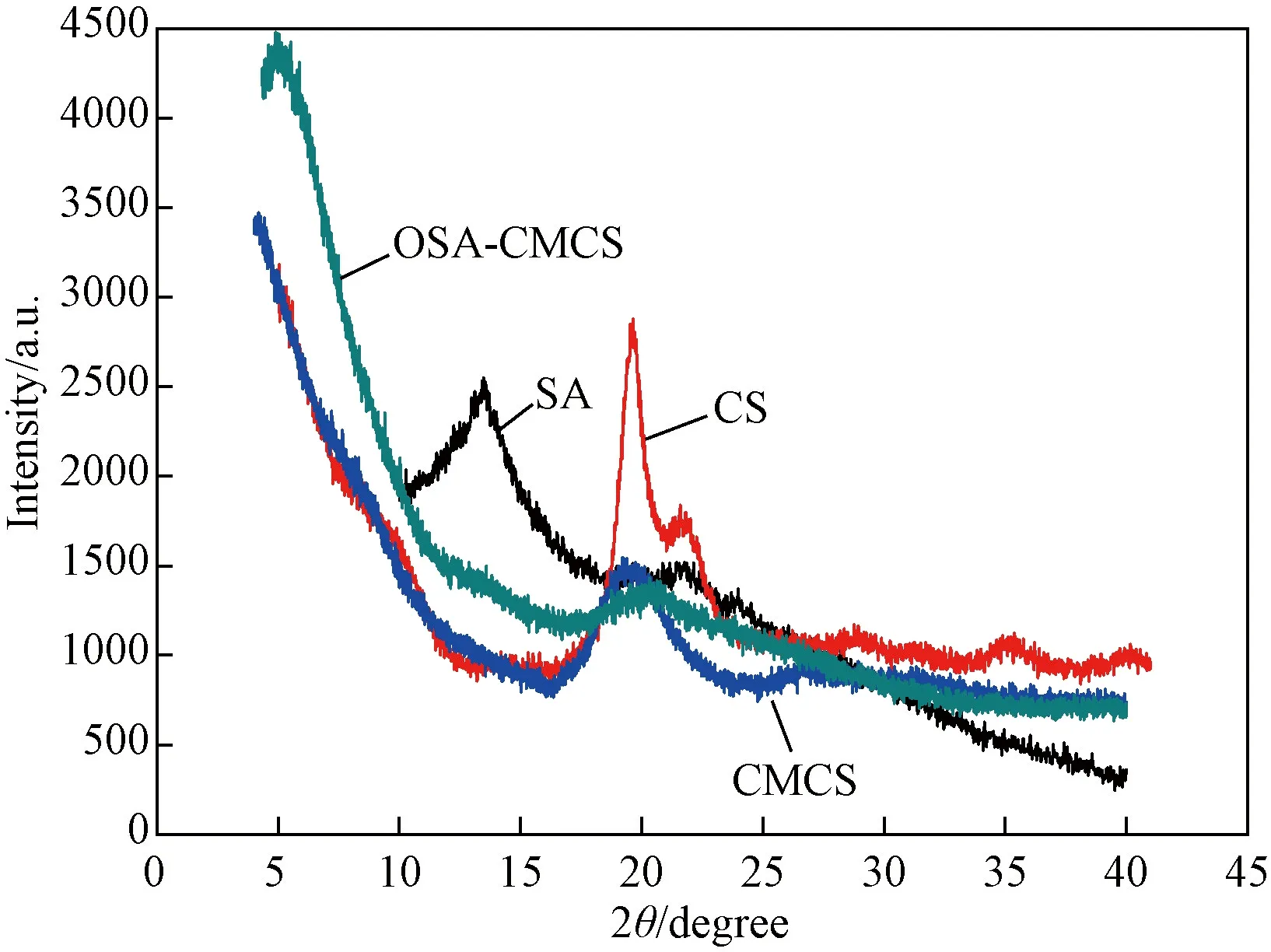
图9 复合水凝胶的X射线衍射图Fig. 9 X-ray diffraction patterns of the composite hydrogels
在SGF溶液中,由于溶液中H+的扩散作用,CS中的氨基发生质子化,水凝胶球表面带正电荷,SA中以-COOH形式存在,所以水分子渗透作用不明显,在SGF中普遍最大溶胀率仅有1.5左右。但置于SIF溶液后,环境成弱碱性,SA分子中的-COOH以-COO-形式存在,基团之间的作用力增强,凝胶内部空间变大,从而溶胀率大大增加。
从图11(a)中可以看出随着CS浓度的增加,复合水凝胶的最大溶胀率也随之增加,这是因为CS浓度增加,凝胶表面与SA作用的CS分子增加,形成了更稳固的CS膜,在溶胀过程中能有效保护水凝胶结构的完整性,从而提高水凝胶的最大溶胀率,可达33左右。图11(b)中,成膜时间为60 min时,水凝胶溶胀行为最佳,平衡溶胀率最大。所制得的水凝胶中,溶胀率最大可达33.59。
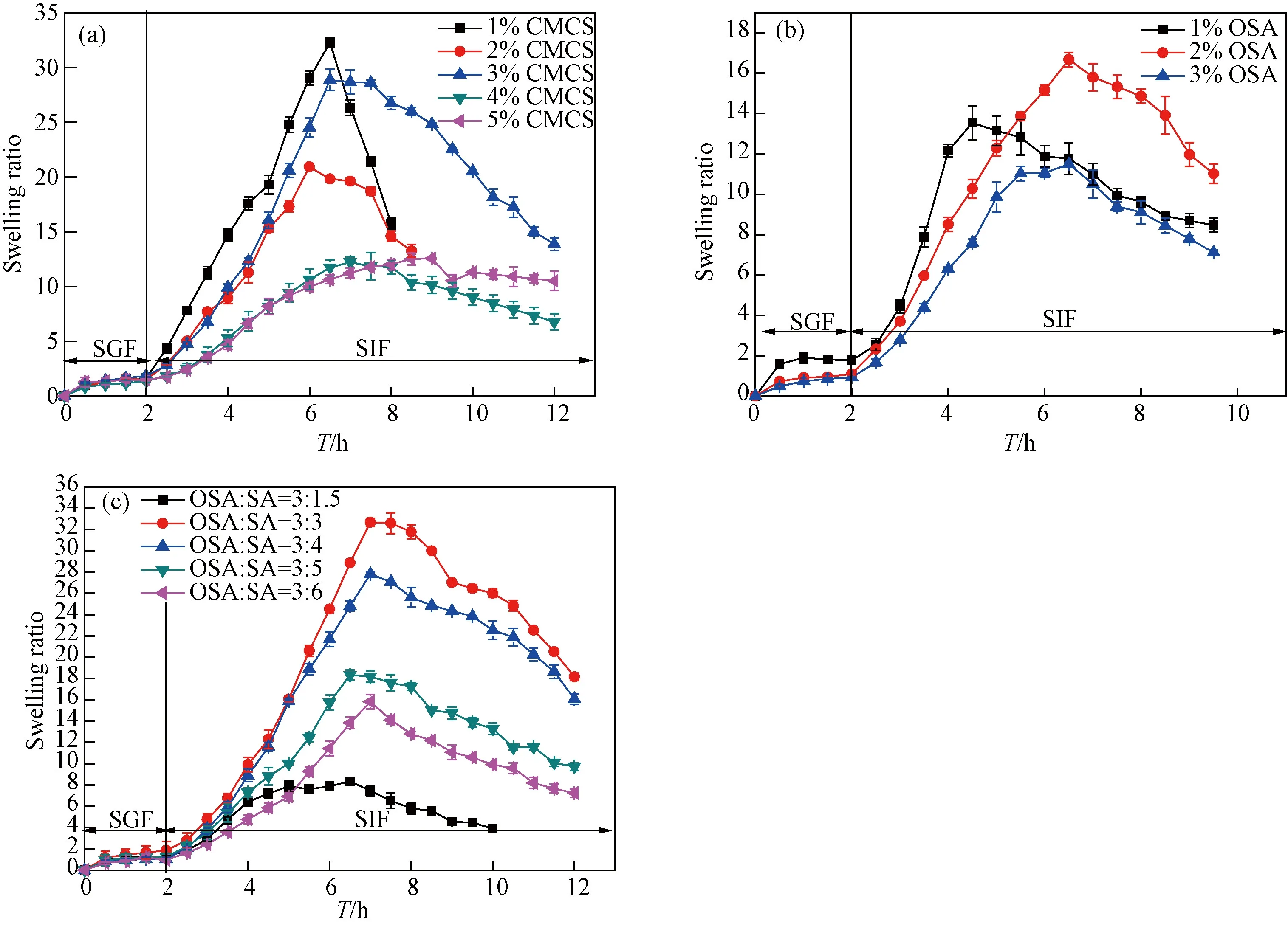
图10 不同组成的复合水凝胶的溶胀曲线图 (a) 不同的CMCS浓度; (b) 不同的OSA的浓度; (c) 不同的OSA和SA配比Fig. 10 Swelling profiles of composite hydrogels with different composition (a) different CMCS concentration; (b) different OSA concentration; (c) different feed ratio of OSA to SA

图11 不同制备条件下的复合水凝胶的溶胀曲线图 (a) 不同的成膜浓度; (b) 不同成膜时间Fig. 11 Swelling profiles of composite hydrogels in different preparation condition. (a) the membrane preparation by different CS concentrations; (b) the different membrane formation time
3.3 复合水凝胶的药物释放行为研究
3.3.1载不同药物的复合水凝胶释药行为 图12分别为以2%、3% OSA为原料制备的复合水凝胶对不同药物的累积释药曲线。从图12(a)可以看出当OSA浓度为3%时,水凝胶在SGF中对BSA的累计释放率极低,低于1%,当改变OSA浓度为2%时,BSA在SGF中的累计释放率达10%。从图12(b)可以看出,OSA浓度的改变对MH的释放行为影响不大。从图12(c)可以看出,两条释放曲线在SGF中基本重合,并且释药缓慢。综合上述情况,最终选择当OSA的浓度为3%时进一步比较复合水凝胶对不同类型药物的释药行为。
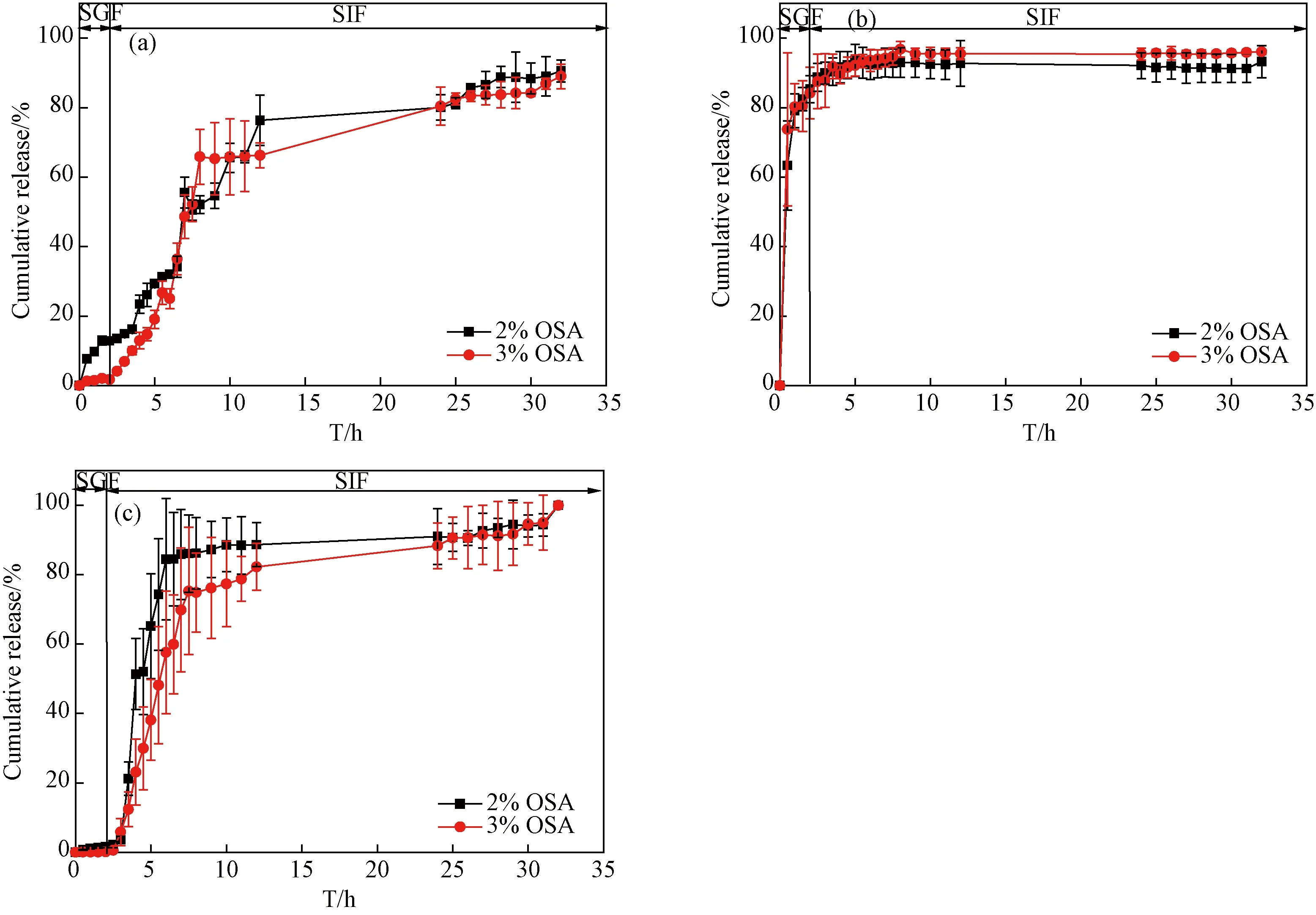
图12 复合水凝胶的累积释药曲线图(a) BSA; (b) MH; (c) IDMFig. 12 Cumulative drug release curve of the composite hydrogels (a) BSA; (b) MH; (c) IDM
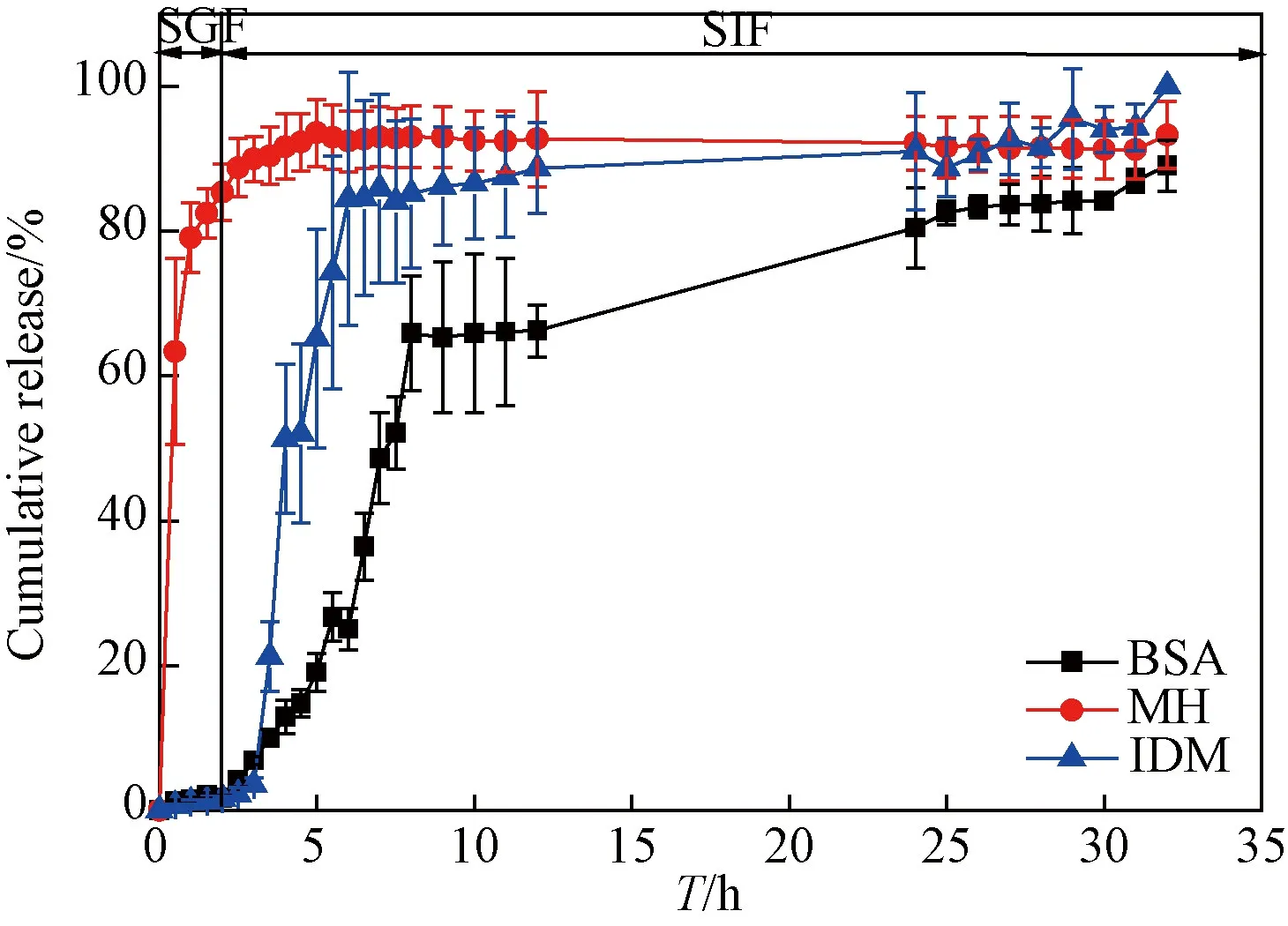
图13 复合水凝胶的释药曲线对比图Fig. 13 Comparison of the drug release curve of the composite hydrogels
3.3.2载不同药物复合水凝胶释药行为对比 图13为载三种不同药物的复合水凝胶的释药曲线。从图可见,BSA从凝胶孔隙中缓慢释放,此凝胶体系对BSA有明显的缓释作用,7 h左右释药率约为50%。MH从凝胶孔隙中释放较快,0.5 h左右释药率已超过50%,说明此凝胶体系对MH的缓释作用不太明显。IDM从凝胶孔隙中释放较缓慢,4 h左右释药率为50%,说明此凝胶体系对IDM有一定的缓释作用。研究结果表明,该复合水凝胶对大分子蛋白质类药物及小分子疏水性药物均有一定的缓释效果。
4 结 论
本实验通过物理交联,化学交联以及聚电解质复合凝聚法制备了具有 pH 敏感性的膜控型IPN结构复合水凝胶,并考察了该水凝胶在模拟胃肠道中的溶胀率与释药性能。所制得的水凝胶最大溶胀率可达33.59,且对大分子蛋白类药物显示出了较好的缓释作用。由于本复合凝胶系统具有IPN结构,同时外层具有聚电解质膜的修饰,因此该复合凝胶系统有助于克服了单一结构水凝胶在药物输送中的弊端,从而增强了水凝胶体系的稳定性及药物缓释性能。该复合凝胶制备方法简单温和,在作为大分子药物缓控释输送载体方面具有潜在的应用前景。

