2种杀虫剂对舞蹈蜜蜂大脑转录组中可变剪切的影响
张祖芸,李 震,吴志豪,黄 强,曾志将*
(1.江西农业大学 蜜蜂研究所,江西 南昌 330045;2.红河学院 生命科学与技术学院,云南 蒙自 661100)
【研究意义】蜜蜂是一种重要的经济性社会昆虫,为人类提供蜂蜜、蜂王浆、蜂花粉等蜂产品。而且也是一种重要的传粉昆虫,为许多虫媒植物授粉,对农业生态系统平衡与植物多样性具有重要贡献[1]。随着蜜蜂基因组测序工作的完成,蜜蜂基因功能、转基因技术和调控机制的研究将成为新的热点[1-2],人们进行有关农药诱导的蜜蜂基因功能和调控机制的研究意义深远。【前人研究进展】Aufauvre 等[3]发现蜜蜂体内编码羧酸酯酶、细胞色素P450 和谷胱甘肽转移酶的基因被认为主要负责杀虫剂代谢;通过转录组分析蜜蜂对微孢子和杀虫剂应答反应,免疫相关基因显著下调,并影响屏障防御和海藻糖代谢的显著改变。Wu等[4]在蜜蜂幼虫期暴露于亚致死剂量吡虫啉蔗糖溶液,羽化出房后蜜蜂进行转录组测序分析,得出免疫相关基因和王浆蛋白相关基因显著下调,而且解毒基因和感官相关基因特异表达;此外,多巴胺转运体编码基因和谷氨酸受体编码基因显著下调,而γ-氨基丁酸(γ-aminobutyric acid,GABA)神经递质编码基因显著上调,这些转运体和受体基因可能扰乱蜜蜂的神经系统,进而影响学习记忆能力,损害蜜蜂的大脑功能。李志国等[5]通过蜜蜂脑部转录组分析亚致死剂量吡虫啉对嗅觉学习记忆的影响,表明吡虫啉诱导的氧化应激可能导致蜜蜂大脑氧化还原失衡,参与光传导的基因显著下调,扰乱蜜蜂大脑钙离子平衡和长期记忆和嗅觉敏感性,同时参与免疫应答,解毒和化学感应的基因显著下调,进而降低蜜蜂的学习记忆能力。
【本研究切入点】可变剪切(alternative splicing,AS)是真核生物基因表达的一种常见现象,基因转录成前体mRNA(pre-mRNA)后,可通过不同的剪接方式产生不同的mRNA 剪接异构体,这些不同的mRNA 可能被翻译成不同的蛋白质。因此,一个基因可能编码多个蛋白质,可变剪切是调节基因表达和产生蛋白质多样性的重要机制[6]。此外,可变剪切可能是造成物种之间、器官之间、生理与病理之间差异的更重要因素,如表现在剪切调控的物种、组织和发育特异性方面[7-9]。目前许多研究表明西方蜜蜂体内存在大量可变剪切[10-11],而且可变剪切在海角蜂(A.mellifera capensis)的群居社会可塑性的控制上起重要作用[10]。石元元等[12]研究发现,蜂王浆对雌性蜜蜂发育与基因可变剪切密切相关,参与生长发育,物质代谢的基因都发生了可变剪切。蜜蜂的免疫系统包括细胞免疫和体液免疫。郭睿等[13]研究发现,许多AS 基因全方位参与宿主响应球囊菌胁迫的免疫应答。这些共有AS 基因富集在多个细胞免疫通路,如黑化作用,泛素介导的蛋白水解、内吞作用、溶酶体、吞噬作用和细胞凋亡等多个体液免疫通路和信号通路。【拟解决的关键问题】前人不仅做了大量有关杀虫剂对蜜蜂生长发育、繁殖力和生理免疫能力影响方面的研究,还做了杀虫剂对蜜蜂采集行为和学习行为的影响研究。本课题组前期已进行了杀虫剂对蜜蜂舞蹈行为及内在分子机理的研究,通过采食添加杀虫剂糖水后,舞蹈蜜蜂大脑转录组水平存在差异。本研究结合前期行为学试验和跳舞蜜蜂转录组测序数据,进一步对2 种杀虫剂诱导的舞蹈蜜蜂的可变剪切基因进行深入分析,旨在揭示可变剪切基因在蜜蜂应对杀虫剂过程中的作用,为可变剪切基因功能研究提供依据。
1 材料与方法
1.1 转录组数据来源
本研究前期先进行蜜蜂舞蹈行为学试验,分别用24µg/kg吡虫啉蔗糖溶液,235µg/kg溴氰菊酯蔗糖溶液和50%蔗糖溶液(对照组)各饲喂3 群采集蜂,并在距蜂箱不同距离(300,500,1 000 m)的3 个试验地点进行相关的行为学试验,然后将27个跳舞蜜蜂脑部样本(25个蜜蜂大脑)送检。通过本课题组获得的跳舞蜜蜂脑部转录组全部数据,本研究基于上述转录组数据对跳舞蜜蜂脑部的AS基因进行分析。
1.2 可变剪切分析
以每个进行差异可变剪切分析的比较组为单位,先统计发生的可变剪切事件的种类及数量,再分别计算每类可变剪切事件表达量,最后对每类可变剪切事件进行差异分析。使用跨越内含子的reads来鉴定2个外显子的边界,从而判定junction的位置,tophat比对结果中包含了所有剪切位点信息,rMATS软件可以将AS事件分成5类,并且可以对有生物学重复的样品进行差异AS分析。5类可变剪切事件分别是外显子跳跃(skipped exon,SE),可变5'端剪切(alternative 5' splice site,A5SS),可变3'端剪切(alternative 3' splice site,A3SS),外显子选择性跳跃(mutually exclusive exon,MXE)和内含子保留(retained intron,RI)。
1.3 共有与特有AS 基因的KEGG pathway富集分析
KEGG pathway 显著性富集分析以KEGG pathway 为单位,应用超几何检验,找出与整个基因组背景相比,在共有及特有AS基因中显著性富集的pathway。
2 结果与分析
2.1 吡虫啉诱导舞蹈蜜蜂脑部AS基因类型及数量
由表1 可知,吡虫啉处理组检测出5 种可变剪切:外显子跳跃(SE),可变5'端剪切(A5SS),可变3'端剪切(A3SS),外显子选择性跳跃(MXE),内含子保留(RI)等。SE是主要的可变剪切类型,检测到各组之间事件数目占总事件数达60%以上。而SE类型的差异事件数占差异AS事件总数的50%以上。在300,500,1 000 m 发生5 种可变剪接的事件总数之间存在显著差异(χ2=88.872,df=8,P<0.001),而发生5 种可变剪接的差异事件数目之间不存在显著差异(χ2=13.705,df=8,P=0.09)。
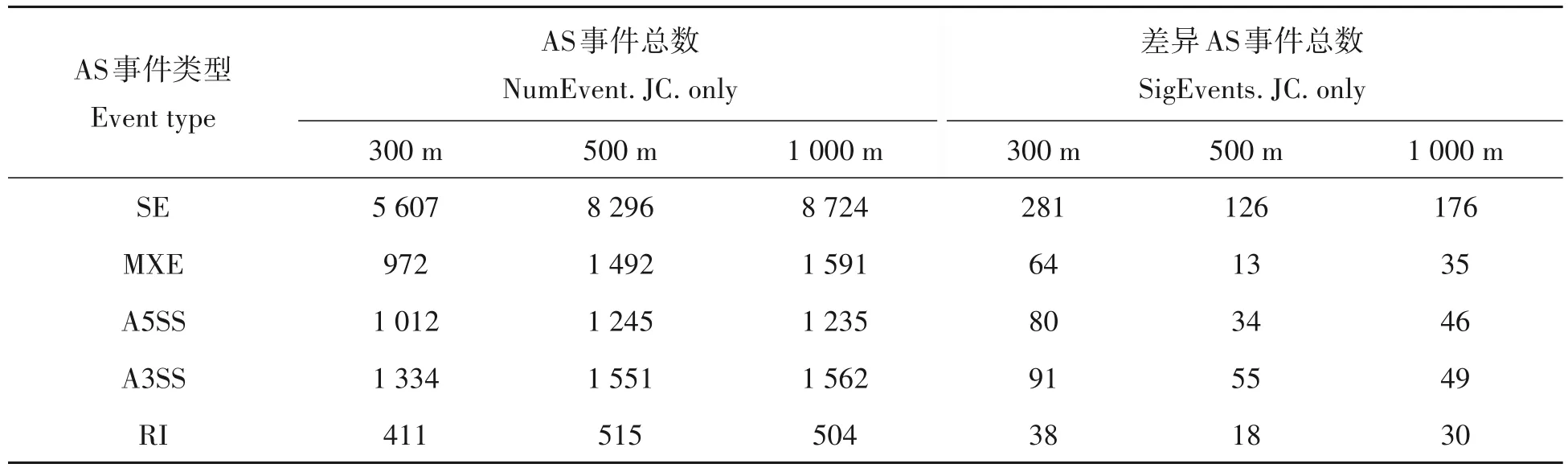
表1 吡虫啉处理组间差异AS分类和数量统计Tab.1 AS classification and quantity statistics between imidacloprid treatment group and control group
由图1 可知,各种类型可变剪切在3 个距离组间的基因数目,其中SE 类型的基因数依次分别为2 567,3 237 和3 395;A3SS 类型的基因数分别为935,1 047 和1 049;A5SS 类型的基因数分别为704,786和781;MXE 类型的基因数分别为332,518 和561;RI 类型的基因数分别为311,388 和380。在300,500,1 000 m发生5种可变剪接的基因数目之间存在显著差异(χ2=36.501,df=8,P<0.001)。

图1 吡虫啉处理组间可变剪切基因数Fig.1 Number of AS genes between imidacloprid treatment group and control group
2.2 吡虫啉诱导舞蹈蜜蜂脑部AS基因KEGG pathway富集分析
根据这些发生可变剪切的基因做了KEGG 富集分析,这些显著富集的通路可以影响机体的新陈代谢、细胞修复、氨基酸代谢和信号传导等生物学活动,与重要的信号通路(wnt signaling pathway,MAPK signaling pathway-fly,phototransduction-fly,hippo signaling pathway-fly,neuroactive ligand-receptor interac‑tion)和免疫应答通路(ubiquitin mediated proteolysis,endocytosis,lysosome)密切相关(表2)。
2.3 溴氰菊酯诱导舞蹈蜜蜂脑部AS基因类型及数量
由表3 可知,本试验中检测出5 种可变剪切:外显子跳跃(SE),可变5'端剪切(A5SS),可变3'端剪切(A3SS),外显子选择性跳跃(MXE),内含子保留(RI)等。SE是主要的可变剪切类型,检测到各组之间事件数目占总事件数达60%以上。而SE类型的差异事件数占差异AS事件总数的55%以上。在300,500,1 000 m发生5种可变剪接的事件总数之间存在显著差异(χ2=101.225,df=8,P<0.001),且发生5种可变剪接的差异事件数目之间存在显著差异(χ2=23.844,df=8,P=0.002)。由图2 可知,各种类型可变剪切在3 个距离组间的基因数目,其中SE 类型的基因数依次分别为2 590,3 221 和3 438;A3SS 类型的基因数分别为945,1 037 和1 053;A5SS 类型的基因数分别为711,788和791;MXE 类型的基因数分别为344,531 和558;RI 类型的基因数分别为316,380 和385。在300,500,1 000 m发生5种可变剪接的基因数目之间存在显著差异(χ2=34.724,df=8,P<0.001)。

表2 可变剪切基因主要显著富集通路分析(吡虫啉)Tab.2 Main Pathway Enrichment of AS Genes(Imidacloprid)
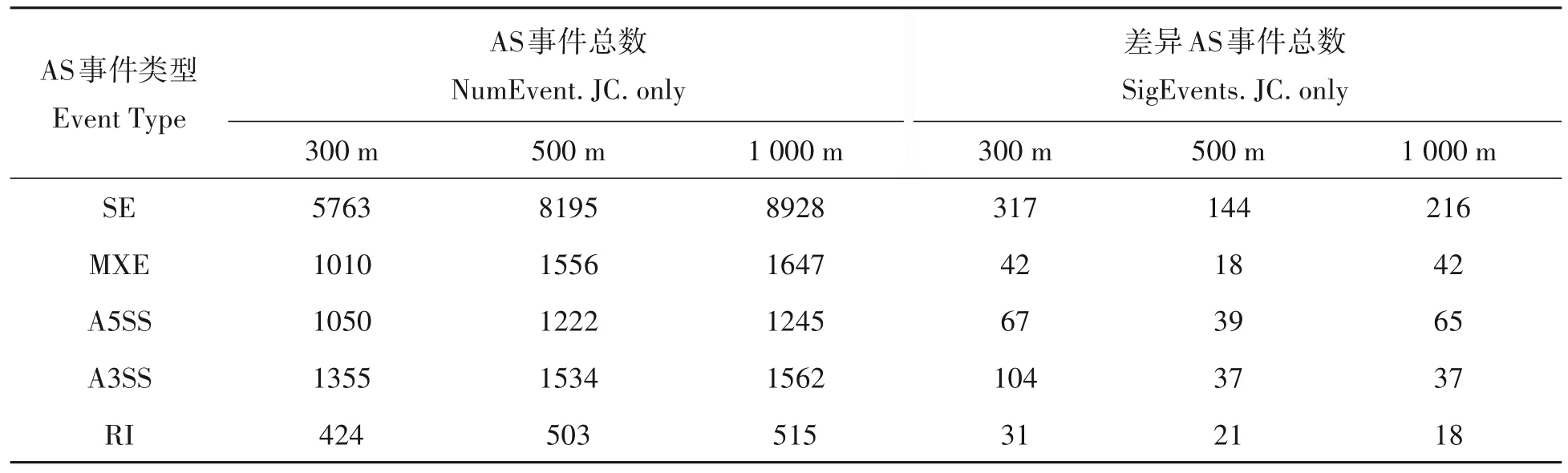
表3 溴氰菊酯处理组间差异AS分类和数量统计Tab.3 AS classification and quantity statistics between deltamethrin treatment group and control group
2.4 溴氰菊酯诱导舞蹈蜜蜂脑部AS基因KEGG pathway富集分析
根据这些发生可变剪切的基因做了KEGG 富集分析,这些显著富集的通路可以影响机体的新陈代谢、糖类代谢、脂肪酸代谢、氨基酸代谢和信号传导等生物学活动,与重要的信号通路(wnt sig‑naling pathway,TGF-beta signaling pathway,notch signaling pathway,MAPK signaling pathway-fly,pho‑totransduction-fly,mTOR signaling pathway,phos‑phatidylinositol signaling system,neuroactive ligandreceptor interaction)和免疫应答通路(regulation of autophagy,microbial metabolism in diverse environ‑ments,nicotinate and nicotinamide metabolism,caf‑feine metabolism)密切相关(表4)。
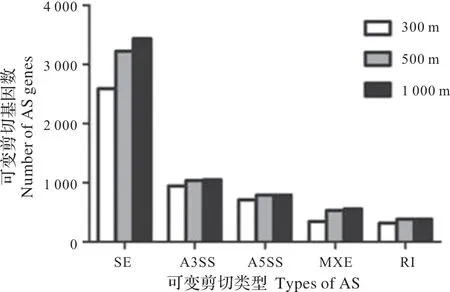
图2 溴氰菊酯处理组间可变剪切基因数Fig.2 Number of AS genes between deltamethrin treatment group and control group
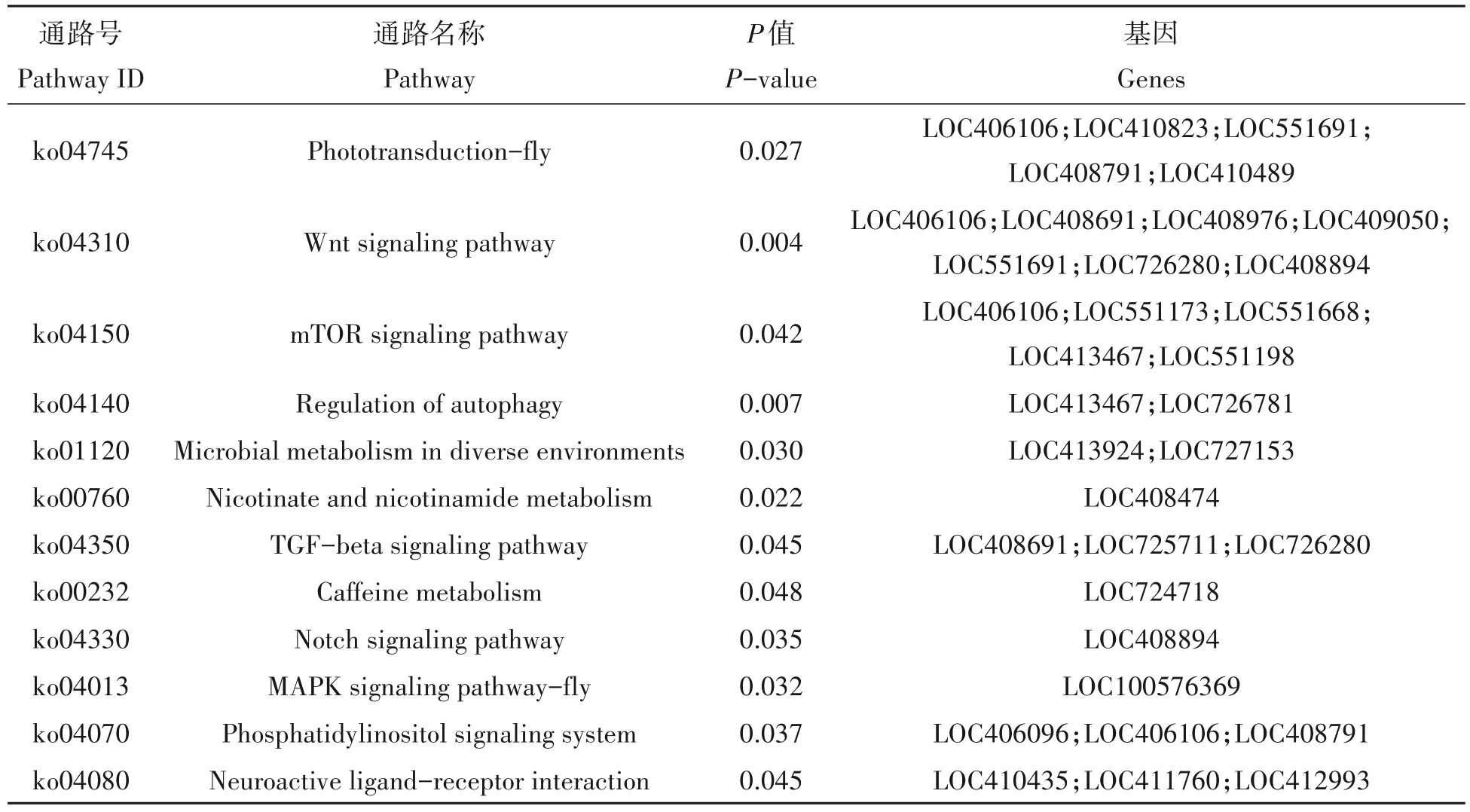
表4 可变剪切基因主要显著富集通路分析(溴氰菊酯)Tab.4 Main Pathway Enrichment of AS Gene(Deltamethrin)
3 讨论
本试验中,笔者通过饲喂2 种亚致死剂量的杀虫剂吡虫啉和溴氰菊酯,蜜蜂转录组测序发现5 种类型的可变剪切,发生可变剪切的事件和基因主要集中在SE。由于1 个基因可能通过不同类型可变剪切产生不同转录本[14],使1 个基因由于时间环境的不同翻译出不同的蛋白质。由于杀虫剂的刺激,蜜蜂基因组发生一定可变剪切,可能改变配体受体结合、转录因子、生理节律、内吞作用以及神经信号传导,会对细胞功能产生影响,包括免疫应答、学习记忆和飞行定位等。
在蜜蜂采食混有杀虫剂的糖水后,体内某些参与信号通路的基因发生了可变剪切,如参与MAPK signaling pathway-fly 的调节基因(LOC412003,LOC412529,LOC100576369),参与Wnt signaling pathway的调节基因(LOC406106,LOC411046,LOC551691,LOC726671,LOC408691,LOC408976)和参与Neuroac‑tive ligand-receptor interaction 的调节基因(LOC411050,LOC726953,LOC410435,LOC411760)。MAPK 信号通路是由小GTP 酶中的岬家族控制的信号级联放大反应[15],调节细胞生理活动。大量行为学试验证明MAPK信号通路能影响长期恐惧记忆[16-17]、空间记忆[18-19]和嗅觉气味记忆的激活[20]。参与Wnt signaling路径的基因与学习记忆有关[21]。而Neuroactive ligand-receptor interaction 通路是一批位于原生质膜上参与神经可塑性及学习记忆的受体[22]。说明2种杀虫剂都能够影响基因的可变剪切,从而影响蜜蜂的学习记忆能力,但其具体的功能还需要进行蛋白互作、RNA 干扰等试验进一步研究。另外,发生可变剪切基因还参与细胞间的信号传导、新陈代谢和正常的生理活动,但可变剪切基因对农药的免疫应答机制还尚不清楚,有待进一步的研究。

