北京地区慢性阻塞性肺疾病合并肺癌主要危险因素的病例对照研究
裴俊 刘彦玲 林俊岭
COPD(慢阻肺)是一种复杂的异质性疾病[1],Sandberg Jacob等[2]一项44年的随访研究发现,慢性阻塞性肺疾病在中老年人群中的发病率和死亡率仍不断增加。中国1990年至今,COPD的发病率有下降趋势,但由于老龄化社会的加剧,COPD患病率明显上升[3]。自2004年以来,肺癌发病率和死亡率已居恶性肿瘤的第一位,肺癌始终占据我国恶性肿瘤死亡的首要地位[4]。慢阻肺引起的氧化及炎症反应能够破坏基因平衡与稳定、使肿瘤细胞逃离免疫细胞的监视作用,最终促进肿瘤生长、迁移,引发肺癌[5-6]。流行病学研究显示,肺癌在慢阻肺人群的患病率是正常人群肺癌患病率的2~5倍,在一定程度上影响着肺癌的发生、发展,是肺癌的独立危险因素[7]。目前慢阻肺向肺癌转化的机制尚不明确,本研究旨在探索慢性阻塞性肺疾病合并发生肺癌的主要危险因素,为预防肺癌发生、提供筛查策略、改善患者预后提供科学的依据。
资料与方法
一、一般资料
采取病例对照研究方法,选取2013年8月至2018年8月于北京市普仁医院及北京朝阳医院呼吸科,肿瘤放化疗科收治的门诊及住院的70例COPD合并肺癌患者为病例组,在同期收治的性别、年龄相匹配的单纯COPD患者75例作为对照组。病例组肺癌的病理类型分别是肺腺癌26例,肺鳞癌33例,小细胞肺癌11例。经过均衡性检验,病例和对照组的年龄、性别无统计学差异(P<0.05)(见表1)。

表1 两组患者一般资料对比[n(%)]
二、病例纳入与排除标准
纳入标准:①病例组:COPD合并肺癌组70例,胸外科手术后患者经病理组织学检查证实肺癌,签署知情同意书自愿参加本项目研究并接受问卷调查和相关检查。依据肺功能检查,诊断为COPD,同时为原发性肺癌。肺癌TNM分期按国际肺癌研究协会2009年第七版分期标准对肺癌进行分类和分期。②对照组:单纯COPD组75例,在呼吸科收集同期单纯性COPD患者,签署知情同意书自愿参加本项目研究并接受问卷调查和相关检查。COPD诊断符合2011年全球GOLD指南,与病例组年龄相差不超过±3岁。
排除标准:①在北京地区居住10年以下者;②既往有其他系统肿瘤;③神经、精神系统疾病。
三、调查方法
本研究为横断面调查,采用问卷调查、医学体检及实验室检测相结合的方法进行。
调查问卷由经过培训的调查员对调查对象本人采用访谈的方式进行。肺功能检查、肺部影像学检查及实验室检测(包括病理检查、肿瘤标志物情况等)由主治医师及以上职称医生执行。
四、各因素定义和赋值方法
根据文献检索,找出可能影响COPD患者发生肺癌的相关因素,对各因素进行整理,获得33个变量并进行等级化赋值(见表2)。
五、统计学分析
使用SPSS 22.0统计软件,各因素分别采用logistic单因素回归分析,对具有统计相关性的因素进行多因素logistic 回归分析。之后将多因素模型中有显著差异变量分别组合,采用二项分类logistic回归分析。以P<0.05判断有统计学意义,OR>1.0 判断为是肺癌发生的危险因素,OR<1.0判断为是肺癌发生的保护(预防)因素。

表2 Logistic回归模型中可能影响COPD患者发生肺癌的危险因素赋值表
结 果
一、单因素分析
本研究以是否患有肺癌为因变量,将各因素作为自变量引入,进行单因素非条件Logistic回归分析,发现婚姻状况、居住地、居住环境、吸烟、吸烟指数、环境污染、伴发糖尿病、放射检查、体质指数、COPD病程、COPD分级、肿瘤家族史、使用糖皮质激素治疗及咯血、声音嘶哑、咳嗽咳痰伴随症状、实验室检查血沉加快等与COPD合并肺癌的发生均有统计学意义(P<0.05)。其他因素如文化程度、职业类型等未发现统计学意义(P>0.05)(见表3)。

表3 各影响因素的单因素Logistic回归分析结果
二、多因素分析
应用多因素非条件 logistic回归模型,将(表3)中有统计学差异的单因素纳入进行分析,发现居室通风不良、吸烟指数较高、COPD分级、具有肿瘤家族史与肺癌发生显著相关,COPD患者发生肺癌的风险增加(OR>1,P<0.05);远离油烟和被动吸烟环境,营养良好,使用糖皮质激素雾化治疗的COPD患者肺癌发生风险较低(OR<1,P<0.05);而婚姻状况、居住地、糖尿病、放射检查、COPD病程、COPD相关症状、血沉等因素均被剔除(P>0.05)(见表4)。
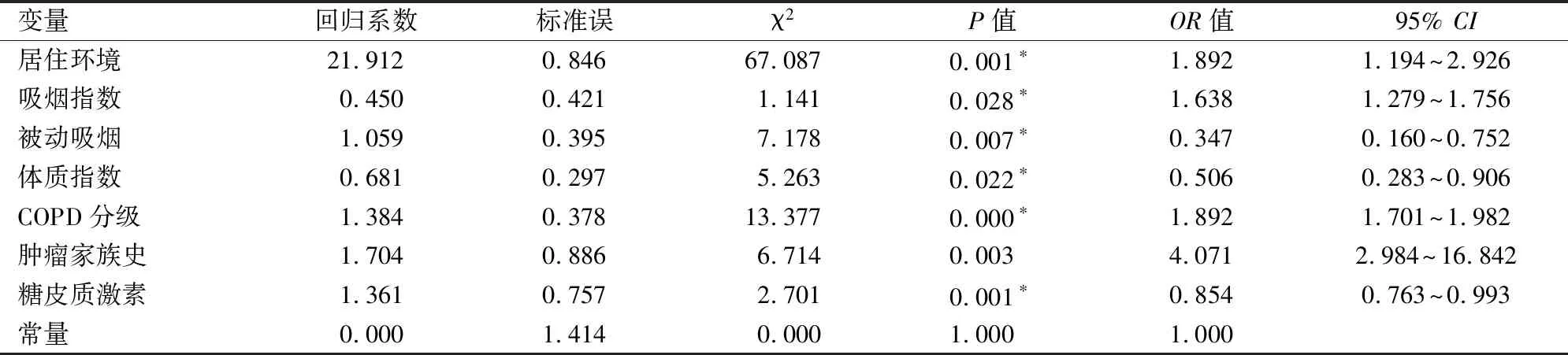
表4 主要危险因素的logistic多因素回归分析结果
讨 论
慢阻肺向肺癌的转化机制尚未十分明确,但大量研究表明慢阻肺及肺癌疾病进展中存在着一些共同的炎症机制。例如,COPD急性发作期肺内的巨噬细胞、受损伤的支气管上皮,甚至瘤细胞可引起氧化反应,或激活核因子-KB(nuclearfactor kb,NF-KB)产生强烈的免疫和炎症反应,二者相互作用,破坏基因组的稳定性、使肿瘤逃逸免疫监视,出现肿瘤促生成、细胞凋亡受抑制[8-9]。本研究显示,居室通风不良,吸烟指数较高,身体消瘦、具有肿瘤家族史和Ⅱ级COPD是COPD患者发生肺癌的主要危险因素。
一、环境污染
烟草是以往研究常见的暴露因素,烟草燃烧烟雾、油烟等刺激呼吸道时,活化的Th2细胞促进肿瘤细胞的生成,帮助肿瘤细胞免疫逃逸,使肿瘤生成和抑制失衡。此外,也可因呼吸道纤毛粘液清除系统受损,减弱对致癌物质的清除功能。烟草雾气中含有的致癌物质或细菌病毒的感染,导致了支气管黏膜上皮增殖转化,失去正常结构和功能,诱发癌变。
本研究显示,居室环境通风不良、接触油烟、处于被动吸烟环境或吸烟,均是COPD合并肺癌发生的危险因素。Duarte-de-Araújo A等[1]的研究发现,吸烟者的COPD发生率呈明显上升趋势;在中国,82%的COPD死亡和75%的肺癌死亡将归因于吸烟和固体燃料使用的综合影响,减少吸烟和固体燃料的使用可以大大降低COPD预测和肺癌负担[10];Lin Hsien-Ho等[11]研究同样显示,患有结核病,主动或被动吸烟,职业暴露于金属毒物,房屋通风不良,燃烧生物燃料,肺癌的发生风险较高。本研究显示,体质指数较低[小于18.5(kg/m2)]长期处于油烟污染环境的COPD 患者,发生肺癌的风险更高。因此,建议COPD患者改善居住环境,避免有害空气接触,可降低肺癌的发生风险。而对于吸烟,本研究二项分类回归显示,若每日吸烟超过10支且居住环境通风不好的COPD患者,肺癌发生风险进一步升高。目前研究表明,戒烟是减缓 COPD 患者肺功能下降的有效的干预方法[7]。因此建议并鼓励COPD患者尽早戒烟,以降低发生肺癌的风险。
二、COPD分级及伴随症状
伴随着肺功能的下降,特别是COPDⅡ级出现,肺癌的发病风险较显著,这可能与COPD 患者肺泡黏膜的清除致癌物质的能力下降有关,因而使肿瘤的发生率升高。但肺癌早期缺乏典型临床表现,多数是健康体检或疾病筛查过程中发现,而多数COPD晚期病人多以治疗呼吸衰竭为主,忽略了对肺癌的筛查,可能是本研究未发现COPD晚期引起肺癌发病风险增高的原因之一。本研究显示,早期COPD患者是肺癌发生的危险因素,说明早期的COPD就存在致癌可能,早期肺功能改变即为肺癌发生的独立危险因素。对早期肺癌进行诊断及治疗,这对于肺癌的预后意义重大。影像学研究显示,轻度或中度气流受限的吸烟者更容易罹患肺癌[12-13],与本研究结果相一致。因此对于频繁出现咳嗽、咳痰,咯血或痰中带血或消瘦等异常症状时应高度警惕肺癌的发生,应注意行胸部CT检查有利于发现早期肺癌。另外,本研究及国内多有报道消瘦发生肺癌的风险较高,而Husebo Gunnar R等[7]通过对COPD合并肺癌的危险因素队列研究,发现COPD患者体质指数过高是COPD患者发生肺癌的独立危险因素。因此,体制指数对COPD人群肺癌发生的作用及影响,还有待于进一步探究。
三、糖皮质激素
糖皮质激素对慢性炎症和急性炎症均有强大的抗炎效应[14-15]能够激活一系列的抗炎蛋白相关基因的转录,在发挥抗炎作用的同时,还对吸烟者的原癌基因、肺癌细胞的生长、肿瘤的形成等均存在抑制作用。在抗肿瘤治疗的同时规范按时吸入糖皮质激素,还可以改善患者的生活质量及预后[9]。而柯华等[16]通过行Meta分析发现,随机对照研究中糖皮质激素暴露与COPD患者肺癌发生和死亡风险没有关系;观察性研究中糖皮质激素暴露可降低COPD患者肺癌的发生风险,高剂量的糖皮质激素趋势更加明显。综上所述,糖皮质激素在肺癌预防方面可能具有较好前景,适量的糖皮质激素吸入是否可成为COPD患者预防肺癌发生的有效手段之一,其理论机制有待进一步研究。
四、肿瘤家族史
遗传在COPD和肺癌两种疾病中起着重要作用。肺癌患者的父母及子女比非肺癌患者的亲属有高于2.5倍的可能性患肺癌[8]。其机制,可能是由于肺癌或COPD染色体基因位点的多态性,造成α1抗胰蛋白酶和中性粒细胞弹性蛋白酶之间的平衡紊乱,进而增加肺癌发生的风险[10]。多项流行病学已证明,肿瘤家族史增加肺癌的发病风险,但对于具体肿瘤家族病史的肿瘤类别未作详细统计,有待进一步研究。
总之,慢性阻塞性肺疾病与肺癌的发病之间存在诸多危险因素,本研究显示肺癌的发生是多种因素共同作用的结果,居室通风不良、吸烟指数较高、身体消瘦、Ⅱ级COPD、具有肿瘤家族史,是COPD患者发生肺癌的主要危险因素,提示临床需警惕该类患者发生肺癌的可能性,同时建议COPD患者注意营养支持、戒烟或远离油烟、被动吸烟等环境污染,降低肺癌的发生风险。

