投喂野生鲫和人工配合饲料对哲罗鲑消化生理的影响
王亚玲,王常安,刘红柏,包玉龙,徐奇友,尹家胜
(1.中国水产科学研究院 黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学 水产与生命学院,上海 201306)
【研究意义】哲罗鲑(Hucho taimen)系鲑形目Salmoniformes、鲑科Salmonidae、哲罗鲑属Huchosp.,是我国名贵的土著鱼类,属于大型的冷水性鱼类,生长速度快,一般个体在3 kg 以上,属于大型的经济鱼类,肉味鲜美、细嫩,极富营养,是高寒地区的特产,具有很高的营养和经济价值[1-2]。但由于近几十年来自然环境恶化、捕捞强度增大,使哲罗鱼资源遭到了严重的破坏[3]。天然饵料存在质量不稳定、货源不充足、季节影响大,以及因生物性饵料携带病源导致疾病暴发、养殖水体环境污染、死亡率高等一系列问题。为进一步满足其规模化生产的需求,急需研发其高效专用的配合饲料[4]。鱼类消化酶的分泌量和活性不仅与食性、种类等因素相关,还与长期摄食的饵料成分相适应[5-6]。【前人研究进展】目前有研究学者认为,仔鱼不能利用配合饲料使其自身消化酶活性过低,活饵料体内的某些消化酶能弥补这种不足[7-8]。但也有研究学者认为,来自活饵料的蛋白酶对仔鱼消化的直接贡献不显著[9]。最近几年来,不同饵料对仔鱼消化酶活性的影响已有较多研究,对中华倒刺鲃(Spinibarbus sinensis)的研究发现,活饵组的胰蛋白酶明显高于饲料组;淀粉酶活力具有稳定上升的变化趋势;脂肪酶活力在试验期间交替上升[10]。在翘嘴鳜(Siniperca chuatsi)的研究中也有相似的发现,肝脏脂肪酶、肠道消化酶的活性在冰鲜组、活饵组和饲料组没有显著差异,而冰鲜组的肝脏淀粉酶、肠道脂肪酶显著高于其他两组[11]。不同饵料对稀有鮈鲫(Gobiocypris rarus)仔稚鱼的研究发现,活饵组的消化道各部肌层厚度、黏液细胞数目均较高,该组的消化道发育状况较好,具有较好的消化吸收能力,转食组的胰蛋白酶活性高于活饵组和饲料组[12]。在大口黑鲈(Micropterus salmoides)的研究发现,温度、pH、底物浓度对2种饲料投喂的大口黑鲈消化酶活性的影响为饲料组的比肠质量显著高于冰鲜组,在相同温度和底物浓度下,摄食人工配合饲料的大口黑鲈消化器官的消化酶活性显著高于摄食冰鲜杂鱼[13]。
【本研究切入点】2011年,王常安等[14]已研究了不同饲料对哲罗鲑生长性能和营养成分的影响;2015年,吴金明等[15]也研究了不同开口饵料对川陕哲罗鲑(Hucho bleekeri)仔鱼生长和存活的影响。关于哲罗鲑的生物学特性[16]、营养物质如蛋白质[17]、氨基酸[18]等需要量的研究较多,但对摄食天然饵料和人工饲料对哲罗鲑消化生理等方面的研究较少。现已有不同饲料对哲罗鲑生长性能和营养成分的研究基础,也有不同饲料对其他幼鱼生长、消化道及消化酶活性影响的研究。【拟解决的关键问题】在已有的研究基础上探讨人工配合饲料与天然饵料对哲罗鲑胃、肠道和肝消化酶活性的变化情况以对肠道绒毛高度、纹状缘高度和组织消化形态的影响,进行分析对比,以期为其人工饲料的优化配制提供理论依据。
1 材料与方法
1.1 试验材料
基础饲料配方及营养组成如表1[7]所示,原料粉碎后过60目筛(制粒直径为1.5 mm),放置-20 ℃冰箱中保存备用。试验鱼购自中国水产科学研究院黑龙江水产研究所渤海冷水鱼试验站,挑选健康的哲罗鲑(体质量(32.84±3.34)g)放置室内循环流水系统中,野生鲫鱼捕于牡丹江,其水分含量为80.31%,粗脂肪为1.52%,粗蛋白为15.33%,粗灰分为1.62%。

表1 基础饲料配方及营养水平(风干基础)Tab.1 Formula and nutritional level of the experiment feed(air-dry basis)
1.2 试验设计与饲养管理
试验分2个处理组,G1组投喂野生鲫鱼,G2组投喂人工配合饲料,每组3个重复,每个重复50尾鱼。试验选择流水养殖系统,养殖试验开始前彻底清理并消毒水族箱,将试验鱼放置室内水族箱(0.90 m×0.50 m×0.45 m)中进行。开始试验前,试验鱼饥饿24 h,用100 mg/L MS-222的溶液快速麻醉,称质量并测体长。
试验用水为涌泉水,水温9.8~16.2 ℃,溶氧>6.0 mg/L,氨氮<1.0 mg/L,pH 值为7.2~7.6,自然光照,日投喂2 次。G1 组投喂野生鲫鱼,按其4 倍折算,G2 组投喂人工配合饲料,配合饲料按试验鱼的体质量前4 周投喂率为3.4%,后4 周为2.0%,连续投喂56 d。养殖试验结束后,计算缸内鱼的数量并称每缸的总质量,同时,称每尾的质量和测体长。
1.3 样品采集
每个试验组随机取10 尾鱼用于消化酶的分析。放置冰盘上迅速解剖取出胃、内脏和肠道,分离出肝脏,去除肠道内含物和脂肪,并用-4 ℃的预冷生理盐水冲洗干净,滤纸吸干后称量。将所有样品放置-80 ℃冰箱中备用。
1.4 消化酶活性和组织切片观察
消化酶的测定:取待测的肠道样品在4 ℃下解冻,称量后按质量体积比1∶9加入0.86%的预冷生理盐水,采用FJ-200CL高速分散组织匀浆机匀浆(10 000 r/min),匀浆10 min,匀浆液4 000 r/min离心10 min,取上清液放入1.5 mL离心管中备用,用于检测消化酶。胰蛋白酶采用紫外比色法测定,脂肪酶采用比色法测定,淀粉酶采用淀粉-比色法测定[19]。
肠道组织切片的制备:每个试验组随机取10 尾鱼,将解剖取出的前肠、中肠、幽门盲囊组织,放置Bouin氏液中固定48 h,选择常规石蜡包埋,用乙醇脱色、苏木精-伊红染色法(H.E.)染色、之后用KD1508型切片机选择厚度为6µm 的切片进行横方向连续切片,最后用中性树脂封片。在LeicaMD 4000B 的显微镜下观察采集照片,使用Motic Images Plus 2.0 软件测量皱襞高度、绒毛宽度和基层厚度,每个切片测量10个以上。
1.5 统计分析
试验结果采用统计软件SPSS for Windows 23.0 进行独立样本T检验比较数据之间的显著差异性,所有试验数据用平均值±标准差(-X±SD)表示,显著性水平P<0.05。
2 结果与分析
2.1 不同饲料对哲罗鲑蛋白酶活性的影响
如表2 所示,野生鲫鱼组的胃、前肠+幽门盲囊、后肠的蛋白酶活性均显著高于人工配合饲料组(P<0.05),但两试验组肝的蛋白酶活性差异不显著(P>0.05)。

表2 不同饲料对哲罗鲑蛋白酶活性的影响Tab.2 Effects of different feed on protease activities of Hucho taimen n=10;Xˉ±SD
2.2 不同饲料对哲罗鲑脂肪酶活性的影响
如表3所示,可以看出G1和G2组在前肠+幽门盲囊和后肠的脂肪酶活性存在显著差异(P<0.05);胃和肝的脂肪酶活性差异不显著(P>0.05)。

表3 不同饲料对哲罗鲑脂肪酶活性的影响Tab.3 Effects of different feed on lipase activities of Hucho taimen n=10;Xˉ±SD
2.3 不同饲料对哲罗鲑淀粉酶活性的影响
如表4所示,野生鲫鱼组的胃、前肠+幽门盲囊、后肠和肝的淀粉酶活性均低于人工配合饲料组,G1和G2组的后肠、肝淀粉酶活性存在显著差异(P<0.05),胃、前肠+幽门盲囊中G1和G2组差异不显著(P>0.05)。

表4 不同饲料对哲罗鲑淀粉酶活性的影响Tab.4 Effects of different feed on amylase activities of Hucho taimen n=10;Xˉ±SD
2.4 不同饲料对哲罗鲑消化组织形态的影响
如表5所示,试验结果表明肠道绒毛高度和纹状缘的高度G2组均比G1组的低,纹状缘高度G1组和G2组存在显著差异(P<0.05)。

表5 不同饲料对哲罗鲑肠道形态的影响Tab.5 Effects of different feed on intestinal morphology of Hucho taimen n=10;Xˉ±SD µm
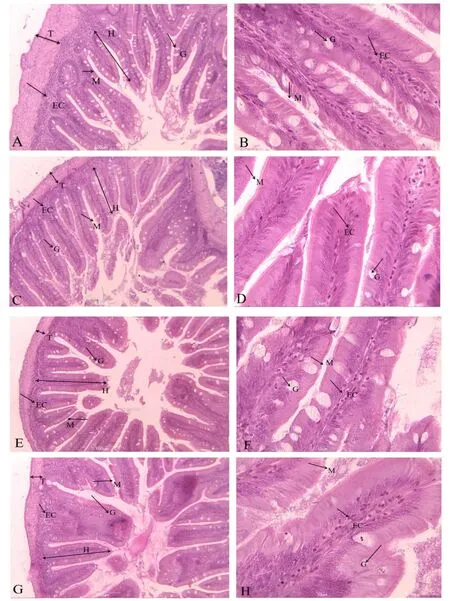
图1 哲罗鲑前肠、肠和后肠组织切片Fig.1 Foregut,midgut and hindgut histological section of Hucho taimen
从哲罗鲑前肠、后肠的组织切片可以看出,G1 组(图1A,B,E,F)细胞的粘膜上皮细胞排列较整齐,肠绒毛发达,上皮细胞结构完整,杯状细胞紧密排列,数量较多,与G1组相比,G2组(图1C,D,G,H)的肠道组织结构完整性被破坏,上皮细胞与固有层部分出现分离现象,粘膜褶皱边缘有破损,部分纹状缘融合、脱落,肠道绒毛附近出现肿大,杯状细胞较少。
3 讨论
3.1 不同饲料对哲罗鲑消化酶活性的影响
前期研究表明,饲喂野生鲫鱼组的哲罗鲑生长性能显著高于饲喂饲料组[14]。本试验中,与野生鲫鱼组相比,人工配合饲料组的胃、前肠+幽门盲囊和后肠的蛋白酶活性显著降低;野生鲫鱼和人工配合饲料组的前肠+幽门盲囊和后肠的脂肪酶活性差异显著,胃和肝的脂肪酶差异不显著;而淀粉酶的活性与蛋白酶的正好相反,人工配合饲料组的淀粉酶活性显著高于野生鲫鱼组,这可能与所含有的淀粉诱导有关,人工配合饲料组虽然含有的营养成分全面,但蛋白质来源主要为鱼粉、豆粕和大豆分离蛋白,可以看出鱼类利用动物性的蛋白质效率明显高于植物性,同时人工配合饲料组含有的淀粉含量较高,推测可能是引起蛋白酶活性降低,淀粉酶活性升高的原因。用不同的饵料投喂莫桑比克罗非鱼(Anguilla mossam⁃bica)研究发现,淀粉含量与淀粉酶活力呈正相关关系,说明饲料中的淀粉会诱导消化系统中淀粉酶的活性,鱼类对饲料的适应性[20]。杨代勤等[21]对黄鳝的研究发现,投喂配合饲料组中的淀粉酶活性显著高于投喂鲢(Hypophthalmichthys molitrix)肉和蚯蚓组。这与本试验结果相似,所以饵料成分的含量不同,刺激消化道分泌相应量的酶来消化食物,也可能与哲罗鲑养殖驯化处于起步阶段,对野生鲫的适口性较好有关。鳡(Elopichthys bambusa)幼鱼投喂鲜活饵料和配合饲料后研究发现,投喂鲜活饵料组的蛋白酶、淀粉酶的总量比摄食人工配合饲料的要高,且蛋白酶活性的增加与投喂的频率有关[22]。大口鲈(Stribass drumbass)的研究发现,鱼类蛋白酶活性的大小与摄取的食物性质和数量有关[23]。对鲤(Cyprinus carpio)、大西洋鲱(Clupea harengus)的研究表明,鱼类摄取食物的性质和数量影响蛋白酶的分泌和活性的大小,大口黑鲈的蛋白酶在消化系统的分布和活力受饵料影响更明显[24-25]。李芹等[26]对瓦氏黄颡鱼(Pelteo⁃bagrus vachelli)稚鱼的研究发现,饲料组和驯化组的脂肪酶活性普遍高于活饵料组,脂肪酶活性与饲料中的脂肪含量呈正相关关系。对金头鲷(Sparus aureta)投喂4 种不同的饲料研究发现,饲料中的脂肪含量高时,会增加脂肪酶的活性而降低淀粉酶的活性,当饲料中脂肪含量低而碳水化合物的含量高时,脂肪酶的活性降低,而淀粉酶的活性增加[27]。宋聃等[28]对杂交鲟仔幼鱼的研究发现,饥饿和不同饵料对杂交鲟脂肪酶的活性各处理组变化规律各不相同。因此,不同饵料对鱼类脂肪酶活性的影响较为复杂,具体原因有待进一步研究。
3.2 不同饲料对哲罗鲑消化系统组织形态的影响
鱼类营养物质的消化和吸收能力与肠道组织中纹状缘的发达程度、杯状细胞的数量、粘膜皱襞的疏密以及上皮细胞的高低密切相关[29]。本试验研究显示,人工配合饲料组的绒毛高度和纹状缘高度都低于野生鲫鱼组。与野生鲫鱼组相比,人工配合饲料组影响哲罗鲑的消化组织形态,使肠道结构的完整性被破坏,粘膜褶皱边缘有破损,部分纹状缘融合、脱落。哲罗鲑属于冷水性肉食鱼类,与野生鲫鱼组相比,人工配合饲料组含有的某些原料在肉食性鱼类的肠道中难以被充分消化吸收,还可能会对鱼类的肠道组织形态和功能产生影响。综上可以推断,可能饲料组肠道发生了病变导致饲料组肠道形态发生改变和消化能力减弱。与野生鲫鱼组相比,饲料组含有较高的植物性成分,纤维含量大,已有大量研究表明,增加日粮中纤维的含量,会影响肠道的发育,改变肠道的形态结构,导致肠道肥大[30-31];饲料组的豆粕和大豆分离蛋白含量也相比野生鲫鱼组高,当饲料中大豆分离蛋白含量较高时,会影响肠道组织形态,如日本鲈鱼(Lateo⁃labrax japonicus)的饲料中大豆分离蛋白含量较高时,前肠和中肠的绒毛高度缩短,绒毛和肌肉厚度明显减少[32],这与虹鳟[33]、石斑鱼(Epinephelus coiodes)[34]的研究发现相似。在大西洋鲑(Salmo salar)[35]、鲤(Cypri⁃nus carpio)[36]、大菱鲆(Scophthalmus maximus)[37]的饲料中添加大豆产品时,同样会引起肠道组织形态改变,发生不同程度的损伤,粘膜组织发生炎症现象,这可能与大豆蛋白的抗原因子有关,抑制肠道细胞的生长发育,影响肠道的组织形态,使肠道组织受损,发生粘膜炎症反应。然而,对牙鲆(Paralichthys olivaceus)[38]的研究发现,饲料中用豆粕替代鱼粉时,未见牙鲆肠道组织形态发生变化。可见,饲料种类不同,原料组成不同,对肠道组织形态结构也会因鱼的种类不同而反应不同,具体原因有待进一步研究。

