低品位粗铜中铜量测定方法的探究
李文英,刘芳美*,巫贞祥,张月琳,赖秋祥,赖晓芳
(紫金铜业有限公司,铜绿色生产及伴生资源综合利用福建省重点实验室,福建 上杭 364204)
1 引言
铜作为与人类密不可分的有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域[1]。随着社会不断进步与发展,矿产资源日渐枯竭,铜矿品位下降,因此充分利用冶炼过程中的二次资源有利于可持续发展,对社会经济效益和环境效益协调发展有重要意义。
我国铜冶炼主要采用火法从铜矿中提炼,炼铜转炉吹炼后铸造成型的铜则是,其中含铜约70%~99.5%,主要杂质元素为铁、硫、锑、铋等元素[2,3]。目前铜的检测方法主要有电解法、原子吸收光谱法、比色法、可见分光光度法[4]等。电解法虽然准确度高、干扰少,但分析过程繁琐,不能满足实际生产的快速分析要求。原子吸收、分光光度和比色法适用于低含量铜的分析检测,且干扰大、分析误差大[5]。现行行业标准YS/T521.1-2009《粗铜化学分析方法铜量的测定碘量法》[6]采用碘量法测定粗铜中铜含量,但只适用于检测铜含量为97.50%~99.70%的粗铜,不适用于低品位粗铜中铜含量的检测。因此,亟需建立低品位粗铜中铜量的测定方法。
碘量法具有准确度高、操作简单、流程短、干扰因素易控制等优势[5],被广泛应用于铜的测定。故本文采用碘量法,针对低品位粗铜杂质含量高的特性,对行业标准方法YS/T521.1-2009进行了改进,使之适用于低品位粗铜中铜的测定。
试验采用硝酸-盐酸-溴分解样品,用饱和溴水氧化三价砷和锑,硝酸-盐酸溶解试样中铁等杂质,建立了碘量法测定低品位粗铜中铜的方法。方法简单、准确度高、精密度好,可用于低品位粗铜中铜的测定。
2 实验过程
2.1 试剂
盐酸(分析纯);硝酸(分析纯);溴(分析纯);氨水(分析纯);冰乙酸(分析纯);氟化氢铵(分析纯);碘化钾(分析纯);硫代硫酸钠(分析纯);淀粉(分析纯);硫氰酸钾(分析纯)。
硫代硫酸钠标准滴定溶液c(Na2S2O3)≈0.1mol/L:
配制:称取250g硫代硫酸钠(Na2S2O3·5H2O)置于1000mL烧杯中溶解,加2g无水碳酸钠,移入10L棕色试剂瓶中,用煮沸并冷却的蒸馏水稀释至约10L,充分摇动。于暗处放置10天后备用。
标定:称取3.00g(精确至0.0001g)处理过的纯铜片(质量分数≥99.95%)三份。以下按1.3与试料同时测定。取三次标定的平均值。
按下式计算硫代硫酸钠标准溶液的浓度:
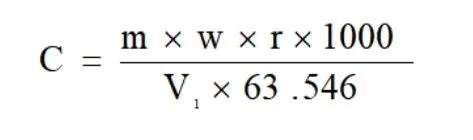
式中:c:硫代硫酸钠标准滴定溶液的实际,mol/L;w:纯铜片中铜的质量分数,%;r:纯铜液分取比;V1:标定时滴定纯铜液消耗硫代硫酸钠标准滴定溶液的体积,mL;m:纯铜片的质量,g;
2.2 试样
分析样品加工破碎至全量通过2mm标准筛,再用0.45mm标准筛筛分成筛上、筛下,并分别称重。低品位粗铜的主要成本见表1。
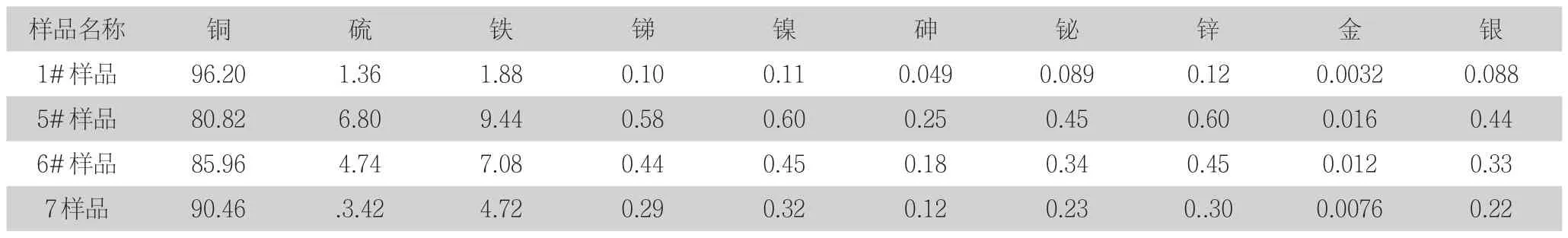
表1 粗铜样品成分含量(%)
2.3 分析步骤
按筛分后的质量比合称取3g(精确至0.0001g)试样于500mL三角烧杯中,加入50mL 1+2硝酸,盖上表面皿,待剧烈反应停止后,置于电热板上低温加热使其溶解。然后用水洗涤表面皿及杯壁,加入10mL盐酸,0.5mL溴,继续低温加热至溶解完全,取下,冷却至室温。将溶液移至500mL容量瓶,以水稀释至刻度,混匀。再移取50.00mL试液于500mL三角烧杯中,加入2mL溴饱和溶液,置于电热板上低温溶解至体积约3mL~5mL。取下,稍冷,用水吹洗杯壁至溶液体积约为40mL。摇匀,冷却至室温。然后用氨水调节pH至氢氧化铜沉淀出现,加入3mL冰乙酸,然后滴加氟化氢铵饱和溶液至红棕色消失并过量1mL,摇匀。沿杯壁吹少量水。加入5mL 500g/L的碘化钾溶液,摇匀,迅速用硫代硫酸钠标准溶液滴定至浅黄色,加入5mL 5g/L的淀粉溶液,1mL 40g/L乙酸铅溶液,继续滴定至溶液呈淡蓝色,再加5mL 400g/L的硫氰酸钾溶液,激烈振摇至蓝色加深,再滴定至蓝色恰好消失为终点。
2.4 分析结果的计算
按下式计算铜的百分含量:

式中:c(Na2S2O3):硫代硫酸钠标准溶液的物质的量浓度,mol/L;V(Na2S2O3):滴定消耗硫代硫酸钠标准溶液的体积,mL;V0:空白所消耗的体积,mL;M(Cu):铜的摩尔质量,g/mol,数值为63.546;m:试样量,g。
3 结果与讨论
3.1 条件优化实验
3.1.1 溶样方法的选择
本实验采用以下两种方法对部分代表试样进行溶样方法选择试验。方法一:按标准方法《YS/T 521.1-2009粗铜化学分析方法第1部分铜量的测定碘量法》,试样用硝酸溶解,三价砷和锑用溴氧化,控制溶液的pH为3-4,用饱和的氟化氢铵掩蔽铁,加入碘化钾与铜(Ⅱ)作用,析出碘以淀粉为指示剂,用Na2S2O3标准溶液滴定。方法二:按1.3分析步骤进行试验。
根据2种方法对试样进行溶样方法选择实验,结果见表2。

表2 溶样方法的选择(n=3)
经过两种方法的比对,方法一铜测定结果明显偏低,样品溶液中还有少量黑色固体物质,可能的原因是硝酸无法将样品完全溶解,导致分析结果偏低。采用本方法铜结果明显高于方法一,本方法可以完全将试样溶解。
3.1.2 盐酸用量的选择
按试验方法对1#-7#进行试验,改变盐酸用量,其他条件不变,探索盐酸用量对铜测定的影响,其结果见表3。

表3 盐酸用量的选择(n=3)
低品位粗铜中的铁等杂质含量高,硝酸无法完全将样品溶解,加入一定量的盐酸可以使样品溶解完全。从表3中可以看出,加入盐酸后,检测结果明显高于未加盐酸样品结果,但是随着盐酸加入量增大,检测结果趋于稳定。因此,考虑检测成本,盐酸加入量为10mL适宜。
3.1.3 溴用量的选择
按试验方法,对1#粗铜进行试验,改变溴的使用量,其他条件不变,探索溴的用量对结果的影响,其分析检测结果见表4。

表4 溴素用量的选择(n=3)
从表4分析结果中可知,当不加溴时,样品溶液表面漂浮一层黑色物质,样品中的硫元素无法用硝酸、盐酸溶解,硫会包裹部分铜使分析结果明显偏低;当溴加入量大于等于0.5mL时,样品中的硫杂质溶解完全。加入过多的溴会造成药品试剂的浪费,综合成本、职业健康考虑,溴素加入量为0.5mL适宜。
3.1.4 分样液蒸发至1mL与5mL左右结果比对
称取3g(精确至0.0001g)试样,按照试验方法进行测定,改变分样液剩余体积,其他条件不变,测定结果见表5.
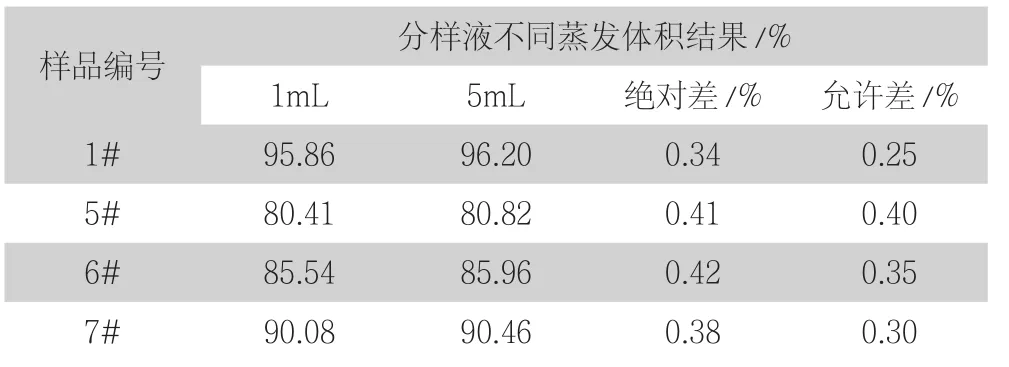
表5 分样液蒸发至不同体积结果比对(n=3)
结果表明:当分样液蒸发至约1mL时,烧杯底部易出现局部蒸干现象,且测定结果会明显偏低,样品平行度较差。而当分样液蒸发至约5mL时,结果稳定可靠。因此分样液蒸发剩余体积不应太小,若烧杯底部出现局部蒸干需重新取分样液分析。
3.1.5 加与不加乙酸铅溶液的比对
由于低品位粗铜中杂质元素铅含量较低、其他杂质元素高会干扰终点颜色,使其呈粉紫色,不易判别。因此,以1#粗铜进行试验,按试验方法,在滴定过程,加入5mL 5g/L的淀粉溶液后,再加入1mL 40g/L乙酸铅溶液,而后继续按照试验方法滴定,其结果见表6。
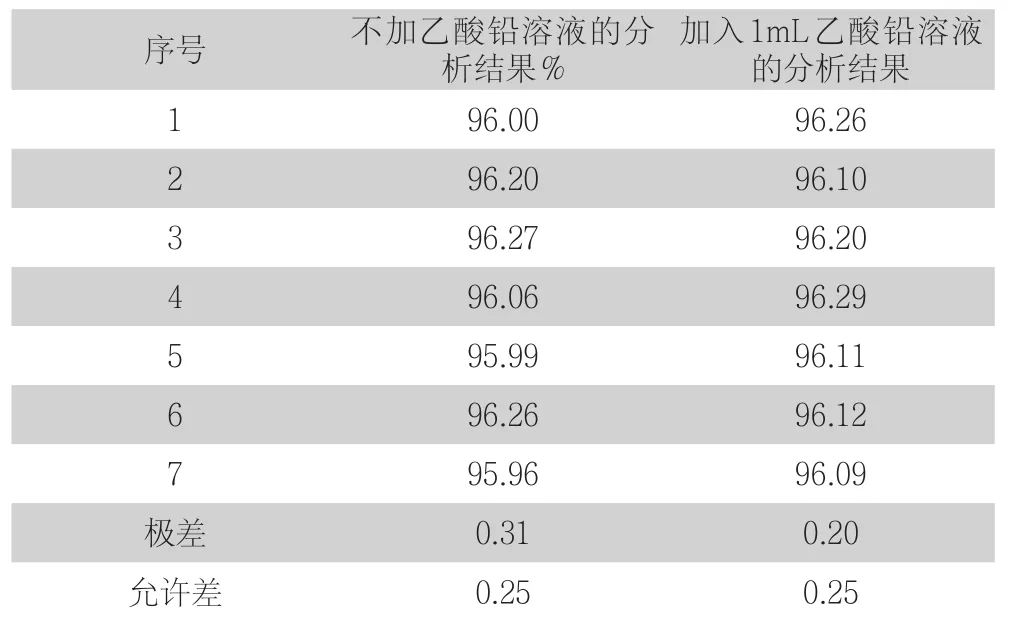
表6 加入乙酸铅溶液结果比对
从表中可以看出,在滴定过程不加乙酸铅溶液的试样检测结果平行度差,精密度低。加入乙酸铅溶液的粗铜试样滴定终点突变明显且易于判断,检测结果平行度好,精密度高。故,在滴定过程加入一定量的乙酸铅溶液。
3.2 精密度实验
为了确定该试验方法是否准确可靠,在最优条件下由同一人员对同一试样在相同的条件下平行测定7次,结果满意,分析结果如下表所示。
由表7中的分析结果中可以看到,测定结果令人满意,相对标准偏差小于5%,由此可说明该实验方法稳定可靠,分析结果稳定。

表7 不同样品精密度实验分析结果
3.3 模拟实验
为进一步验证该方法准确度,利用纯铜加基体配置不同含量的模拟试样进行回收实验,结果如表8。
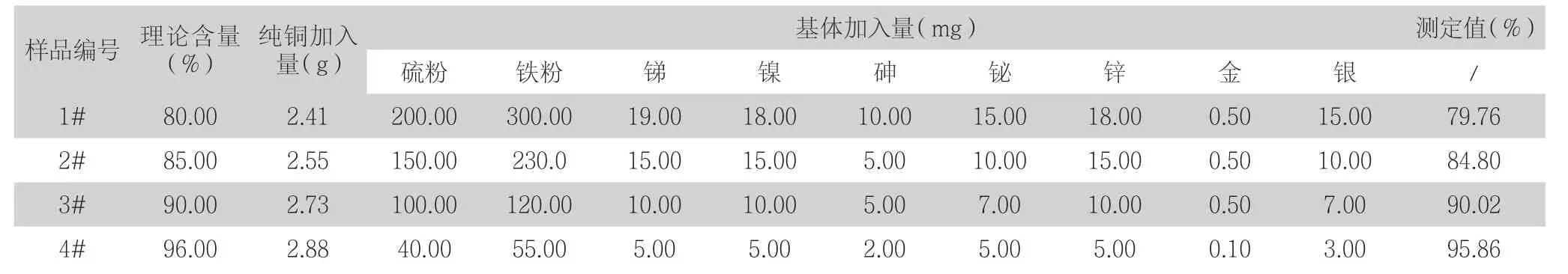
表8 加标回收实验
由表8数据可见,模拟试样测定值与理论值一致,由此可知本方法可用于低品位粗铜中铜的测定。
3.4 对照试验
在本试验中,通过实验室间比对方式,验证本实验方法是否合理。在该对照试验中对不同含量粗铜泥进行了大量的比对,部分分析结果如表9所示。

表9 外部比对结果
从表中可以看出,采用本试验的检测与外检比对结果基本一致,差值远远小于允差,结果满意,由此可以说明本实验方法是准确可靠的,可用于日常实际检测中。
4 结论
本文用硝酸-盐酸-溴分解样品,用饱和溴水氧化三价砷和锑,硝酸-盐酸溶解试样中铁等杂质,采用碘量法可准确测定低品位粗铜中铜含量。方法简单,精密度好,准确度高,具有良好的方法先进性,完全满足生产及贸易的检测需求。

