基于传统分离培养和宏基因组测序分析不同产地小龙虾菌群的多样性
汤 纯,刘 芳,诸永志,吴海虹,孙芝兰
(江苏省农业科学院农产品加工研究所 南京210014)
克氏原螯虾俗称小龙虾(Procambarus clarkii),原产于北美洲地区[1],上世纪20年代由日本传入我国,现广泛分布于我国长江中、下游地区,已成为重要经济虾类。本世纪初,小龙虾产业迅猛发展,2017年全国小龙虾养殖总产量达112.97 万t[2],然而,相关食品卫生问题频频发生。2010年,南京部分地区医院急诊科陆续接诊了多个因食用小龙虾患横纹肌溶解症的病人[3];江西瑞昌、湖北十堰等地先后出现副溶血性弧菌(V.parahemolyticus)集体性食物中毒事件[4-5]。小龙虾营养丰富且主要生活在水体环境中,因此,生鲜小龙虾自身携带多种微生物,极不耐运输储藏[6-8]。张生元等[9]和朱若林等[10]从安徽肥东某养殖场的濒死虾中分离到布氏柠檬酸杆菌。李兵兵等[11]在淮安地区发现当地鲜活小龙虾携带副溶血性弧菌、金黄色葡萄球菌、沙门氏菌等致病菌。
传统培养基分离鉴定法是利用各类具有选择性的固体培养基对样品处理液中的细菌进行计数、分离,而后提取、扩增DNA,通过NCBI Blast分析DNA 序列,确定菌株类别[12]。此方法在实施过程中人为主观意识较强,仅凭视觉挑选单菌落,容易遗漏腐败菌。此外,传统平板培养基不能毫无遗漏地培养出样品携带的全部细菌,自然环境中可通过此方法培养得到的细菌仅占1%[13-14]。宏基因组测序法可以弥补这一不足,它能对数10 万条DNA 同时测序,针对性地分析样品所携带菌群的基因组[15]。邓晓影等[16]和江艳华等[17]分别利用宏基因组测序法全面分析南美白对虾、虾夷扇贝柱的菌群多样性。江杨阳等[18]采用上述2 种方法探寻小龙虾低温保藏时的腐败菌,得出宏基因组测序法结果的菌群多样性更高。
小龙虾好温喜湿,不同产地的地理条件、养殖环境与饲料不尽相同,因此在研究其所携带菌群时,需结合多个因素综合考虑[19]。本研究采用传统培养以及宏基因组测序法,选择浦口和太湖东山产区的小龙虾,分析鲜活小龙虾整体、表面及尾肉部位的菌群组成,归纳其携带的污染菌,为小龙虾的保鲜、运输研究提供参考。
1 材料与方法
1.1 材料与试剂
小龙虾来源于浦口、太湖东山,冷鲜包装后由顺丰快递寄至实验室备用。
PCA 菌落计数培养基、BHI 脑心浸液肉汤、结晶紫中性红胆盐葡萄糖琼脂(VRBGA)、甘露醇氯化钠琼脂(MSA)、乳酸菌琼脂基础培养基(MRS)、月桂基硫酸盐胰蛋白胨肉汤(LST)、营养肉汤(NB)、脑心浸出液肉汤(BHI),北京奥博星生物技术有限公司;假单胞菌琼脂基础培养基(CN 琼脂),山东青岛海博生物技术有限公司。
1.2 仪器与设备
M124A 电子分析天平,意大利BEL 公司;SW-CJ-1FD 型无菌操作台,苏州净化设备有限公司;SPX-250B-Z 型生化培养箱,上海博讯实业有限公司医疗设备厂;Centrifuge 5810 R 离心机、Centrifuge 5424 R 离心机,德国Eppendorf 公司;Unicen MR 台式冷冻离心机,德国Hero lab 公司;Direct-Q3 纯水/超纯水一体化系统,默克化工技术(上海)有限公司。
1.3 样品处理
对两产地小龙虾分别进行3 种处理:①称取50 g 鲜活小龙虾,均质后随机取10 g 加入90 mL生理盐水得到小龙虾整体样品;②随机挑选10 只大小均等的小龙虾,加入225 mL 生理盐水得到小龙虾表面样品;③无菌条件下取出虾尾肉,取10 g剪碎后加入90 mL 生理盐水得到小龙虾尾肉(带肠)样品。每组样品设置3 个平行,分别均质30 min。
1.4 菌落计数与优势腐败菌保种
采用GB 4789.2-2016[20]的方法测定小龙虾样品中的菌落总数。利用平板涂布法将1.3 节中的样品稀释液涂布于VRBGA、CN 琼脂、MSA、PCA和MRS 固体平板,30 ℃培养24 h 后计数。选取5类培养基平板上不同形态的菌落,分离、纯化后接种到5 mL 相应液体培养基中,37 ℃摇床培养。菌液混浊(此时OD600nm=1)时,按V菌液∶V50%无菌甘油=3∶2混合,放入-80 ℃冰箱保存。
1.5 样品总DNA 提取
将1.3 节中的样品均质液在4 ℃,2 000 r/min条件下离心10 min,取上清。在4 ℃,12 000 r/min条件下离心10 min,弃上清,收集沉淀。质检DNA,将合格样品置于-80 ℃保存。
1.6 MiSep 测序和数据分析
将在-80 ℃冰箱中冻存的DNA 样品置于干冰中,送至奥维森有限公司测序,使用 Illumina Miseq PE300 高通量测序平台。在细菌16S rDNA V3-V4 区进行菌群检测,利用引物338F(5′-ACTCCTA CGGGAGGCAGCAG-3′)及806R(5′-GGACTACNNGGGTATCTAAT-3′)对样品进行扩增[21]。Paired-end 测序仍采用该平台,完成后用QIIME(v 1.8.0)软件处理数据,对双端序列数据进行过滤,调整序列方向,归纳有效序列[22]。利用barcodes 将各样品的序列归类为操作分类单元(Operational Taxonomic Units,OTU),相似性为97%[23]。将每个OTU 比对Silva 数据库,获得相应物种信息。Alpha 多样性分析选用Mothur 软件(version 1.31.2)[24]。汇总比较两产地生鲜小龙虾携带的微生物群落,统计微生物群落结构。
1.7 数据分析
方差分析使用SPSS 16.0 软件,获得显著性分析。所有试验重复3 次。
2 试验结果
2.1 两地区小龙虾初始菌落数分析
图1 为3 个产地小龙虾初始菌落数。由图1a可知,浦口小龙虾整体样品和太湖东山小龙虾整体样品的菌落总数相近,分别为7.78 lg(CFU/g)和7.76 lg(CFU/g)。浦口、太湖东山地区的小龙虾表面所含菌落数为6.49,7.37 lg(CFU/g)(图1b)。从图1c 可知,浦口小龙虾尾肉的菌落数为7.26 lg(CFU/g),太湖东山地区所产小龙虾尾肉菌落数为7.46 lg(CFU/g)。两地小龙虾各部位初始菌落数的差异可能与产地的地理条件和养殖环境有关[25]。
2.2 优势腐败菌的分离与鉴定
对特征菌落进行平板划线,分离得115 株菌。采用琼脂糖凝胶电泳检测16S rRNA 扩增产物。成功扩增的样品在1 500 bp 处出现明显特异性条带,分析条带对应的菌株序列,进行NCBI Blast分析,取同源性大于98%的序列信息,确定种属[26]。表1 和表2 为浦口、太湖东山小龙虾各样品携带的115 株特征菌的鉴定结果,大多菌株属于肠杆菌科,有35 株属于柠檬酸杆菌属。柠檬酸杆菌广泛存在于自然环境中,目前已有相关报道其易感染水产动物[27]。Jaaskelainen 等[28]发现三文鱼中的主要腐败菌为发光杆菌属(Photobacterium beijerinck),金枪鱼中的主要腐败菌为假单胞菌属(Pseudomonas)。Zhang 等[29]研究得知鲜草鱼片中优势腐败菌为不动杆菌属(Acinetobacter)及假单胞菌属。这些差异可能和物种及产地环境有关。

图1 两地小龙虾不同部位的菌数差异Fig.1 The difference of bacterial counts in different parts of crayfish from two aquaculture farms

表1 浦口地区小龙虾不同部位腐败菌组成Table 1 Composition of spoilage bacteria in different parts of Pukou crayfish

表2 太湖东山地区小龙虾不同部位腐败菌组成Table 1 Composition of spoilage bacteria in different parts of Dongshan crayfish
2.3 测序数据统计和OTU 分析
用FLASH 软件及Trimmomatic 优化Illumina Miseq 宏基因组测序法获取两产地小龙虾不同部位样品菌群的序列信息,18 个小龙虾样品共得到1 480 950 条有效序列,序列长度多在200~260 bp之间(图2a)。由图2b 可看出,随着样品量的增加,当序列量在20 000 条以上时,曲线逐渐平坦,说明测序数据量充足,具有合理性,足够体现研究对象的菌群多样性信息。
2.4 Alpha 多样性指数分析
Alpha 多样性指数(包括Chao1、PD_whole_tree、observed_species 及Shannon 指数)分析可以反馈小龙虾各部位微生物群落的丰度和均匀度。Chao1 及observed_species 指数能体现菌群丰度(Species richness)。Shannon 指数可体现符合本研究主题的菌群多样性(Species diversity),PD_whole_tree 指数可以体现小龙虾各部位所含微生物对进化历史的留存差别[30],如图3所示。由于Shannon 指数受菌群丰度和均匀度的影响,能真实反映样品中菌群的多样性,因此主要采用Shannon 指数分析菌群多样性。从图中可发现,太湖东山小龙虾整体和表面Shannon 指数的色块位置较高,而尾肉的色块位置较低。浦口产地小龙虾表面Shannon 指数的色块位置比整体、尾肉高。表明太湖东山的小龙虾微生物多样性高于浦口小龙虾。除此之外,2 个产地小龙虾尾肉(带虾线)的菌群多样性指数均偏低,可能与小龙虾自身的构造有关。

图2 序列分布(a)和样品稀释曲线图(b)Fig.2 Sequence distribution and sample dilution curve

图3 Alpha 多样性指数的箱图Fig.3 The box plots of Alpha diversity indexes
2.5 物种组成和聚类分析
获取各OTU 对应物种分类信息后,在科、属水平上标注不同样品的微生物菌属信息。
2.5.1 基于科水平的分析 由图4 可知,两产地小龙虾的初始菌相主要由肠杆菌科、莫拉氏菌科、Family_XII、黄杆菌科和气单胞菌科5 大菌群组成,每个菌群的相对丰度不低于20%。两产地小龙虾各样品菌相虽有共性,但差异也十分明显。肠杆菌科作为优势菌群存在于两产地小龙虾整体,而Family_XII、黄杆菌科分别是浦口、太湖东山小龙虾整体的优势菌群。莫拉氏菌科是两地小龙虾表面样品中共同的优势菌群,与整体样品一致。Family_XII、黄杆菌科也分别是浦口、太湖东山小龙虾表面的优势菌群。肠杆菌科和气单胞菌科是两地小龙虾尾肉的主要携带菌群,而太湖东山小龙虾尾肉中气单胞菌科的相对丰度比浦口小龙虾尾肉样品高。除此之外,所有样品中均存在一些丰度高于5%的菌科,如希瓦氏菌属希瓦氏菌科、拟杆菌科、支原体科、动性球菌科和假单胞菌科。

图4 基于科水平的菌种组成分析柱状图Fig.4 Column chart of bacterial composition analysis based on family level
2.5.2 基于属水平的分析 从图5 可以发现,各样品微生物多样性丰富,丰度较高的有黄杆菌属、气单胞菌属、假单胞菌属、不动杆菌属、耶尔森氏鼠疫杆菌属、嗜冷杆菌属、希瓦氏菌属、拟杆菌属、稳杆菌属等,两产地样品菌相类似,而菌群丰度差异大,其中浦口小龙虾整体携带菌为微小杆菌属微小杆菌属、金黄杆菌属、不动杆菌属和黄杆菌属。太湖东山小龙虾整体携带菌主要有黄杆菌属、气单胞菌属、希瓦氏菌属和不动杆菌属。浦口小龙虾表面携有不动杆菌属、微小杆菌属、金黄杆菌属和嗜冷杆菌属。太湖东山表面携带黄杆菌属、气单胞菌属、不动杆菌属和假单胞菌属。浦口小龙虾尾肉主要携带菌为希瓦氏菌属、拟杆菌属、耶尔森氏鼠疫杆菌属和气单胞菌属。太湖东山小龙虾尾肉含有的微生物有希瓦氏菌属、气单胞菌属、耶尔森氏鼠疫杆菌属及拟杆菌属。两产地小尾肉部位都检出耶尔森氏鼠疫杆菌属,且相对丰度较高。耶尔森氏菌分布较广,容易导致感染对象罹患急性肠胃炎,1 岁以下的婴幼儿较易感染[31-32]。Keisam 等[33]在印度东北部的鱼、猪肉和豆豉等发酵食品中检测出耶尔森氏鼠疫杆菌属。
2.6 样品菌群多样性变化的热图分析
热图可以通过色彩的渐变差异反映表格中最原始的数据信息或二维矩阵,聚合18 个样品的多样性数据,颜色深浅简洁地展示数据梯度,结果见图6。图中的不同样品根据污染菌丰度的差异进行了聚类,两产地小龙虾样品携带的菌群:不动杆菌属、金黄杆菌属和气单胞菌属等在样品中的比例大致相同。浦口样品中嗜冷杆菌属、微小杆菌属和耶尔森氏鼠疫杆菌属的丰度较太湖东山地区样品高,而太湖东山样品中希瓦氏菌属和假单胞菌属的相对丰度比浦口地区样品高。

图5 基于属水平的菌种组成分析柱状图Fig.5 Column chart of bacterial composition analysis based on genus level

图6 OTU 及属水平热图Fig.6 OUT and heatmap map of genus level
2.7 两地小龙虾菌群主成分分析
由图7 可知,第1 主成分(横轴PC1)与第2主成分(横轴PC2)的贡献率分别为43.15%和35.6%。图中各部位代表点的距离越近,该部位菌群组成相似度越高。两产地小龙虾尾肉样品与小龙虾整体、表面这2 个部位的距离远。两产地小龙虾的表面与整体部位距离近,说明养殖环境(主要是水体环境)对小龙虾整体携带的菌群多样性影响程度高。
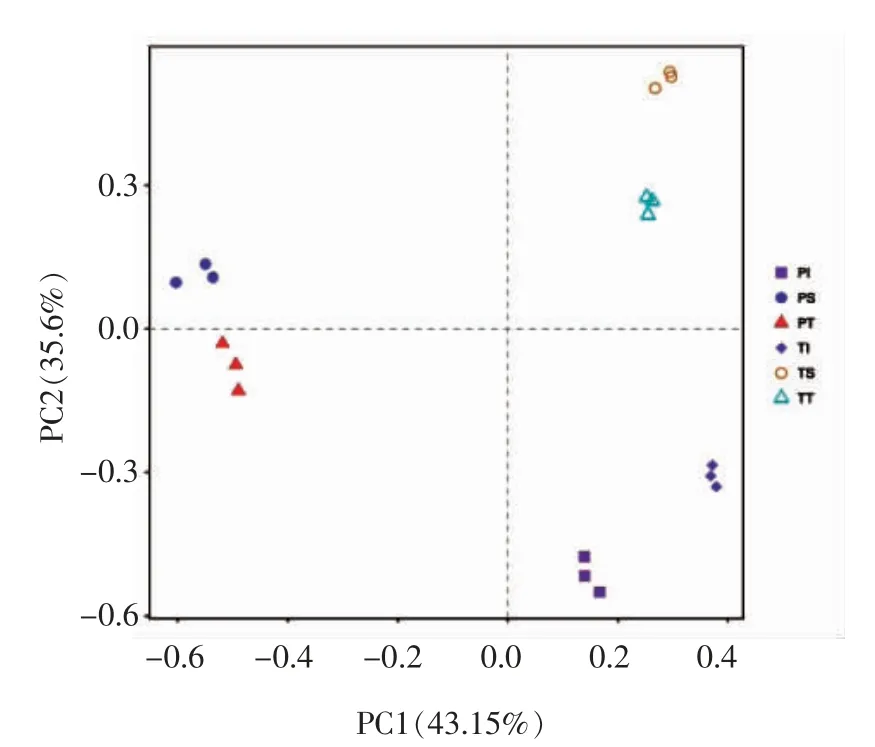
图7 不同小龙虾样品细菌菌群的主成分分析Fig.7 Principal component analysis of bacterial flora of different crayfish samples
3 结论
以不同产地的小龙虾为研究对象,运用Illumina Miseq 宏基因组测序法探究生鲜小龙虾3 个部位样品的菌相构成。采用传统培养法分离所得污染菌为气单胞菌属、柠檬酸杆菌属、蜂房哈夫尼菌和克雷伯氏菌属。宏基因组测序显示,两产地小龙虾所携带菌群组成存在差异:浦口新鲜小龙虾样品中的微生物主要有不动杆菌属、气单胞菌属、微小杆菌属、假单胞菌属和耶尔森氏鼠疫杆菌,太湖东山小龙虾样品中微生物菌属组成相对丰富,主要有气单胞菌属、假单胞菌属、耶尔森氏鼠疫杆菌、希瓦氏菌属及黄杆菌属,说明两产地新鲜小龙虾携带污染菌的菌相构成不同。此外,小龙虾整体与表面的菌群多样性高于尾肉,说明较多接触外部环境的小龙虾表面所含菌群较为丰富。本研究为今后小龙虾食品安全质量检测及其保鲜、运输技术的靶向研究提供理论依据。

