不同原料的米酒多酚及其抗氧化性能比较
蔡海莺,盛宇华,沈灵智,李嘉嘉,李 静,林萌慧,陈 曲,蔡成岗,冯凤琴
(1 浙江省农业生物资源生化制造协同创新中心 浙江省农产品化学与生物加工技术重点实验室浙江科技学院生物与化学工程学院 杭州310023 2 浙江大学生物系统工程与食品科学学院 杭州310058)
甜米酒历史悠久,是我国饮食文化的重要组成部分。中国甜米酒主要以糯米为发酵原料,在自然条件下通过霉菌、细菌和酵母混合发酵酿制而成。甜米酒具有柔和绵长的香气和口感,营养价值较高。除糯米自身营养成分经发酵后易于被人体消化吸收外,还包含酿制过程中产生的功能性多肽、氨基酸、多糖、低聚糖、维生素等。多酚化合物是植物性食物的天然成分,与食物的感官特性有关,如风味和颜色。近年来,膳食多酚因其清除自由基,调节消化酶和螯合金属等生物活性而受到越来越多的关注[1-2]。研究表明,食用多酚类化合物可能有助于预防各种疾病,包括眼科、心血管和消化系统故障、糖尿病、动脉粥样硬化、衰老,甚至过敏、肿瘤发生和病毒感染等[3-4]。植物性食品中多酚的作用机理可能随着多酚组分的变化而变化,其中抗氧化活性是研究最多的重要功能之一。
发酵能在一定程度上改善甜米酒的营养,同时还有利于提高其多酚组分的释放和生物利用度。混合微生物种群(包括酵母菌、霉菌和细菌)发酵产生的酶、酒精和其它分子,通过多种途径促进多酚化合物的释放,同时还能改善甜米酒风味物质形成和消化性能[5]。Xu 等[6]通过传统的蒸汽法进行糯米糊化酿制,获得的米酒多酚含量达到479.67 mg/L(没食子酸当量)。此外,酒中的多酚化合物在体内具有较高的生物利用度[7-8],这是因为酒类发酵过程产生大量水解酶,将植物原料中的多酚化合物从其糖苷或其它结合物中释放出来,从而有效提高游离多酚含量和其抗氧化活性。
前期的研究表明,不同酒曲发酵剂对甜米酒最终的品质和风味等方面产生了重要影响[9]。然而,不同原料对米酒发酵的酚类及其抗氧化活性的影响鲜见研究报道。本文采用6 种大米原料,通过传统固态发酵工艺酿制甜米酒,对米酒终产物的总多酚含量、主要酚类成分及其抗氧化活性进行研究和相关性分析,旨在为米酒的生物酿制,营养和功能性优化等提供一定的理论和应用依据。
1 材料与方法
1.1 材料与试剂
原料:黄米、红米、长糯米、紫米、黑米和圆糯米以及酒曲(AQ4)均购于杭州本地超市。
抗坏血酸、2,2-嗪-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、1,1-二苯基-2-苦基肼(DPPH)和乙二胺四乙酸(EDTA)均为分析纯试剂,Sigma Aldrich(中国上海)。福林酚试剂、生物试剂,上海国药化学试剂有限公司。异阿魏酸、没食子酸、对羟基苯甲酸、3,4-二羟基苯甲酸、绿原酸、儿茶素、香草酸、咖啡酸、丁香酸、对香豆素酸、芥子酸、阿魏酸均为色谱纯试剂,阿拉丁工业公司。
用甲醇制备1 mg/mL 标准酚类溶液,在-80℃下储存。在样品缓冲液(1.25%冰醋酸,7%甲醇双蒸馏水)中稀释后立即使用工作标准溶液。
1.2 仪器与设备
紫外-可见分光光度计(SP-756),上海光谱仪器有限公司;水浴氮吹仪(JC-S24),青岛聚创环保集团有限公司;高效液相色谱仪(Waters E2695),美国Waters 公司;台式高速离心机(H1850),湖南湘仪实验室仪器开发有限公司;恒温培养箱(ZWPA1230)、恒温培养振荡器(ZHWY-2102C),上海智城分析仪器制造有限公司;恒温水浴锅(HH-8),常州澳华仪器有限公司。
1.3 甜米酒酿制过程
甜米酒的酿制方法参考文献[9],发酵过程分5 步:浸泡大米、蒸米、冷却、添加发酵剂并搅拌均匀后发酵。将100 g 糯米浸泡在150 mL 水中,在25 ℃下浸泡1 h,然后蒸米20 min,使糯米淀粉糊化。将蒸好的大米冷却至30 ℃,放入500 mL 烧杯中。将发酵剂加入每个样品中,在30 ℃下静态发酵120 h。从发酵混合物中收集所有样品酒液,然后在室温下以6 000 r/min 速度离心10 min。上清液用于测定多酚含量、主要酚类成分和抗氧化活性。
1.4 甜米酒的理化性质鉴定
以没食子酸为参比化合物,采用Folin-Ciocalteu 法[10]对总多酚进行评价。根据没食子酸当量的标准曲线,甜米酒总酚含量以mg/L 没食子酸当量计。取0.1 mL 样品于10 mL 离心管中,补去离子水至0.5 mL,加入2.5 mL 10%福林酚试剂,常温避光反应3 min,然后加入2 mL 7.5% Na2CO3,放入摇床震荡,25 ℃反应1 h(转速120 r/min),最后于波长765 nm 处测定吸光值。将测得的数据代入没食子酸标准曲线方程,计算待测样品中总酚含量。
1.5 甜米酒的抗氧化活性测定
采用ABTS 自由基清除能力测定米酒样品的自由基清除能力,试验方法参考文献[11]。具体步骤是:将米酒中的0.5 mL 甲醇提取物添加到新制备的4 mL ABTS 溶液中。将溶液混合并在25 ℃黑暗中培养30 min。在734 nm 处测量培养液的吸光度。使用0.5 mL 等份甲醇溶剂作为空白对照,米酒的自由基清除活性表示为mg/L 维生素C(VC)当量。用铁还原抗氧化能力(FRAP)测定法[12]评价米酒溶液的还原力。具体步骤是:将米酒0.5 mL 甲醇提取物添加到新制备的5 mL FRAP 试剂中,在波长595 nm 处测量吸光度。米酒的还原能力表示为mg/L Fe2+当量。以上所用溶液均为现配。
1.6 甜米酒多酚的提取
根据文献[13]方法进行总多酚和游离多酚提取前处理。碱处理法用于米酒总多酚测定的前处理,即:用4.5 mL 2 mol/L NaOH 溶液(含10 mmol/L EDTA 和体积分数1%VC)在30 ℃下水解0.5 mL 甜米酒样品,处理时间30 min。水解完成后,用HCl 将样品pH 值调至3.0,加入300 mg NaCl 和40 μg 异芥酸作为内标。与总多酚提取方法相比,游离多酚前处理不经碱解处理。
米酒多酚的提取过程参考文献[14]。分别用0.5 mL 水溶液和0.5 mL 含NaCl 的米酒液,用2 mL 乙酸乙酯经3 次涡旋混匀提取,每次5 min。每轮提取后,样品经3 000 g 转速离心10 min,收集有机相,通过氮吹挥发完全。最后,将干燥残渣溶解于0.5 mL 甲醇。将制备的提取物用缓冲液适当稀释,过滤后进行高效液相色谱分析。使用上述提取程序对米酒样品做回收试验,结果酚类化合物的回收率(92.1%~107.0%)较高。
1.7 甜米酒多酚化合物的HPLC 检测
使用配备光电二极管阵列检测器(PDA)的高效液相色谱(HPLC)检测提取物中的酚类物质。操作条件是:柱温25 ℃,流速1 mL/min,进样量10 μL,检测器280 nm。在安捷伦C18 柱(250 mm×4.6 mm×5 μm)上进行色谱分离。用流动相溶液A(双蒸馏水含1.25%冰醋酸)和溶液B(甲醇)进行梯度洗脱。梯度洗脱程序:0~5 min,从85%溶液A和15%溶液B 到80%溶液A 和20%溶液B,线性梯度;6~25 min,从80%溶液A 和20%溶液B 到65%溶液A 和35%溶液B,线性梯度;26~35 min,从65%溶液A 和35%溶液B 到50%溶液A 和50%溶液B,线性梯度;36~45 min,20%溶液A 和80%溶液B;46~50 min,85%溶液A 和15%溶液B。
1.8 统计分析方法
所有测定3 个平行样品,结果均以平均值±标准误差表示。回归分析采用SPSS 22.0(美国SPSS公司),组间差异通过单因素方差分析(ANOVA)和Tukey 多重比较确定。主要成分分析(PCA)采用SIMCA 14.1(瑞典UMetrics)软件。
2 结果与分析
2.1 甜米酒多酚总量
用不同原料大米进行米酒酿制。表1 列出6种酿制米酒的总多酚含量,从144.53 mg/L 没食子酸当量到1 135.33 mg/L 没食子酸当量不等。其中,黑米酒(B2)总酚含量最高,其次是长糯米(L2)和紫米(P2),表明黑米是发酵高含量多酚米酒的首选原料。黄米酒中总酚含量最低,仅144.53 mg/L 没食子酸物质的量。试验结果显示:米酒中的多酚主要来源于发酵植物原料。除了发酵工艺和酒曲的影响外,不同的米酒原料显著影响米酒的品质参数,尤其是米酒的多酚含量。
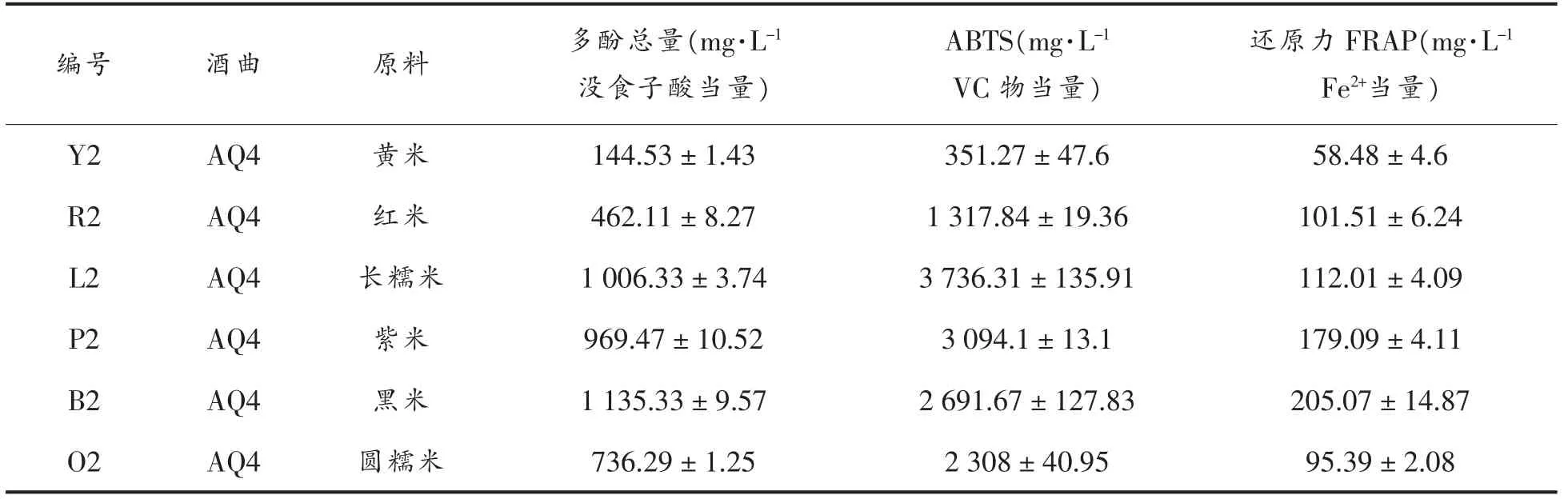
表1 不同原料米酒的多酚含量和抗氧化性Table 1 The polyphenol content and antioxidant acitivity of different rice wines
2.2 甜米酒抗氧化活性
采用基于自由基清除能力的ABTS 法和基于铁离子还原的FRAP 法对米酒进行抗氧化活性评价。表1 列出6 种米酒的抗氧化活性值。不同稻米原料的米酒的抗氧化性差异显著,米酒的ABTS值在351.27~3 736.31 mg/L VC 当量之间,米酒的FRAP 值在58.48~205.07 mg/L Fe2+当量之间。黑米发酵米酒虽然ABTS 清除能力略低,但是在FRAP 测定中显示最高还原力,黑米是酿制最佳抗氧化活性米酒的首选原料,与总酚含量的结果一致。米酒总酚与抗氧化活性(ABTS 和FRAP 值)之间相关性分析显示(图1):ABTS 检测方法中,6 种大米原料的米酒抗氧化值与总多酚含量的线性相关系数为0.829(P=0.042);FRAP 检测方法中,6种大米原料的米酒总多酚含量与抗氧化活性呈线性相关,相关系数为0.886(P=0.019)。米酒的自由基清除能力与其总多酚含量显著有关,说明多酚为米酒抗氧化性的主要成分。另外,有研究也报道了包括白葡萄酒、红葡萄酒、果酒和糯米酒等酒类的总多酚与抗氧化活性之间的正相关关系[6]。
2.3 甜米酒多酚化合物含量
不同米酒的多酚组成成分不同,酚类成分决定了米酒的质量和风味。采用HPLC 测定米酒样品的多酚组成。米酒中酚酸多酚多以酯化形式存在。碱水解后收集的总多酚含量(游离和共轭形式)及游离酚含量见表2 和表3。分别列出不同大米原料米酒中游离多酚和总多酚化合物的含量,结果显示,以黑米和紫米为原料发酵的米酒具有相似的多酚组成和含量,与其余4 种米酒差异较大。黑米酒和紫米酒中对羟基苯甲酸和芥子酸含量较高,而其它4 种米酒中这两种成分含量较低。黑米酒中对香豆素酸含量明显高于其它米酒。此外,所有米酒中香草酸是最丰富的多酚化合物,其次是阿魏酸。大多数肉桂酸和苯甲酸多酚以酯化或糖基化形式存在,经NaOH 溶液处理后可水解为游离多酚,导致相应多酚含量增加。没食子酸、3,4-二羟基苯甲酸、咖啡酸和丁香酸经碱处理后急剧增加,而对香豆素酸和阿魏酸的增量相对较低,说明不同多酚的结合酚含量与总酚含量的比值不同。
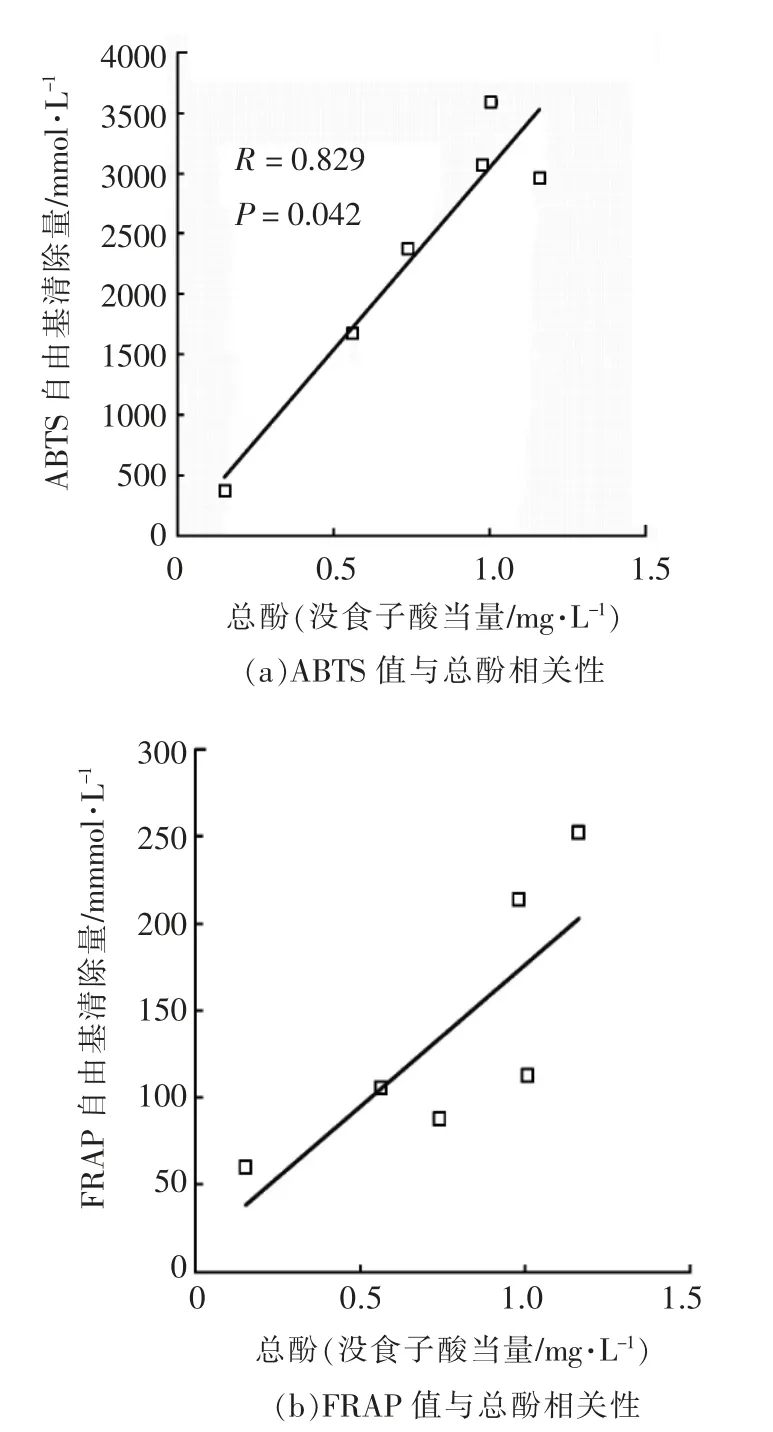
图1 不同米酒总酚与抗氧化性相关性分析Fig.1 Correlation analysis between polyphenol contents and antioxidant acitivities of different rice wines
与Folin-Ciocalteu 法测定的总酚含量结果相似,不同大米原料的米酒多酚含量有显著差异,游离多酚和总多酚的最低值分别为19.16 mg/L 和26.33 mg/L,最大值分别为49.74 mg/L 和72.71 mg/L。采用主成分分析法(PCA)对米酒样品的多酚谱进行数据相似性和差异性的可视化分析。PCA 结果与生化分析的结果类似,即不同原料的米酒多酚谱差异较为显著(图2)。L2、O2、R2 和Y2 样品在主成分PC1 轴上的位置接近,表明它们的多酚组成相似,均含有丁香酸、香草酸和没食子酸;P2 和B2 组成成分差异较显著。在主成分PC2轴上,B2、O2、R2 和Y2 样品的分布也很接近,表明其含有部分相同成分和含量,包括对香豆酸、芥子酸和绿原酸。
3 结论与讨论
研究结果显示,传统的HPLC 法检测到的米酒样品中多酚含量与福林酚法检测的总多酚含量之间存在明显的差异,该结果与红酒和白葡萄酒中膳食纤维结合多酚研究结果一致[15],表明大多数米酒多酚可与膳食纤维结合,在小肠中生物利用度较低。根据食物多酚的酶消化和结肠发酵的体外胃肠模型,肠道微生物群具有复杂的酶系统,大多数与膳食纤维结合的不可提取多酚在结肠中具有较高的生物利用度,并具有改善肠道微生态健康的作用[16-17]。除了对人体健康的多重益处外,多酚的抗氧化活性对酒类自身的抗衰老特性和最终的酒品质同样重要[18]。另外,一定量的多酚还有利于酒体的醇香和质地的形成,然而,米酒中过量的多酚往往通过与蛋白质分子的相互作用导致非生物混浊和沉淀[19],尤其是分子质量较大的聚合多酚。此外,过多的多酚会导致米酒的涩味、苦味和暗色[20]。了解多酚的作用和影响机制,优化多酚的组分和含量,对米酒最终品质有着重要的影响。
综上所述,在相同发酵条件和酒曲发酵剂下,6 种原料的米酒在总多酚含量、酚类物质和抗氧化活性方面差异显著。其中,黑米是酿制高含量多酚和抗氧化活性米酒的最佳选择。研究显示米酒中的多酚主要来源于发酵的植物原料。米酒发酵可能通过调节酶、代谢物与酚类化合物的相互作用加速多酚的释放。在对米酒进行营养和功能优化时,必须综合考虑米酒原料、酒曲以及发酵工艺等技术因素及其它们之间的相互作用。
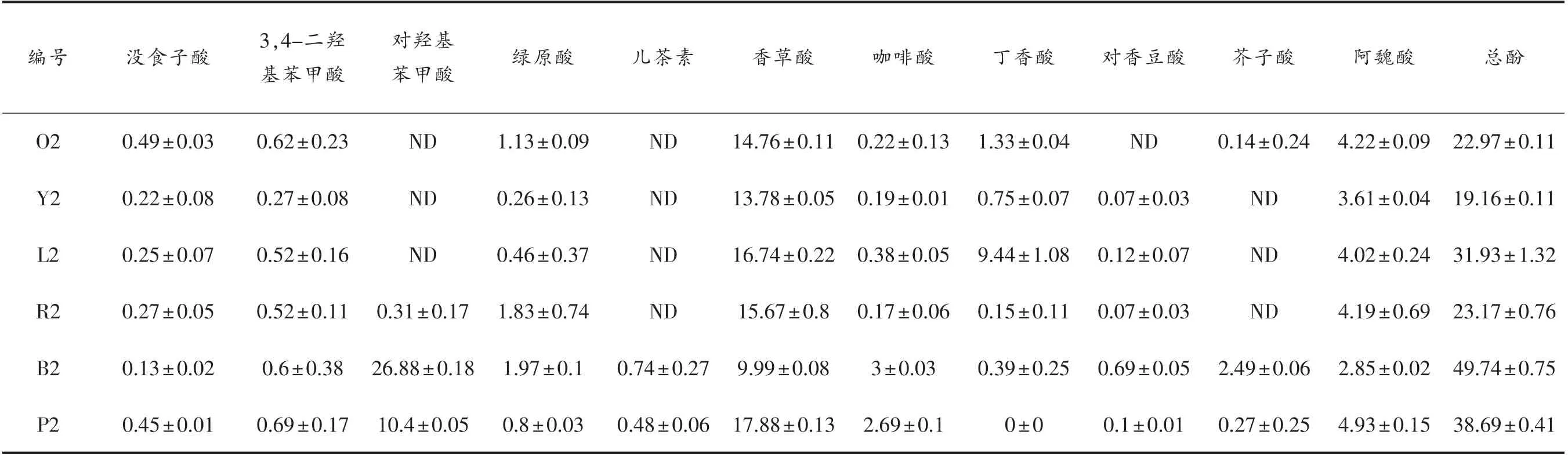
表2 不同原料米酒的游离多酚谱(mg/L 没食子酸当量)Table 2 Free polyphenolic profiles of different rice wines(mg/L gallic acid equivalents)
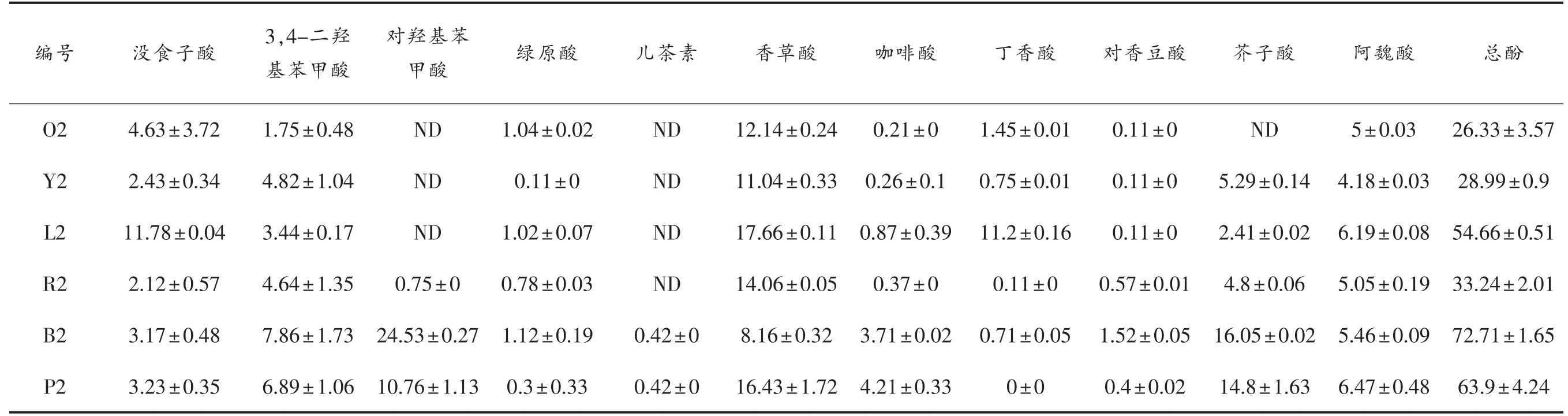
表3 不同原料米酒的总多酚谱(mg/L 没食子酸当量)Table 3 Total polyphenolic profiles of different rice wines(mg/L gallic acid equivalents)
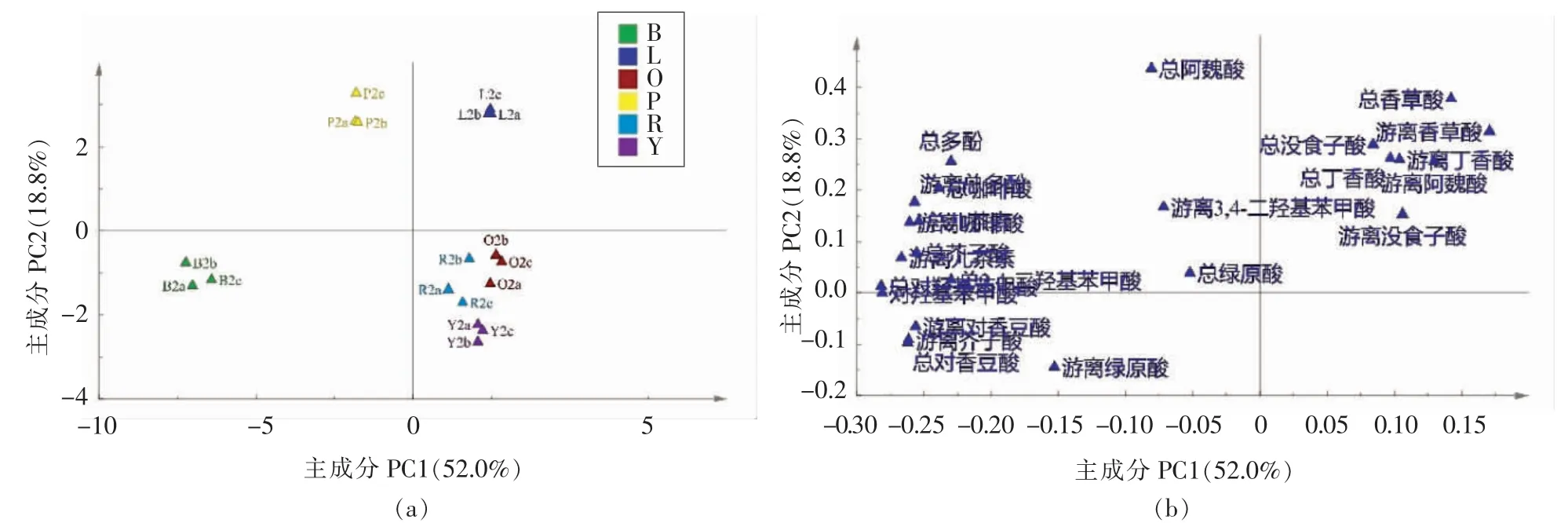
图2 不同原料米酒的多酚谱主成分分析Fig.2 Principal component analysis of phenolic profiles of different rice wines
——清徐老陈醋酿制技艺

