有机溶剂和混合油脂对脂肪酶活性恢复的影响
王致禹,陈晓倩,孟庆凤,李 春,刘丽波*,曲国强,孙雪婷
(1 东北农业大学食品学院 乳品科学教育部重点实验室 哈尔滨150030 2 交铁检验认证中心(成都)有限公司 成都610000)
脂肪酶(EC 3.1.1.3)是常用的生物催化酶制剂之一。脂肪酶可以水解甘油三酯并进行逆向合成反应合成新分子。脂肪酶可以作用于多种底物,在温和条件下表现出高区域选择性和对映体选择性。脂肪酶催化的反应主要有产量高,产物杂质少和环境友好等优点[1-2]。
诺维信脂肪酶(Lipozyme TL IM)是一种来源于疏棉状嗜热丝孢菌的sn-1,3 特异性脂肪酶,它能够催化酯化反应重新排列脂肪酸,具有高度的底物选择性和良好的热稳定性,用于人乳脂肪替代品的合成和生物柴油的制备中[3-6]。尽管Lipozyme TL IM 价格较低,工业化应用的成本还是目前急需解决的问题。通过优化工艺筛选高产菌株,提高脂肪酶活性以及再生等方法提高脂肪酶的产率和利用率,是实现脂肪酶工业化应用的最主要问题。
目前测定脂肪酶三级结构的方法主要是荧光光谱法,测定二级结构的方法主要有圆二色谱法和傅里叶变换红外光谱法。圆二色谱和傅里叶变换红外光谱可以区分脂肪酶二级结构中的α-螺旋、β-折叠、β-转角和无规则卷曲等结构[7-8]。目前提高脂肪酶活性的方法有很多。如:极性有机溶剂可以改变脂肪酶的构象[9],从而提高脂肪酶活性;超高压技术对有害酶有钝化作用,还可以提高一些酶的活力[10-11]。
本文通过使用荧光光谱和傅里叶变换红外光谱技术检测不同催化次数的脂肪酶,分析脂肪酶活性与二级、三级结构之间的关系。使用有机溶剂和混合油脂处理脂肪酶,使低活性脂肪酶的催化活性恢复,达到低活性脂肪酶重复利用的目的。
1 材料与方法
1.1 材料与试剂
Lipozyme TL IM(250 PLU/g),北京高瑞森科技有限公司;异丙醇,上海阿拉丁生化科技有限公司;椰子油,菲律宾Supercoco 集团有限公司;菜籽油,山东鲁花集团有限公司。
1.2 仪器与设备
PerkinElmer Spectrum 400 傅里叶变换红外-近红外光谱仪,美国Perkin Elmer 公司;F4500 荧光分光光度计,日本日立公司;Agilent 7890A 型气相色谱仪,美国Agilent 科技有限公司;Waters 2695-2420 高效液相色谱仪,美国Waters 科技有限公司。
1.3 试验方法
1.3.1 脂肪酶的预处理 在9 份具塞三角瓶中加入棕榈酸甘油三酯与油酸,物质的量比为1∶4,添加8%的Lipozyme TL IM 脂肪酶,在60 ℃,200 r/min 的气浴摇床中进行振荡反应,分别反应1~9次,每次反应时间为6 h。反应完成后,用100 目过滤筛分离油脂与脂肪酶,收集脂肪酶,用丙酮清洗脂肪酶表面多余的油脂,干燥后储存在4 ℃待用。
1.3.2 脂肪酶活性的测定 固定化脂肪酶可将1-丙醇和月桂酸酯化,形成丙基月桂酸酯。标准反应条件下每分钟生成1 μmol 的丙基月桂酸酯所需的酶的量为一个单位,表示为PLU。将约30 mg的Lipozyme TL IM 置锥形瓶中,加入10.73 g 反应底物(24.0 g 1-丙醇,80.1 g月桂酸和3.2 g 蒸馏水),盖上胶塞,立即放入60 ℃水浴中反应20 min。20 min 后取出锥形瓶,吸取5 μL 上清液,加入995 μL 庚烷,转移至气相样品瓶中。采用带有FID 检测器的Agilent 7890A 型气相色谱仪检测。毛细管柱选用restek stabilwas DA 柱(15 m×0.25 mm×0.25 μm),进样量0.7 μL。载气为氦气,流速1.7 mL/min,分流比50∶1。进样器温度280 ℃,检测器温度280 ℃。柱温程序:60 ℃保持1 min,以50℃/min 速率升至250 ℃保持2.2 min。试验结束后在以下温度清洗仪器3 h,除去仪器中的残留物。进样器350 ℃,检测器350 ℃,柱250 ℃[12]。
月桂酸到丙基月桂酸酯的转化量按式(1)计算:
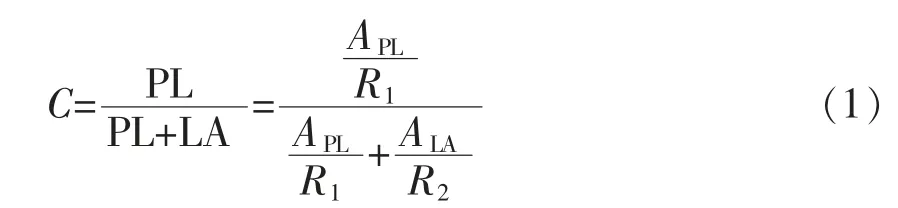
式中,C——月桂酸到丙基月桂酸酯的转化量(g);LA——月桂酸浓度(mmol/L);PL——丙基月桂酸酯浓度(mmol/L);APL——色谱图上丙基月桂酸酯的面积(mAUos);ALA——色谱图上月桂酸的面积(mAU·s);R1——标准曲线上丙基月桂酸酯的响应因子;R2——标准曲线上月桂酸的响应因子。
酶活性按式(2)计算:

式中:M——1-丙醇和月桂酸的初始量(g);C——转化成丙基月桂酸酯的月桂酸的量(g);m——催化剂干物质的量(g);t——反应时间(min)。
单位定义:在标准反应条件下每分钟生成1 μmol 的丙基月桂酸酯所需要的酶的量为一个单位,用PLU 表示。
1.3.3 脂肪酶二级结构的测定 分别测定使用0 ~9 次后脂肪酶的二级结构。将固定化的Lipozyme TL IM 脂肪酶在研钵中研成粉末,置真空冷冻干燥机中干燥12 h。取适量Lipozyme TL IM 真空冷冻干燥粉末,置于研钵中,与一定量溴化钾粉末混合,用研磨棒研磨均匀后压片,红外光谱测定,扫描范围4 000~400 cm-1[13]。图谱处理方法:选取傅里叶红外光谱图中的酰胺Ⅰ带图谱,使用Peakfit 4.12 曲线拟合软件。首先对酰胺Ⅰ带的图谱进行基线校正,调整参数对谱图去卷积。采用二阶导数方法对谱图的分峰拟合,用Origin 2018对图谱进行高斯曲线拟合,根据拟合峰的位置确定其对应二级结构类型,计算二级结构的含量。
1.3.4 脂肪酶三级结构的测定 使用荧光发射光谱分别测定使用0~9 次后脂肪酶的三级结构。荧光发射光谱条件:激发波长279 nm,激发狭缝和发射狭缝5 nm,扫描波长300~400 nm,速度12 000 nm/min,PMT 电压400 V,响应时间0.1 s。
1.3.5 脂肪酶活性的再生 考虑到工业化生产中,低活性脂肪酶的生产效率不高,使得时间成本增加,使用催化5 次的脂肪酶进行脂肪酶活性的再生试验。将使用5 次的脂肪酶用丙酮清洗去除表面多余的油脂,在20,30,40,50,60,70 ℃异丙醇中浸泡20,40,60,80,100,120 min 后取出干燥。将干燥好的脂肪酶按m混合油脂∶m脂肪酶=4∶1 的比例放入混合油脂(m菜籽油∶m椰子油=9∶1)中,室温下磁力搅拌24 h,过滤分离脂肪酶,用丙酮清洗脂肪酶表面的油脂,离心干燥[14]。
1.3.6 异丙醇对脂肪酶活性影响的正交试验 在异丙醇浸泡时间和温度对脂肪酶活性影响的基础上,设计二因素三水平试验,选出最佳条件。
1.3.7 脂肪酶对甘油三酯的位置特异性 取2 g棕榈酸甘油三酯和2.8 g 油酸加入具塞三角瓶中,加入0.38 g Lipozyme TL IM 脂肪酶,置于60 ℃,200 r/min 气浴摇床中反应6 h。反应结束后,取0.1 g 产物溶解于10 mL 正己烷中,过膜后待测。使用高效液相色谱法检测产物,研究脂肪酶的位置特异性。
高效液相色谱条件:配有蒸发光散射检测器(2420,美国沃世特公司)和分离模块(2695,美国沃世特公司)的高效液相色谱,色谱柱为C18 色谱柱(250 mm×4.6 mm,25 μm,大连依利特),流动相为丙酮和乙腈的混合液(v丙酮∶v乙腈=8∶2),流速1 mL/min,柱温30 ℃,进样量10 μL。
1.4 数据统计与分析
2 结果与分析
2.1 不同使用次数的脂肪酶的活性
图1 显示不同催化酯交换次数Lipozyme TL IM 的活性。随着脂肪酶使用次数的增加,脂肪酶的活性持续下降,使用0 次的脂肪酶活性为250.00 PLU/g,使用1 次和使用2 次的脂肪酶活性分别为190.58 PLU/g 和133.32 PLU/g,具有显著性差异(P<0.05)。使用3,4 次和5 次的脂肪酶的活性分别为84.31,83.73,83.50 PLU/g,与之前使用次数的脂肪酶活性均有显著性差异(P<0.05),而彼此间差异不明显。使用6,7 次和8 次的脂肪酶的活性分别为67.30,67.21,66.72 PLU/g,同样与之前各组的脂肪酶活性有显著性差异(P<0.05),而彼此间差异不明显。使用9 次的脂肪酶的活性为25.00 PLU/g(P<0.05)。
2.2 脂肪酶的二级结构
不同催化次数的脂肪酶的红外光谱图见图2。其中,脂肪酶的酰胺Ⅰ带(1 600~1 700 cm-1)可以反映脂肪酶的二级结构,据文献[13],[15],[16]报道,结合二阶导数图谱,可将脂肪酶酰胺Ⅰ带的各个子峰归属为不同的二级结构:1 615~1 640 cm-1和1 682~1 700 cm-1为β-折叠结构;1 640~1 649 cm-1为无规则卷曲结构;1 650~1 660 cm-1为α-螺旋结构;1 661~1 681 cm-1为β-转角结构。通过对不同使用次数的脂肪酶的红外光谱图酰胺Ⅰ带进行基线校正,去卷积,分峰拟合得到二阶导数图谱。拟合后各脂肪酶酰胺Ⅰ带的图谱见图3。通过对各子峰进行结构归属,计算各二级结构所占比例,得到不同使用次数脂肪酶二级结构的含量见表1。随着使用次数的增加,脂肪酶二级结构中β-折叠的含量逐渐增加,α-螺旋的含量减少,其它各二级结构增减程度不同。由此可见,脂肪酶活力的下降与β-折叠的增加有一定关系。敖敦格日乐等[13]发现经电场处理的脂肪酶活性增加,而脂肪酶的α-螺旋和β-折叠的含量均下降。张瑜等[17]指出,通过超高压处理的脂肪酶活性增加,脂肪酶中的α-螺旋含量提高,β-折叠含量降低,说明脂肪酶的活性与其β-折叠的含量呈负相关的关系。
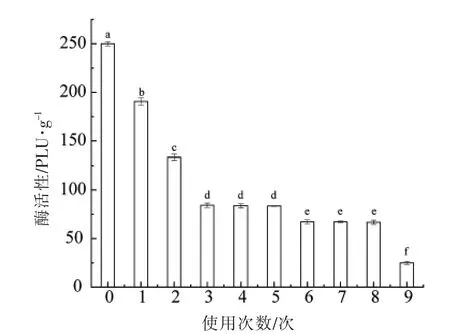
图1 不同使用次数Lipozyme TL IM 的酶活性Fig.1 The activity of Lipozyme TL IM with different usage times
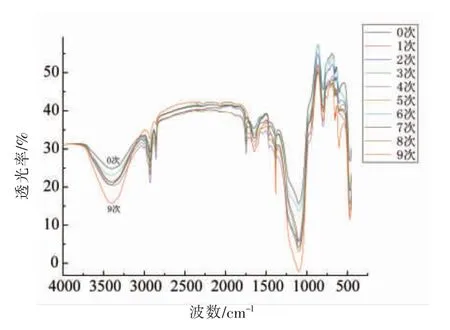
图2 不同使用次数脂肪酶的红外光谱图Fig.2 Infrared spectrum of lipases with different usage times

图3 不同使用次数脂肪酶的拟合曲线图Fig.3 Fitting curve of lipases with different usage times

表1 不同使用次数脂肪酶的二级结构含量Table 1 Secondary structure content of lipases with different usage times

(续表1)
2.3 脂肪酶的三级结构
大多数蛋白质都具有3 种能产生荧光发射光谱的内源性氨基酸,分别是酪氨酸、色氨酸和苯丙氨酸,这3 种氨基酸的侧链有生色基团,荧光峰位波长分别在348,303,282 nm 附近。一般情况下,这些氨基酸的侧链有疏水性,通常位于脂肪酶内核的疏水区。随着反应进行,脂肪酶表面结构被逐渐破坏,使这些疏水基团暴露出来,可通过荧光光谱检测观察脂肪酶结构的变化。图4 显示分别使用0~9 次的脂肪酶表面疏水性的荧光光谱图。在284.6 nm 附近有吸收峰,由此可以判断,脂肪酶Lipozyme TL IM 的内源性氨基酸以苯丙氨酸为主。随着使用次数的增加,荧光的吸光强度逐渐升高,表明随着脂肪酶使用次数的增加,脂肪酶的三级结构受到影响,使苯丙氨酸的暴露面积越来越大。表2 显示不同使用次数脂肪酶的最大发射波长和峰值。结合图4 和表2 可知,使用9 次的脂肪酶苯丙氨酸暴露最多,三级结构受到的影响最大。结合脂肪酶的酶活性显示:随着脂肪酶的活性逐渐下降,脂肪酶的荧光强度逐渐增强。可能是因为使用次数增加,导致一些维持空间结构的化学键被破坏,使脂肪酶分子的三级结构破坏,用于催化的空间结构崩溃,脂肪酶荧光强度增加,活性下降[18]。
2.4 异丙醇浸泡时间对脂肪酶活性的影响
将低活性的脂肪酶浸泡在30 ℃异丙醇中20,40,60,80,100,120 min,过滤分离脂肪酶后干燥,测定其活性。由图5 可知,在异丙醇中分别浸泡20,40,60,80,100,120 min 的脂肪酶活性分别为90.60,122.00,165.37,148.99,130.61,104.09 PLU/g。浸泡时间60 min 时,脂肪酶活性恢复的最高,为原脂肪酶活性的66.15%。异丙醇最佳的浸泡时间为60 min。
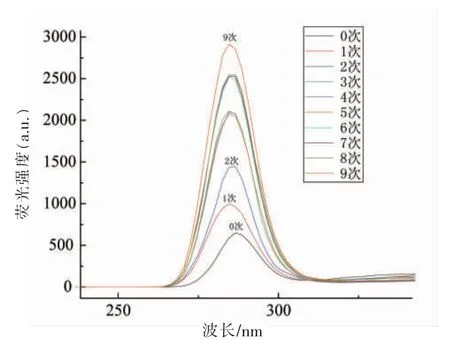
图4 不同使用次数脂肪酶的荧光检测光谱图Fig.4 Fluorescence detection spectrum of lipases with different usage times
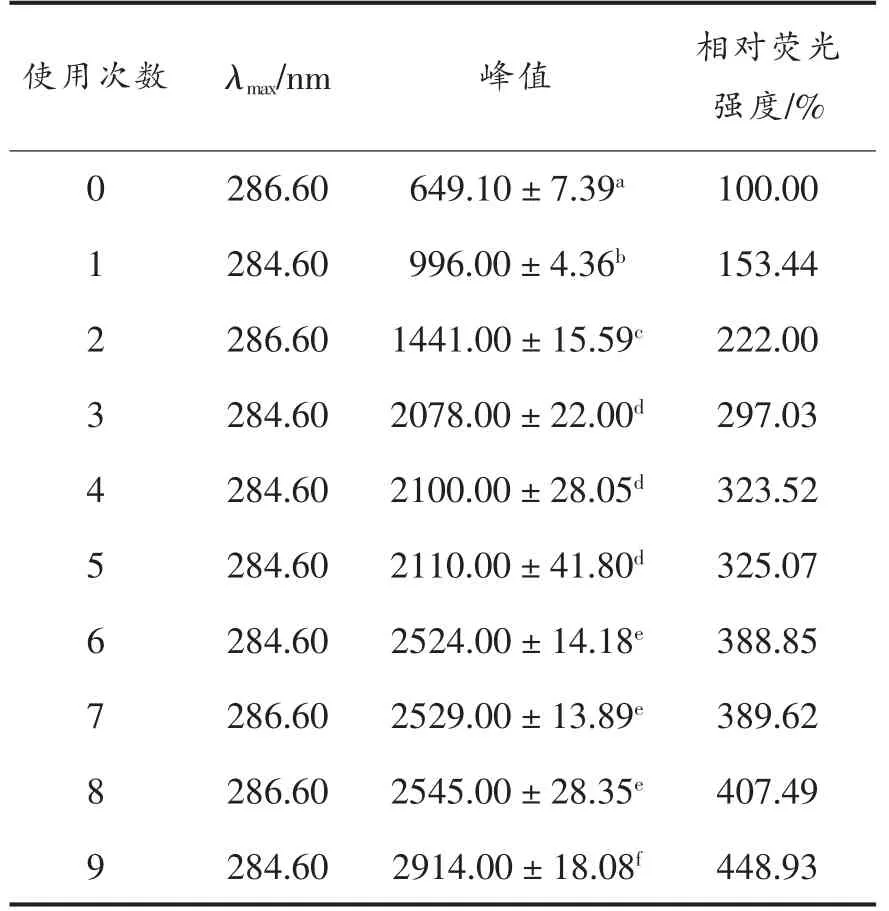
表2 不同使用次数脂肪酶的荧光强度Table 2 Fluorescence intensity of lipases with different usage times
2.5 异丙醇浸泡温度对脂肪酶活性的影响
将低活性的脂肪酶分别在20,30,40,50,60,70 ℃异丙醇中浸泡60 min,过滤分离脂肪后酶干燥,测定其活性。由图6 可知,在20,30,40,50,60,70 ℃的异丙醇中浸泡60 min 后脂肪酶活性分别为95.28,120.05,172.38,153.60,134.83,119.05 PLU/g。温度为40 ℃时,脂肪酶活性恢复的最高,为原脂肪酶活性的68.95%。异丙醇最佳的浸泡温度为40 ℃。有机溶剂能够提高脂肪酶活性,可能是因为极性有机溶剂与水的亲和性较好,在浸泡脂肪酶时,能够吸收脂肪酶中多余的水分,使脂肪酶中处于闭合状态的活性部位暴漏出来,与底物结合发挥作用[19-21]。祖昕等[22]研究发现,用极性较强的有机溶剂处理未使用过的固定化脂肪酶,可以明显提高脂肪酶的活性。Talukder 等[23]研究发现,使用异丙醇预处理的脂肪酶活性比没有处理过的脂肪酶要高。Chen 等[24]使用叔丁醇对活性降低的脂肪酶进行活性恢复,恢复后的脂肪酶活性为原脂肪酶活性的75%。以上试验结果均与本试验一致,极性有机溶剂可使脂肪酶的活性恢复。脂肪酶中残余的异丙醇可通过高速离心和氮吹等物理方法去除。
2.6 异丙醇对脂肪酶活性影响的正交试验
在异丙醇浸泡时间和温度对脂肪酶活性影响的基础上,选择浸泡时间为50,60,70 min,浸泡温度为25,30,35 ℃,设计二因素三水平试验,共9组,因素水平表见表3,试验条件和结果见表4。
通过对各组试验进行显著性分析可知,异丙醇浸泡脂肪酶恢复活性的最佳条件为:时间60 min,温度40 ℃。在此条件下,恢复后的脂肪酶的活性为172.38 PLU/g(P<0.05),脂肪酶活力为初始脂肪酶的68.95%。
将异丙醇处理过的脂肪酶放入室温下的混合油脂中,磁力搅拌24 h 后测定其酶活性为241.48 PLU/g。与异丙醇处理的脂肪酶活性相比,提高了40.09%。与原脂肪酶活性相比,经混合油脂处理的脂肪酶活性恢复了96.60%。Negishi 等[14]使用菜籽脱色油和中链甘油三酯混合物冲洗活性降低的脂肪酶Lipozyme TL IM,结果显示,Lipozyme TL IM的活性恢复到原活性的90%。

图5 异丙醇浸泡时间对脂肪酶活力的影响Fig.5 Effects of isopropanol soaking time on lipase activity
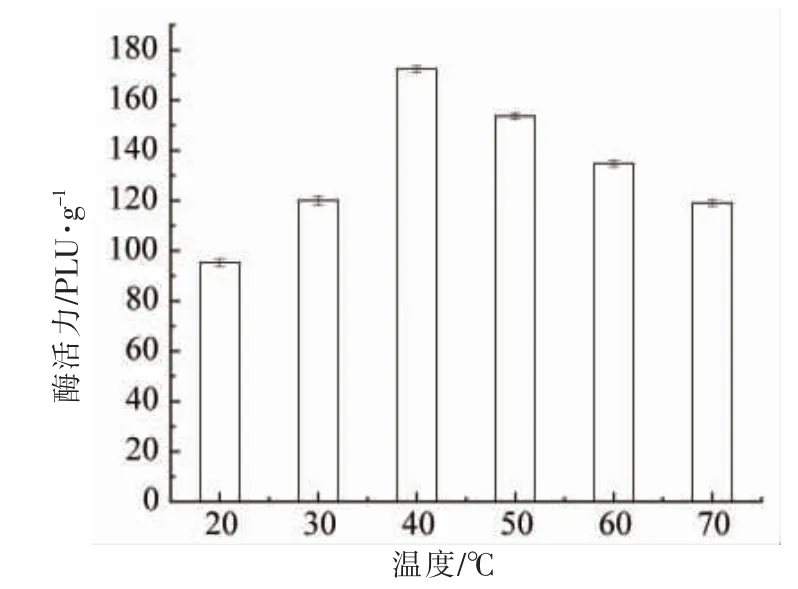
图6 异丙醇浸泡温度对脂肪酶活力的影响Fig.6 Effects of isopropyl alcohol soaking temperature on lipase activity
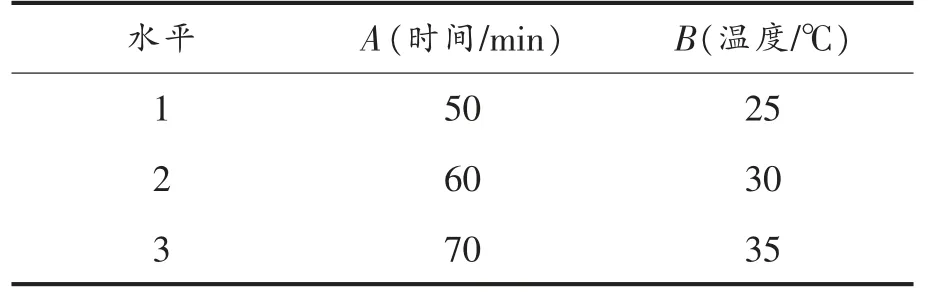
表3 正交试验因素水平表Table 3 Factor levels table of orthogonal test
2.7 脂肪酶对甘油三酯的催化位置特异性
以棕榈酸甘油三酯和油酸为底物,对脂肪酶Lipozyme TL IM 的催化位置特异性进行分析,结果见图7。
若脂肪酶经活性再生后的催化位置特异性改变或者丧失,则甘油三酯的2 位可能因酯交换反应而被油酸取代,即反应产物中有POP、OOO 或者OPP 生成。如图7所示,Lipozyme TL IM 催化棕榈酸甘油三酯和油酸产生的产物经液相色谱检测,含有1,3-二油酸-2-棕榈酸甘油三酯,这是因为催化底物为棕榈酸甘油三酯和油酸,产物中的1,3-二油酸-2-棕榈酸甘油三酯为脂肪酶催化合成的产物。Lipozyme TL IM 的位置特异性没有受到影响。

表4 异丙醇对脂肪酶活性的影响Table 4 Effects of isopropanol on lipase activity

图7 高效液相色谱检测结果Fig.7 High performance liquid chromatography test result
3 结论
本文主要研究了脂肪酶活性与其二级和三级结构间的关系。在脂肪酶活性降低时,脂肪酶二级结构中α-螺旋结构减少,β-折叠结构逐渐增多,且三级结构也受到影响。其荧光强度逐渐增强,氨基酸的暴漏面积随使用次数的增加而增大。本文还研究了低活性脂肪酶活性再生的方法。在经异丙醇和混合油脂浸泡后,低活性脂肪酶的活性得以再生,为原脂肪酶活性的96.60%。脂肪酶活性恢复后,其催化酯交换的位置特异性未受影响,为脂肪酶重复利用时结构变化和脂肪酶活性再生提供了保障。

