p53 基因敲除对小鼠神经行为及桶状皮层神经元数目的影响
焦翠王俭妹周雪颖况海霞刘辉保柳涛
(1. 南昌大学第一附属医院儿科,南昌 330006; 2. 新余市妇幼保健院儿科,江西 新余 338025)
p53 基因位于人类染色体17p13.1,可调控多种基因和microRNA 的表达,在细胞应对各种应激如DNA 损伤和缺氧等过程中起着关键作用,对维持生物的内环境稳定至关重要[1]。自1979年被发现以来,p53 作为一种抑癌基因在肿瘤的发生发展中扮演着重要的角色。近年来,越来越多的研究开始关注p53 基因在神经精神性疾病中的作用,机制与调控神经管发育[2]、突触可塑性[3]、神经元分化和轴突再生[4]等有关。研究发现,孤独症患儿外周血单核细胞p53 基因复制比率增高[5];阿尔茨海默病患者的成纤维细胞和血细胞中p53 蛋白构象改变,使蛋白功能受损、生长相关蛋白43(GAP-43)水平降低,导致神经元死亡[6-7];帕金森小鼠黑质纹状体系统中多巴胺能神经元p53 基因缺失时,通过下调促凋亡基因-Bax、Puma表达,增加神经元存活,产生神经保护作用[8]。虽然p53 基因在神经系统疾病中的作用已经被初步认识,但是对其研究多集中于体外培养的神经细胞及分子机制,而p53 基因缺失对动物神经行为学的影响的研究较少,且结果存在分歧。如Amson 等[9]研究发现,p53 基因敲除(KO)小鼠存在焦虑样行为,而Campana 等[10]研究结果则相反。因此,我们利用p53 基因敲除小鼠,探讨了p53基因缺失对小鼠的焦虑样行为和工作记忆能力等神经行为学及相关脑区神经元数目的影响,以期为深入研究p53 基因在神经系统疾病中的作用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
8 ~12周龄SPF 级p53 基因纯合敲除(KO)(C57BL/6-Trp53tm1/Bcgen)小鼠45 只及野生型(WT)小鼠(C57BL/6)38 只,雌雄不拘,体重18 ~25 g,均为C57BL/6 背景,购于北京百奥赛图公司【SCXK(京)2019-0001】,饲养于我校动物中心【SYXK(赣)2015-0001】。动物房维持12 h:12 h 的昼夜循环(7:00 ~19:00),室温23 ~25℃,湿度50%,可自由获取食物和饮水。实验动物操作严格遵守《南昌大学实验动物管理办法》及《南昌大学实验动物实验伦理审查》(伦理审批号2017(009))。
1.1.2 主要试剂与仪器
尼式染色液(Solarbio,中国)。旷场、Y 迷宫、纹理辨别实验装置(自制), 石蜡切片机(Leica RM2245,德国),包埋机(Leica GE1150H,德国),机械对流烤箱(Thermo scientific 51028873,美国),图像导航扫描仪(Olympus FSX100,日本),Matlab R2016b 分析软件(MathWorks,美国),Image-Pro Plus 6.0 分析软件(Media Cybernetics,美国)。
1.2 方法
1.2.1 旷场实验(open field test,OF)
本实验用于评测焦虑情绪与自发活动。开阔旷场大小为50 cm × 50 cm × 25 cm(长× 宽×高)[11],摄像头置于盒子正上方,光照强度为300 Lux 左右。随机选取野生型小鼠18 只、p53 基因敲除14 只小鼠进行该实验。测试时将小鼠放置于旷场中心(中心点至各边15 cm 以内),任其自由活动10 min。观察指标为小鼠在旷场中心活动的时间及运动总路程。用Matlab R2016b 软件进行数据析。测试室温度23 ~25℃,时间为8:00 ~17:00,每组测试结束后,用酒精擦洗盒子后再进行下一只实验鼠的检测。
1.2.2 Y 迷宫实验(Y-maze test,YM)
本实验用于检测工作记忆能力。测试盒为臂长40 cm、宽10 cm、高25 cm 的三臂水平迷宫[12],摄像头置于盒子正上方,光照强度为300 Lux 左右。随机选取野生型小鼠12 只、p53 基因敲除14 只小鼠进行该实验。测试时将小鼠放置在其中一臂末端,并使其鼻侧朝向迷宫的中心,自由活动5 min。观察指标为小鼠进入臂的总次数及自发交替率。用Matlab R2016b 软件进行数据析。小鼠按顺序依次进入三个臂为交替一次,计算公式为:交替率=交替次数/(进入臂的总次数-2)×100%。分析软件、测试条件及处理同1.2.1。
1.2.3 纹理辨别实验(texture discrimination task,TDT)
本实验用于评估触须敏感性[13]。测试盒与旷场实验相同,但测试时盒子底部覆盖以2 cm 厚的常规垫料,另有目标物a、b、c、d,0.5 cm × 15 cm × 4 cm(厚× 长× 宽),固定于4 cm × 4 cm 底座上。氧化铝砂纸覆盖在目标物底座上方2 cm 处,覆盖高度为7.5 cm,绕目标物一周。a、b、c 的砂纸为80 目,d 的砂纸为100 目[13]。为尽量减少不同砂纸之间的视觉差异,光照强度调弱为50 Lux 左右。随机选取野生型小鼠12 只、p53 基因敲除7 只小鼠进行该实验。实验分为适应期和测试期,共3 d。适应期(2 d)每天把小鼠放入不含目标物、覆盖垫料的测试盒中,自由适应10 min。测试期(第3天)包括两个阶段—学习阶段和测试阶段。测试当天,先在盒子底部覆盖垫料,再放入目标物a 和b,目标物底部埋入垫料中。将实验动物鼻侧背离目标物放入盒中,自由探索5 min,此为学习阶段。然后将实验小鼠移至一个覆盖干净垫料的中转笼中过渡5 min,与此同时将目标物a 和b 换成c 和d,再次将动物鼻侧背离目标物放入盒中,测试3 min,此为测试阶段。“探索”定义为小鼠的鼻触碰到物体或者鼻与物体的距离<2 cm,人工计数小鼠主动探索每个目标物的时间。在学习阶段未探索目标物、在测试阶段只探索一个目标物或者在两个阶段中总探索时间小于2 s 的小鼠因先天探索能力缺乏而被剔除。观察指标为在学习阶段探索两个相同纹理目标物(a 和b)的总时间及在测试阶段探索熟悉纹理(c)与新纹理(d)时间的百分比。测试条件及处理同1.2.1。
1.2.4 尼氏染色
小鼠予腹腔注射乌拉坦(1.2 g/kg)深度麻醉后,用30 mL 4℃生理盐水心脏灌流,断头取脑。将脑组织放入10%中性福尔马林中固定,脱水后进行石蜡包埋,制备3 μm 冠状切片(前囟-0.94 ~-1.28 mm)。尼氏染色时将切片浸入装有Cresyl violet Stain 试剂的染缸中,于机械对流烤箱56℃浸染1 h。然后用去离子水冲洗数次,随后置于Nissl Differentiation 液中分化数秒至2 min(背景接近于无色)。最后无水乙醇迅速脱水,二甲苯透明,中性树胶封片。对照组和实验组各取3 只小鼠的脑组织标本,从每个标本中随机选取≥3 张不同切面的切片于40 × 镜下观察,选取≥3 个不重叠视野计数桶状皮层II/III 层每个视野下的神经元数目。
1.3 统计学分析
实验数据均以平均值± 标准误差(±)表示,采用SPSS 17.0 软件进行统计分析。本研究统计方法均选用独立样本t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 旷场实验结果
小鼠在旷场中的运动轨迹及热图的代表图如图1A 所示。野生型小鼠和p53 基因敲除小鼠在旷场中心区域活动的时间分别为(67.51 ± 6.92)s 和(57.42 ± 8.50)s,无显著差异(P=0.360)(图1B);总运动路程分别为(3914.52 ± 401.64) cm 和(4637.91 ± 323.37)cm,无统计学差异(P=0.166)(图1C),表明p53 基因缺失对小鼠的焦虑样行为和自发活动无显著影响。
2.2 Y 迷宫实验结果
小鼠在Y 迷宫中的运动轨迹图和热图的代表图如图2A 所示。野生型小鼠和p53 基因敲除小鼠在Y 迷宫中的自发交替率(野生型小鼠:53.33% ±3.03%,p53 基 因 敲 除: 48.25% ± 3.94%,P=0.320)(图2B)和进入臂的总次数(野生型小鼠:33± 4 次,p53 基因敲除(28 ± 4)次,P=0.379)(图2C)均无显著差异,表明敲除p53 基因不影响小鼠的工作记忆能力。
2.3 纹理辨别实验结果
纹理辨别实验操作示意图如图3A 所示。测试当天,在学习和测试阶段,两种小鼠对相同纹理目标物(野生型小鼠(21 ± 5)s,p53 基因敲除(22 ± 7)s,P=0.892)和不同纹理目标物(野生型小鼠(19 ± 4)s,p53 基因敲除(14 ± 2)s,P=0.383)的总探索时间均相似(图3B),但p53 基因敲除小鼠对新纹理目标物探索时间与总探索时间的百分比较野生型小鼠更低(野生型小鼠: 59.98% ± 3.76%,p53 基因敲除:41.56% ± 3.55%,P=0.005)(图3C),说明敲除p53 基因可损伤小鼠对新纹理的辨别能力,即触须敏感性降低。
2.4 尼氏染色结果
尼式染色代表图如图4A 所示。p53 基因敲除小鼠桶状皮层第II/III 层神经元数目较野生型小鼠显著减少(野生型小鼠(68 ± 1)个,p53 基因敲除(61 ± 1)个,P=0.002)(图4B),说明敲除p53 基因可影响神经元的生长。
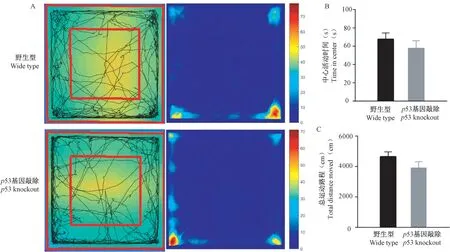
图1 旷场实验测试结果(±s)Note. A. Representative tracks and heat maps of mice movements in the open field test. B. Histogram indicating the center time calculated from the open field test. C. Histogram indicating the total distance moved in the open field test.Figure 1 The results of the open field test(±s)
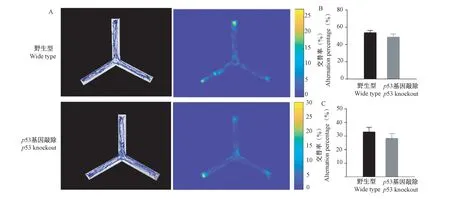
图2 Y 迷宫实验测试结果(±s)Note. A. Representative tracks and heat maps of mice movements in the Y-maze test. B. Histogram indicating the percentage of spontaneous alternation in the Y-maze test. C. Histogram indicating the number of arms entries in the Y-maze test.Figure 2 The results of the Y-maze test(±s)

图3 纹理辨别实验测试结果(±s)Note. A. Histogram indicating the total time spend to investigate the textures object. B. Histogram indicating the percentage of time to investigate the novel textures in the texture discrimination task. Compared with the WT mice, ∗∗P<0.01. (The same in the following figure)Figure 3 The results of the texture discrimination task(±s)
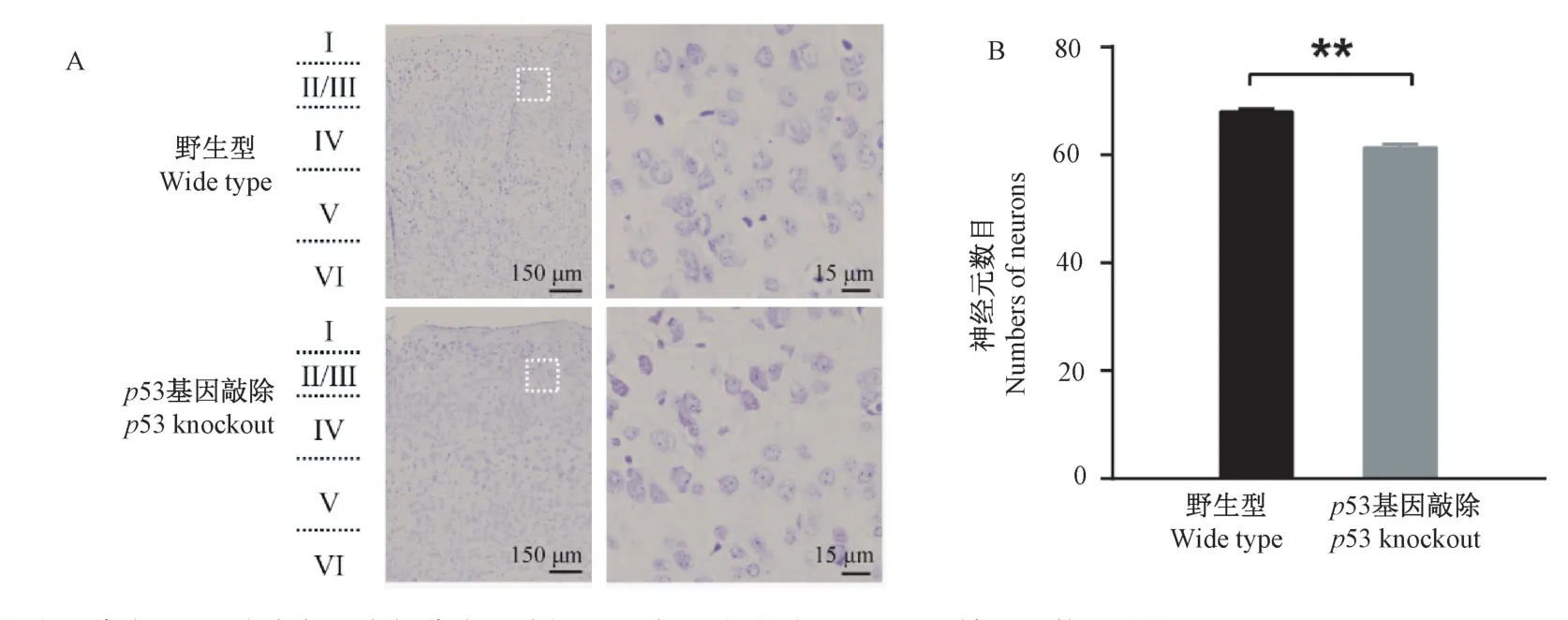
图4 尼氏染色结果(±s)Note. A. Representative photomicrographs of the barrel cortex sections (Nissl staining), white squares represent the areas for analysis. B. Histogram indicating the number of neurons in the layers II/III of the barrel cortex.Figure 4 The results of the Nissl staining(±s)
3 讨论
在神经系统中,p53 基因广泛分布于海马、丘脑和小脑等部位[14],它不仅可通过调控神经元分化相关基因如GAP-43[15]和Map2[16]等的转录和表达影响神经元分化和轴突再生,从而在神经系统的正常发育中发挥重要的功能;还参与调控神经元凋亡相关基因[17],在癫痫发作后神经元凋亡[18]和脑缺血再灌注损伤时细胞的自噬及凋亡[19]等病理情况下也具有重要的作用。
焦虑症是一种常见的精神疾病,是当面对威胁或压力时产生的持续存在的恐惧感。评估小鼠的焦虑样行为的常用方法有高架十字迷宫和旷场实验等,两者对焦虑应变差异的检测与旷场实验敏感性相当,通常可以相互验证。Amson 等[9]在圆形旷场实验中发现p53 基因敲除小鼠具有焦虑样行为,而Campana 等[10]在高架十字迷宫实验中的结果与此相反。相比于圆形旷场,方形旷场更常用于啮齿类动物焦虑样行为的评估[11]。本研究中方形旷场实验结果显示p53 基因敲除小鼠无焦虑样行为,与Campana 等[10]观点一致。研究表明,开阔旷场的形状、大小、材质、实验持续时长、数据采集方式(摄像系统或红外系统)和测试时的光强等均可能对测试结果有一定的影响[20]。因此,上述结果不同可能与实验装置、照明条件、实验时长、数据采集和分析系统均不同有关。此外,王维刚等[21]研究认为,相较于其他行为学实验,如强迫游泳、水迷宫实验等,旷场实验对小鼠的影响较小,因此在同一批小鼠进行不同行为学实验时,通常应先进行旷场实验。Amson 等[9]在Morris 水迷宫实验后进行旷场实验也可能是导致其测试结果不同的原因。此外,Campana 等[10]通过旷场实验、加速旋转棒测试观察到p53 基因敲除小鼠基础运动能力正常且无共济失调,但它们存在行走同步缺陷,可能与p53 基因缺失导致小脑发育异常有关。与Campana 等[10]一致,我们的结果表明p53 基因敲除小鼠活动能力正常,排除了因小鼠活动能力异常导致焦虑样行为测试结果阴性的可能。
学习记忆力受损是认知功能障碍中较为常见的一种表现,Morris 水迷宫和Y 迷宫是目前最常用的评估方法之一。前者侧重于测试实验动物对空间位置感和方向感(空间定位)的学习记忆能力,后者则主要观察动物的注意力、短时记忆和对信息的处理等工作记忆能力。研究发现p53 基因敲除小鼠在水迷宫实验中表现出空间学习记忆能力受损[9],可能由于p53 基因缺失后机体抗凋亡能力下降,从而导致p53 基因敲除小鼠神经细胞减少和大脑发育异常。Morris 水迷宫对工作记忆的测试不如Y 迷宫敏感[22],本研究中,p53 基因敲除小鼠在Y 迷宫中的自发交替率和进入臂的总次数与野生型小鼠无差异,表明其工作记忆能力未受损。
啮齿类动物的触须是一种非常发达的感觉器官,触须的感觉输入与觅食、探索、感知危险等日常活动息息相关。学者们通常通过刺激小鼠触须或剪除触须从而剥夺其触须感觉输入,进而观察其中枢投射部位—大脑躯体感觉皮层桶状区域(barrel field of the somatosensory cortex,S1BF)神经元的可塑性,这是一种常用于感觉经验以及学习与记忆等任务研究的范式。桶状皮层(barrel cortex)是S1BF 中的一个特殊区域,约占体感皮层的20%,共分为六层,其Ⅳ层可见“barrel”的桶状结构,每个“barrel”与啮齿类动物的面部触须具有一一对应的关系。研究发现,经触须识别的信号到达桶状皮层Ⅳ层神经元后进一步向上投射至II/III 层,该区域也是小鼠纹理识别任务主要的研究部位[23-25]。在本研究中,我们发现p53 基因敲除小鼠对新纹理辨别能力减弱,即触须敏感性受损,并除外了先天探索缺陷、自身焦虑、工作记忆障碍及自发运动对其的影响。为进一步探究其机制,我们对p53 基因敲除小鼠大脑桶状皮层II/III 层神经元进行定量分析,结果显示p53 基因敲除小鼠该区域神经元数目较野生型小鼠显著减少。由于脑源性神经营养因子及其下游的GAP-43 因子对桶状皮层神经元生长至关重要[26],p53 基因缺失导致GAP-43 表达下调[7,15]可能是神经元数目减少的原因之一,进一步研究该信号通路对明确p53 在神经系统疾病中的作用具有重要的意义。
综上所述,本研究观察了p53 基因敲除小鼠的情绪、认知、感觉及运动方面的神经行为学测试结果,并初步探讨了其细胞机制。我们的结果首次揭示了p53 基因缺失可导致小鼠触觉行为异常,并初步分析这种异常与桶状皮层II/III 层神经元数目减少有关,为后期进一步探讨这一内在机制及p53 基因对神经系统的作用提供了理论基础。

