WDR5在大鼠肾脏缺血再灌注损伤中的作用及机制研究*
张 伍 刘修恒 王 磊
肾缺血再灌注损伤(Renal Ischemia-reperfusion Injury)是指肾脏缺血恢复血流灌注后,肾功能无法恢复、甚至损伤进一步加重的现象[1]。肾脏缺血再灌注损伤通常继发于各种类型的出血性休克,此外,急性肾动脉阻塞、肾脏移植术、肾部分切术或某些全身性疾病手术,也会引起肾脏缺血再灌注损伤发生[2]。WDR5基因为编码WD-重复蛋白家族的成员,由40个左右的氨基酸残基组成,具有保守的GH(甘氨酸和组氨酸)和WD(色氨酸和天冬氨酸)序列。该家族成员参与各种细胞过程,包括细胞周期进程,信号转导,细胞凋亡和基因调控。关于WDR5在肾脏缺血再灌注损伤中的相关作用,目前尚缺乏相关文献报道。本实验选用的WDR5-0103抑制WDR5蛋白在细胞内功能的表达,通过大鼠肾脏缺血再灌注损伤模型,探讨WDR5在大鼠肾脏缺血再灌注损伤中对细胞凋亡和炎性反应中的影响,以期为临床上肾脏缺血再灌注损伤提供新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1动物:48只成年雄性SD大鼠(200-220g)由武汉大学实验动物中心提供。 维持室温25℃,相对湿度65%-70%,日光黑夜周期各12h(光照时间为8∶00-20∶00),分笼饲养,自由进食进水,饲养2周后开始进行实验。本项目得到武汉大学实验动物委员会的批准,所有程序均符合《实验动物的护理和使用指南》。
1.1.2药物、试剂和仪器:WDR5抑制剂(WD-Repeat Protein 5-0103,批号S218401)购自美国Selleck公司,Toll样受体4 (TLR4)抗体(批号ab22048)、核因子κB(NF-κB)抗体(批号ab16502)、WDR5抗体(批号ab22512)购自于美国ABCAM公司,DMSO(二甲基亚砜,批号RNBF2134)购自美国SIGMA公司,实验时采用双蒸水配置为2%浓度溶液备用;β-actin及二抗购由中国博斯特生物技术公司设计并合成,血尿素氮(BUN)检测试剂盒(批号C013-2-1)和血清肌酐(Cr)检测试剂盒(批号C011-2-1)购自中国南京建成生物公司。荧光显微镜(Leica DMi8)购自德国徕卡,ABI PRISM 7500型荧光定量PCR仪购自美国BIO-Rad公司,研磨仪购自美国MP Bio公司;Thermo FC酶标仪、分光光度计购自美国Thermo Fisher公司;冷冻离心机购自美国Beckman Coulter公司。
1.2 动物分组和处理
按照随机数字列表法将大鼠分成6组(每组8只),对照组:用戊巴比妥(50mg/kg,i.p.)完全麻醉后放在恒温台上,维持体温为37℃,经腹部正中切口进入腹腔切除右肾,后缝合腹壁;肾缺血再灌注损伤组(IR组):手术过程同对照组,切除右肾后,用血管夹夹闭左肾血管阻断血流,观察到肾脏变为暗红色证明阻断成功,成功阻断45min后松开血管夹,观察到肾脏变为鲜红色则证明再灌注成功; DMSO组:手术同IR组,在闭合左肾血管45min,松开血管夹后腹腔注射4%DMSO(1ml/kg); WDR5-0103低、中、高剂量组:在缺血45min处理后,腹腔注射不同剂量的WDR5-0103(剂量分别为1mg/kg、5mg/kg、25mg/kg),余同IR组。
1.3 Western Blot检测肾脏缺血再灌注损伤后的
TLR4蛋白和NF-κB蛋白表达水平肾再灌注损伤24h后,麻醉大鼠,获取左肾组织,切取1g肾上极皮质组织,在含有蛋白酶抑制剂的RIPA裂解缓冲液中匀浆后,4℃离心15min,取上清液,收集肾组织总蛋白,采用BCA法进行蛋白定量检测。随后用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,将其转移到冰水浴中的PVDF膜上,常温下用5%的无脂牛奶封闭1h,加入一抗4℃孵育12h,之后用TBST洗膜3次,每次20min。加入二抗室温下孵育2h,然后用TBST洗膜3次,每次10min,最后使用增强的化学发光试剂将条带可视化,使用Image Pro Plus软件进行光密度分析,以目的条带与β-actin条带灰度值的比值表示该蛋白的相对表达水平。
1.4 大鼠血清BUN和Cr水平检测
将大鼠处死后固定在实验台边缘位置,左手抓紧大鼠颈部皮肤固定头部,并轻轻向下压迫颈两侧,使眼球充血。用事先准备好的10号金属针头顶端(针尖斜面朝内),垂直插入内眦并向眼底方向转动以切开静脉丛,观察采集管刻度,待所收集的血液量达到1ml时停止采血。而后将血样常温离心获得血清后备用,取三只试管按空白管、标准管、测定管分为三组,分别加入双蒸水,10mol/L BUN标准应用液,待测血清样本0.02ml,而后三只试管皆加入缓冲酶液0.25ml,酚显色剂1ml及碱性次氯酸钠1ml后充分混匀于37℃水浴加热10min。制备好待测样本后,将仪器用双蒸水调零,测定各管于波长640nm处吸光度OD值,Cr测量方法类同,于546nm波长处分别测定空白管、标准管、测定管三组吸光度OD值。OD值测定后以分光光度法计算得出血清BUN和Cr水平。
1.5 大鼠肾脏组织的病理学观察
将大鼠肾脏组织以10%甲醛固定、常规石蜡包埋、4μm切片。H-E染色后,光镜观察肾脏组织学病变;TUNEL染色,光镜观察肾脏组织的细胞凋亡变化,染色后呈褐色的即为凋亡细胞。利用Image Pro Plus对凋亡细胞和正常细胞进行计数并计算细胞凋亡率,细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数) × 100%。
1.6 肾组织WDR5表达
采用免疫组化(Streptavidin-Perosidase,SP)法检测。取肾组织石蜡切片,厚度为4μm,加入WDR5(1∶100)抗体及相应二抗,DAB显色5min后封片。细胞核有棕黄色表达者为WDR5阳性细胞。
1.7 肾脏组织内肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、细胞间黏附分子-1(ICAM-1)等炎性因子mRNA水平检测
采用qRT-PCR法检测炎性因子mRNA水平,取1g大鼠左肾皮质组织,应用Trizol试剂分别提取对照组、IR组、DMSO组和WDR5-0103高剂量组4组细胞的总RNA,逆转录后得到cDNA,逆转录体系为: 5× iScript Reaction Mix 4μl, iScript Reverse Transcriptase 1μl, RNA模板1μg,后加水至20μl,然后进行qRT-PCR。10μl反应体系如下: iTaqTM universal SYBR Green supermix(2×)5μl,上、下游引物1μl,DNA模板2μl,最后加水至10μl。95℃预变性5min,95℃ 10s, 60℃ 30s,40个循环。每组重复3次实验,用2-ΔΔCt法计算各组mRNA的相对表达量。所用引物(由生工科技武汉有限公司合成序列)如下:TNF-α上游引物:5’- CTT CTC ATT CCT GCT CGT GG -3’,下游引物:5’- TCC GCT TGG TGG TTT GCT AC - 3’;IL-1β上游引物:5’- ACT ATG GCA ACT GTC CCT GAA C -3’,下游引物:5’- GTG CTT GGG TCC TCA TCC TG -3;ICAM-1上游引物:5’-GGG ATG GTG AAG TCT GTC AA-3’,下游引物:5’- GGC GGT AAT AGG TGT AAA TGG-3’;内参β-actin:上游引物:5’-TGC TAT GTT GCC CTA GAC TTC G-3’,下游引物:5’-GTT GGC ATA GAG GTC TTT ACG G-3’。
1.8 统计学处理

2 结 果
2.1 各组大鼠血清Cr和BUN水平比较
与对照组相比,IR组血清Cr、BUN水平明显上升(t=27.36、18.24,P均<0.01);与IR组比较,各不同浓度WDR5-0103组血清Cr、BUN水平明显降低(t均<17.83,P均<0.01)。不同浓度的WDR5-0103组中,高剂量组的血清Cr和BUN水平下降最明显(t=29.27、15.68,P均<0.01),见表1。因此,后续实验中均以WDR5-0103高剂量组进行实验。

表1 各组大鼠血Cr及均=8)
2.2 各组大鼠肾脏WDR5蛋白表达水平比较
SP染色结果(图1和表2)显示,WDR5蛋白在肾缺血再灌注损伤的大鼠肾小球基底膜和肾小管上皮细胞内均有显著表达(棕黄色颗粒),主要定位在细胞核,各组WDR5蛋白表达水平差异均有统计学意义(F=405.94,P<0.01)。与对照组比较,IR组WDR5表达明显增高,OD值分别为0.12±0.07、0.58±0.25(t=48.62,P<0.01);与IR组比较,WDR5-0103高剂量组其表达明显降低,OD值为0.27±0.12(t=31.53,P<0.01)。

图1 各组大鼠肾组织内WDR5蛋白表达(SP法,×200)
2.3 各组大鼠肾脏缺血再灌注损伤后的病理学改变
对照组肾小管上皮细胞结构正常,肾小球及肾小管未见明显异常改变(见图2),IR组和DMSO组可见明显肾组织损伤,肾小管上皮细胞肿胀,管腔扩张,刷状缘消失,肾小管结构排列紊乱、松散,间质部分狭窄和炎性细胞浸润,蛋白管型也有明显增加。WDR5-0103高剂量组损害较轻,仅有细胞轻度肿胀,细胞排列较为整齐,无明显改变。

图2 各组大鼠肾脏缺血再灌注损伤后的病理学改变(HE染色,×200)
2.4 各组大鼠肾脏组织细胞凋亡率比较
各组肾脏组织细胞凋亡率差异均有统计学意义(F=167.23,P<0.01),与对照组(1.80±0.20)比较,IR组(31.18±1.27)和DMSO组(30.62±1.13)细胞凋亡率明显增加(t=19.53、13.81,P<0.01);与IR组比较,WDR5-0103高剂量组细胞凋亡率(9.70±0.81,t=12.31,P<0.01)明显减少。
2.5 各组大鼠肾组织TNF-α、IL-1β、ICAM-1 mRNA水平比较
各组大鼠肾脏组织TNF-α、IL-1β、ICAM-1 mRNA水平差异均有统计学意义(P<0.01)。与对照组比较,IR组炎性因子mRNA水平明显升高(t=17.63、23.57、12.41,P<0.01);与IR组比较,WDR5-0103高剂量组炎性因子mRNA水平明显降低(t=23.81、47.33、19.82,P<0.01)。
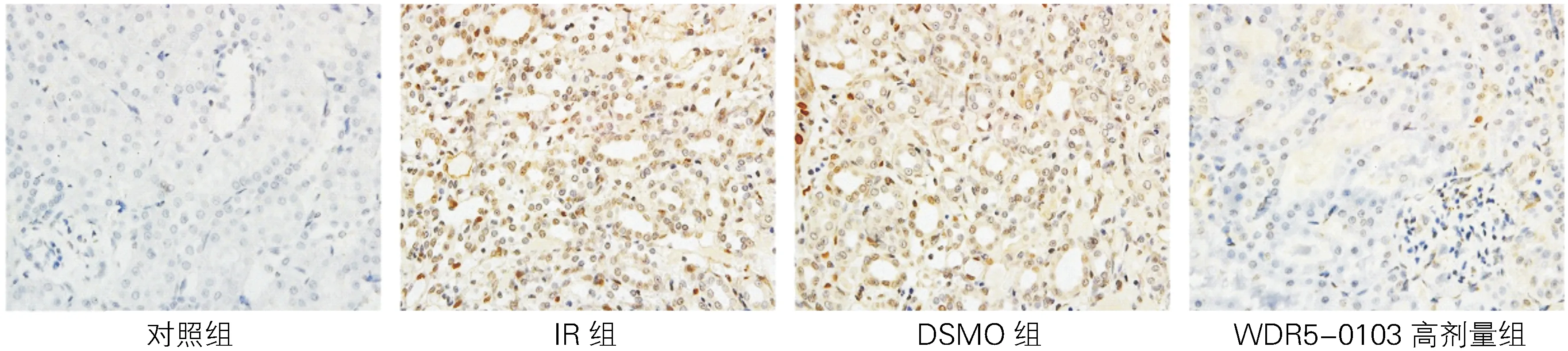
图3 各组大鼠肾脏缺血再灌注损伤后细胞的凋亡反应(TUNEL法,×200)

表2 各组大鼠肾脏组织炎性因子mRNA水平(OD值,均=8)
2.6 各组大鼠肾脏组织TLR4、NF-κB蛋白表达水平比较
各组大鼠肾脏组织TLR4、NF-κB蛋白表达水平差异有统计学意义(P<0.01),与对照组相比,IR组TLR4和NF-κB蛋白表达明显上升(t=58.82、46.62,P均<0.01);与IR组相比,WDR5-0103高剂量组TLR4和NF-κB蛋白表达水平明显降低(t=24.13、47.14,P均<0.01),见图4和表3。

图4 各组大鼠肾脏缺血再灌注损伤后的TLR4和NF-κB蛋白表达(Western Blot)
3 讨 论
随着泌尿外科手术的发展,急性肾损伤的发生率与日俱增,而肾缺血再灌注损伤是其形成的最主要原因之一。急性肾衰竭在临床上较为常见,其发病凶险,致死率高,即使在很多发达国家,其发生率也达到3.2-9.6%,死亡率更是占据住院患者的20%左右[3]。肾缺血再灌注损伤患者血液中Cr和BUN水平明显升高;体内炎症反应加剧,患者血液中可检测到高浓度的TNF-α、IL-1β及ICAM-1等炎性因子[4]。由于肾小管上皮细胞线粒体高度肿胀,肾小管细胞发生凋亡或坏死,在镜下可观察到细胞排列紊乱甚至崩解以及细胞中新形成的空泡[5]。因此,为了有效减少泌尿外科术后的并发症,积极有效地预防肾缺血再灌注损伤显得尤为重要。目前,由于缺乏有效应对肾缺血再灌注损伤的特定药物,使得肾缺血再灌注损伤的机制研究显得尤为重要。

表3 各组大鼠大鼠肾脏组织的TLR4和NF-κB蛋白表达(OD值,均=8)
WDR5基因是编码WD重复蛋白家族的一个重要成员,每个WD重复蛋白是都是由多个高度保守的 WD基元组成 ,基元间的许多结构具有相关性,在生理功能上则呈现为多样性。例如:细胞内的信号转导、染色体的修饰、蛋白质的运输以及RNA的转录和加工过程中,WD蛋白家族都扮演了重要的角色。尽管大部分WD重复蛋白结构非常保守 ,但其可通过改变基元数目和利用不同外在结构域的修饰,使其在功能上表现出明显的差异 。因此 ,保守的 WD重复蛋白能够参与多种生物机制调节过程,如细胞分裂、细胞程序性死亡、分生组织的形成等[6]。本研究首次发现WDR5在肾脏缺血再灌注过程中表达水平升高,抑制WDR5水平,可减轻肾缺血再灌注损伤后的血清Cr及BUN水平,抑制缺血再灌注损伤。本实验采用的WDR5-0103是一类脂溶性小分子,不溶于水,经DMSO溶解后腹腔注射给药。WDR5-0103可与WDR5上的肽结合袋结合(Kd=450nM),在体外抑制髓系混合系白血病核心复合物的催化活性(IC50=39M),从而达到抑制WDR5蛋白在细胞内功能的表达。
TLR4属于跨膜蛋白的一种,主要功能为调节细胞内的免疫过程。 NF-κB是一种可以调节细胞内多种基因的表达的转录因子,其功能包括编码细胞粘附分子、炎症趋化因子和细胞因子(例如TNF-α、IL-6和MCP-1等)[7]。TLR4/NF-κB是一种常见的信号通路,广泛参与了细胞内生命活动的调节。研究表明,TLR4/NF-κB调节通路在细胞增殖和凋亡过程中起着重要作用[8],其调控过程受到多种细胞内活性因子及生物活性物质影响[9],脂多糖(LPS)可通过抑制RAW 264.7巨噬细胞中的TLR4/NF-κB信号通路来降低其所诱导的炎症水平[10]。本实验发现WDR5-0103不仅可降低细胞内的TNF-α、IL-1β及ICAM-1等炎性因子mRNA水平,还可减轻肾缺血再灌注组织的细胞凋亡,其机制可能与降低TLR4/NF-κB通路表达有关,表明WDR5-0103在大鼠肾缺血再灌注组织损伤中发挥了保护作用。
综上所述,WDR5-0103可减轻肾缺血再灌注损伤后的细胞凋亡,抑制组织内炎症反应,其作用机制可能与下调TLR4 /NF-κB通路表达水平有关,这为临床上防治肾缺血再灌注损伤提供了新的思路。

