乳腺癌耐药细胞株外泌体中small RNA表达分析*
洪晓绿 黄小华程 璐 赖金国 潘小平,#
外泌体(Exosome)是一种直径为40-100nm 的盘状囊泡,其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,囊泡内包含多种蛋白质类型,包括细胞表面受体、胞浆信号蛋白、代谢酶、细胞骨架成分和核蛋白,也含有RNA转录物、长链非编码RNA、小分子RNA(small RNA)等[1]。Small RNA包括微小RNA(miRNA)、转运RNA来源的小RNA(tRNA-derived small RNAs, tsRNA)、与Piwi蛋白相作用的RNA(Piwi-interacting RNA, piRNA)和干扰小RNA(small Interfering RNA, siRNA)等。外泌体携带small RNA在许多疾病和肿瘤中发挥重要作用[2-4],包括乳腺癌[5],外泌体携带small RNA还能介导乳腺癌细胞的耐药性[6],但对其影响乳腺癌耐药机制的研究大部分集中在miRNAs[7]。鉴于此,本文检测乳腺癌细胞株和乳腺癌耐药细胞株外泌体中small RNA表达的差异,旨在为研究外泌体携带small RNA在乳腺癌耐药机制中的作用提供研究基础。
1 材料与方法
1.1 细胞培养
人乳腺癌上皮细胞系MCF-7/S和乳腺癌阿霉素耐药细胞株MCF-7/ADR购买于中国科学院典型培养物保藏委员会细胞库(上海,中国),上述细胞株复苏后分别置于含10% 胎牛血清(Hyclone,美国)和10%青霉素-链霉素(Gibco,澳洲)的RPMI-1640 (Gibco,澳洲)培养皿中,置于37℃、5%CO2培养箱中培养,待培养皿中的细胞覆盖率达到80%-90%时,用0.25%胰酶消化细胞,按1∶3的量进行细胞传代,将细胞分别接种于6孔板(3×105个/孔)内,取处于对数生长期的细胞用于后续实验。
1.2 外泌体提取
取对数生长期的MCF-7/S细胞株和MCF-7/ADR细胞株(4×105个/孔),在无血清的RPMI-1640 培养基中过夜培养,24h后当细胞融合率达到80%-90%时收集上清,4℃ 2 000g离心20min除去细胞碎片,收集离心后的上清4℃ 10 000g高速离心1h后,用不含血清RPMI-1640 培养基悬浮沉淀,再重复之前的高速离心步骤一次[8],弃上清,沉淀即为外泌体,于-80℃保存待用。
1.3 外泌体鉴定
1.3.1透射电镜(TEM)鉴定外泌体形态:网格内滴加30μl外泌体,静置1min后,用滤纸从侧面吸干液体,滴加30μl磷钨酸溶液(pH=6.8),室温复染5min,白炽灯烤干,透射电镜(JEM-1200EX,日本)下拍照。
1.3.2动态光散射法检测外泌体直径:将外泌体样品用0.15M NaCl稀释至适当的光学信号检测水平(比例为1∶50),混匀后采用Zetasizer Nano-ZS90(Malvern,英国)仪进行检测,激发光波长λ=532nm。
1.3.3流式细胞仪检测外泌体表面标志物CD63含量:在提取的外泌体中,加入1ml PBS(含1% BSA)重悬,室温孵育30min封闭非特异性抗原,1000g离心5min,弃上清,再以200μl/EP管PBS轻轻重悬外泌体,每组分别加入CD63-PE抗体(Thermo Fisher,美国),室温孵育30min,1 000g离心5min,弃上清,然后用含有1% BSA的PBS重悬外泌体,以未加抗体的EP管作为空白对照,以加入PE标记的抗人IgG(Thermo Fisher,美国)EP管作为同型对照,采用Guava easyCyteTM system流式细胞仪(Merck millipore,德国)检测外泌体表面标志物CD63的含量。
1.4 外泌体RNA提取
按照exoRNeasy Serum/Plasma Maxi Kit(QIAGEN, 德国)试剂盒说明书操作步骤提取外泌体总RNA,用于后续文库制备。
1.5 文库制备与测序
按照QIAseq®miRNA Library Kit(QIAGEN, 德国)试剂盒说明书操作步骤制备小RNA测序文库,文库质检采用Bioptic Qsep100 Analyzer(BIOptic,台湾)检测片段分布,插入片段复合小RNA长度、峰型单一、无杂峰、无接头和无引物二聚体,为合格文库的标准。采用NextSeq CN500测序仪(illumina,美国)进行测序。
1.6 数据分析
1.6.1质控:采用Trimmomatic软件对原始数据进行质量预处理,去掉接头序列和低质量碱基,再用FastQC软件对预处理后的原始数据进行整体评估,包括测序序列长度分布、碱基质量值分布、GC含量分布等。
1.6.2比对与定量:采用BWA软件将预处理后的原始数据与各大数据库比对,首先比对到miRBase数据库(http://www.mirbase.org/),未比对上miRBase数据库的序列分为两部分,一部分是24-33bp序列,另一部分是12-23bp和34-43bp的序列。将24-33bp的序列比对到piRNAcluster数据库(https://labworm.com/tool/pirna-cluster-database),将12-23bp和34-43bp的序列与rRNA比对,过滤rRNA,进而与tRFdb数据库(http://genome.bioch.virginia.edu/trfdb/)比对获得tsRNA。获得各类型小RNA的测序序列长度分布以及碱基偏好性分布,统计各类型small RNA的表达量,采用TPM(以标准化的TPM值来表示small RNA的表达量)对原始表达量进行定量分析。
1.6.3差异表达:采用DEGseq R软件包分析各small RNA差异表达,筛选标准为:log2FC>1,FDR<0.05。
2 结 果
2.1 外泌体鉴定结果
透射电镜下外泌体呈形态基本一致的圆形或者椭圆形膜性囊泡样(图1),动态光散射检测外泌体颗粒直径在30nm-120nm不等(图2),流式细胞仪检测外泌体表面标志物CD63(0.31±0.04mg/ml )显著高表达(P<0.05)(图3)。
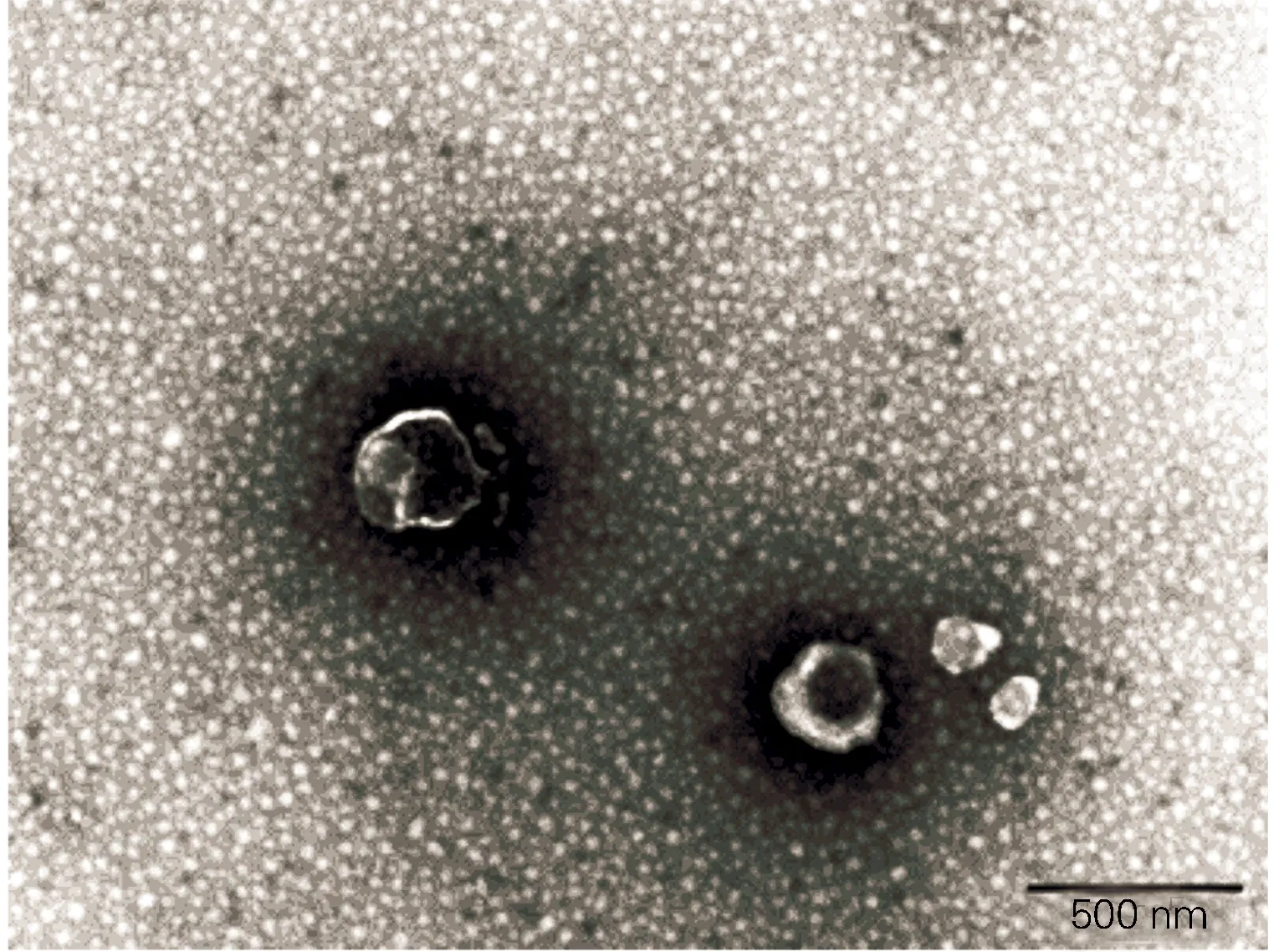
图1 透射电镜鉴定外泌体(20 000×)
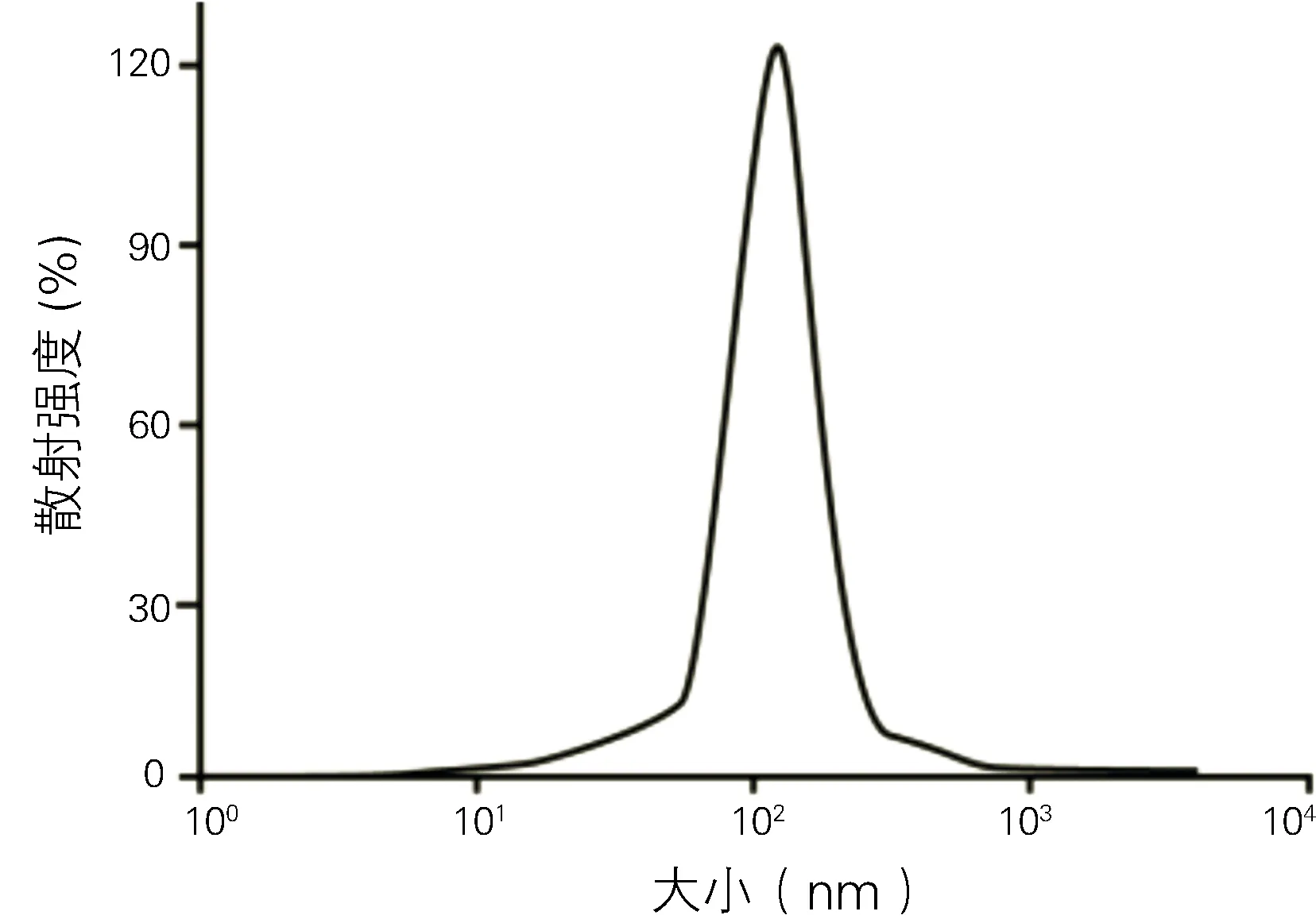
图2 动态光散射检测外泌体直径
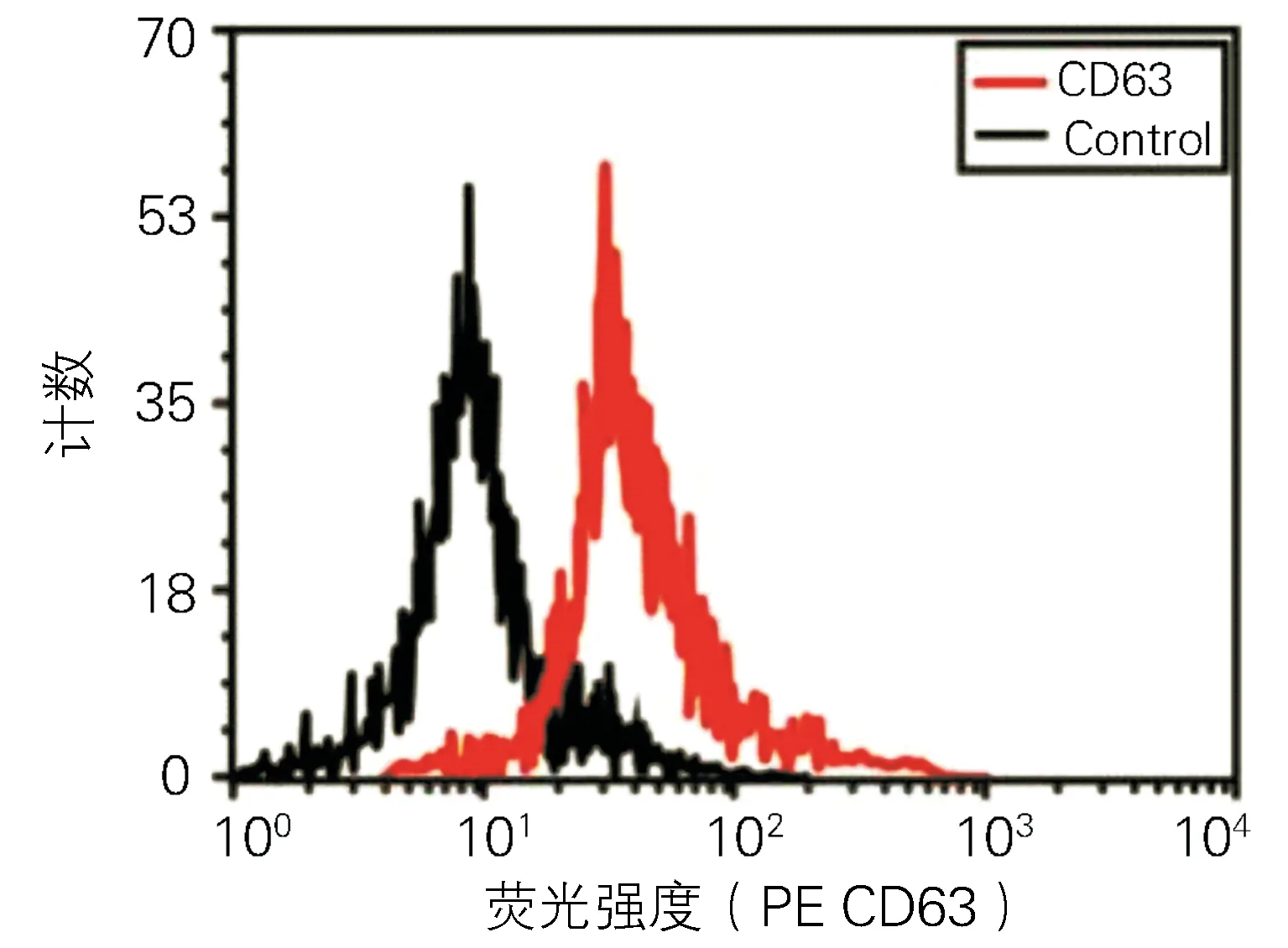
图3 流式细胞术检测外泌体表面标志物CD63含量
2.2 miRNAs在MCF-7/ADR外泌体和MCF-7外泌体中的比较
结果显示,MCF-7/Adr外泌体中miRNAs TPM均值较MCF-7外泌体中miRNAs TPM均值高(26.251 vs 3.292,P<0.05),相对MCF-7外泌体,MCF-7/ADR外泌体中表达上调的miRNAs有960种,分别为:miR-590-3p、miR-574-5p、miR-24-3p、miR-3911、miR-4653-3p、miR-6753-3p、miR-483-3p、miR-let-7b-5p、miR-7704、miR-6799-5p、miR-6891-3p、miR-1301-3p、miR-1249-3p、miR-7851-3p、miR-128-3p、miR-1307-5p、miR-6851-3p、miR-7113-3p、miR-1912-5p、miR-8088、miR-4667-3p、miR-8077、miR-4512、miR-183-5p、miR-1224-3p、miR-6088、miR-4687-5p、miR-718、miR-3182、miR-3184-5p、miR-6873-3p、miR-1909-3p、miR-1183、miR-5187-5p、miR-376c-5p、miR-6769a-3p、miR-7113-5p、miR-4743-3p、miR-5195-3p、miR-148a-5p、miR-10226、miR-497-3p、miR-708-5p、miR-7110-3p、miR-3160-3p、miR-708-3p、miR-6736-3p、miR-4740-5p、miR-6877-5p、miR-3646、miR-6748-5p、miR-668-3p、miR-5684、miR-576-3p、miR-6814-5p、miR-7515、miR-1236-5p、miR-6877-3p、miR-5003-3p、miR-4635、miR-4692、miR-6134、miR-378a-5p、miR-365b-3p、miR-4269、miR-3661、miR-6846-3p、miR-1538、miR-6890-5p、miR-638、miR-let-7i-3p、miR-3934-5p、miR-1273h-3p、miR-196a-5p、miR-4739、miR-611、miR-6076、miR-5006-3p、miR-421、miR-3160-5p、miR-3665、miR-2115-5p、miR-3940-5p、miR-6734-3p、miR-let-7e-3p、miR-143-5p、miR-6763-3p、miR-6780a-3p、miR-339-5p、miR-769-5p、miR-6892-3、miR-4800-5p、miR-3679-5p、miR-9851-5p、miR-4647、miR-6860、miR-1273h-5p、miR-181b-5p、miR-6512-5p、miR-193b-3p、miR-6832-3p、miR-146b-5p、miR-1226-5p、miR-3085-5p、miR-6886-3p、miR-541-5p、miR-4722-3p、miR-4783-5p、miR-3198、miR-6884-5p、miR-328-3p、miR-3605-3p、miR-6836-3p、miR-6817-5p、miR-4791、miR-2276-5p、miR-595、miR-6809-3p、miR-4737、miR-6805-3p、miR-3939、miR-185-3p、miR-877-3p、miR-1285-3p、miR-3196、miR-320b、miR-6867-5p、miR-320a-5p、miR-378d、miR-99b-3p、miR-4513、miR-1249-5p、miR-4644、miR-5689、miR-1229-5p、miR-4732-5p、miR-3680-5p、miR-711、miR-6834-5p、miR-190b-5p、miR-let-7e-5p、miR-125a-3p、miR-10398-3p、miR-622、miR-5585-5p、miR-7-5p、miR-3135a、miR-629-5p、miR-6724-5p、miR-95-3p、miR-338-3p、miR-7155-5p、miR-7108-5p、miR-320d、miR-185-5p、miR-6802-5p、miR-6789-5p、miR-1285-5p、miR-6727-5p、miR-500a-3p、miR-5585-3p、miR-92b-5p、miR-19b-3p、miR-675-5p、miR-762、miR-6797-3p、miR-483-5p、miR-1910-3p、miR-3529-3p、miR-320c、miR-6766-3p、miR-4640-5p、miR-1281、miR-942-5p、miR-619-5p、miR-6775-5p、miR-3168、miR-4516、miR-3195、miR-205-5p、miR-324-5p、miR-6789-3p、miR-492、miR-4430、miR-1273c、miR-2278、miR-8052、miR-615-3p、miR-12118、miR-210-3p、miR-4511、miR-423-5p、miR-1915-3p、miR-296-5p、miR-1304-3p、miR-106b-3p、miR-4508、miR-181c-5p、miR-4787-3p、miR-296-3p、miR-4674、miR-3184-3p、miR-4472、miR-9899、miR-let-7d-5p、miR-6510-5p、miR-1303、miR-6821-5p、miR-3135b、miR-671-5p、miR-4763-3p、miR-6717-5p、miR-6743-5p、miR-27a-5p、miR-181a-5p、miR-10401-5p、miR-1247-5p、miR-6090、miR-3929、miR-4700-5p、miR-5100、miR-320a-3p;表达下调的miRNAs有29种,分别为:miR-663b、miR-11399、miR-4523、miR-10396b-5p、miR-10401-3p、miR-3162-5p、miR-10396a-5p、miR-3648、miR-4706、miR-935、 miR-1470、 miR-4449、miR-664b-5p、miR-375-3p、miR-25-5p、miR-212-5p、miR-141-3p、miR-10396b-3p、miR-200c-3p、miR-4750-5p、miR-6743-3p、miR-12136、miR-125a-5p、miR-5787、miR-606、miR-887-3p、miR-4787-5p、miR-200a-3p、miR-10395-3p。
2.3 piRNAs在MCF-7/ADR外泌体和MCF-7外泌体中的比较
结果显示,MCF-7/ADR外泌体中piRNAs TPM均值较MCF-7外泌体中piRNAs TPM均值高(2 257.60 vs 587.56,P<0.05),相对MCF-7外泌体,MCF-7/ADR外泌体中表达上调的piRNAs有44种,分别为:pir-33470@tRNA、pir-41892@piRNAcluster、pir-52324@piRNAcluster、pir-58790@piRNAcluster、pir-52368@piRNAcluster、pir-50968@piRNAcluster、pir-35729@piRNAcluster、pir-53295@piRNAcluster、pir-36251@tRNA、pir-31199@piRNAcluster、pir-36248@tRNA、pir-31109@piRNAcluster、pir-36038@piRNAcluster、pir-35468@tRNA、pir-36254@tRNA、pir-36242@tRNA、pir-39538@piRNAcluster、pir-36378@tRNA、pir-36249@tRNA、pir-50603@piRNAcluster、pir-31368@tRNA、pir-35467@tRNA、pir-31038@rRNA、pir-60146@piRNAcluster、pir-34093@piRNAcluster、pir-46079@piRNAcluster、pir-35304@piRNAcluster、pir-35463@tRNA、pir-36041@piRNAcluster、pir-36253@tRNA、pir-39980@piRNAcluster、pir-36247@tRNA、pir-41405@piRNAcluster、pir-34442@piRNAcluster、pir-36039@piRNAcluster、pir-31141@piRNAcluster、pir-36245@tRNA、pir-34896@piRNAcluster、pir-36318@tRNA、pir-44984@piRNAcluster、pir-36255@tRNA、pir-36243@tRNA、pir-55891@piRNAcluster、pir-36074@tRNA;表达下调的piRNAs有60种,分别为:pir-33519@tRNA、pir-33160@rRNA、pir-43997@tRNA、pir-33082@rRNA、pir-43996@tRNA、pir-43995@tRNA、pir-43994@tRNA、pir-43993@tRNA、pir-30924@rRNA、pir-60577@tRNA、pir-33387@piRNAcluster、pir-43770@piRNAcluster、pir-36743@tRNA、pir-56450@rRNA、pir-60576@tRNA、pir-43604@tRNA、pir-33164@tRNA、pir-33081@tRNA、pir-33486@tRNA、pir-34358@tRNA、pir-36742@tRNA、pir-44610@piRNAcluster、pir-34822@piRNAcluster、pir-43604@piRNAcluster、pir-35413@piRNAcluster、pir-33520@tRNA、pir-43772@piRNAcluster、pir-41209@rRNA、pir-35410@piRNAcluster、pir-33226@piRNAcluster、pir-36173@tRNA、pir-32512@piRNAcluster、pir-35952@piRNAcluster、pir-33466@piRNAcluster、pir-33065@piRNAcluster、pir-33270@piRNAcluster、pir-34604@rRNA、pir-60565@piRNAcluster、pir-43771@piRNAcluster、pir-35411@piRNAcluster、pir-31104@piRNAcluster、pir-31103@piRNAcluster、pir-35412@piRNAcluster、pir-44312@tRNA、pir-35284@tRNA、pir-36441@tRNA、pir-33468@piRNAcluster、pir-50725@piRNAcluster、pir-31142@piRNAcluster、pir-31925@tRNA、pir-61646@tRNA、pir-35414@piRNAcluster、pir-36256@tRNA、pir-34810@rRNA、pir-33161@piRNAcluster、pir-61647@tRNA、pir-61648@tRNA、pir-57942@tRNA、pir-61645@tRNA、pir-36258@tRNA(@tRNA为tRNA派生的piRNA,@rRNA为rRNA派生的piRNA,@piRNAcluster为已报道的piRNA)。
2.4 tsRNAs在MCF-7/ADR外泌体和MCF-7外泌体中的比较
结果显示,MCF-7/ADR外泌体中tsRNAs TPM均值较MCF-7外泌体中tsRNAs TPM均值高(2 815.36 vs 1 669.43,P<0.05),相对MCF-7外泌体,MCF-7/ADR外泌体中表达上调的tsRNAs有93种,分别为:tsrna-5028a-gluttc、tsrna-5020b-valtac、tsrna-3004b/3005b-glnttg、tsrna-3014a-seraga/sertga、tsrna-5017c-alaagc/alacgc、tsrna-5017b-alaagc/alacgc/alatgc/cysgca/valaac、tsrna-5028b-gluttc、tsrna-3017a-valtac、tsrna-3017b-valtac、tsrna-3014b-seraga/sertga、tsrna-3028b-glygcc、tsrna-3033a-asngtt、tsrna-3005a-glnttg、tsrna-5005b-lysttt、tsrna-3031a-tyrgta、tsrna-1039-argcct、tsrna-3022b-ileaat、tsrna-3020a-alaagc/alatgc、tsrna-5032a-aspgtc、tsrna-1006-argacg、tsrna-5028c-gluttc、tsrna-3021a-alacgc/alatgc、tsrna-5021a-glnctg、tsrna-3030b-tyrgta、tsrna-1035-thrcgt、tsrna-1005-sergct、tsrna-5007c-glyccc、tsrna-3003b-cysgca、tsrna-5016a-alaagc/tyrgta/cysgca、tsrna-3026b-glytcc、tsrna-3008a-valaac/valcac、tsrna-3023a-phegaa、tsrna-5001b-tyrgta、tsrna-1029-alatgc、tsrna-3028a-glygcc、tsrna-3027a-glyccc/glygcc、tsrna-3023b-phegaa、tsrna-3008b-valaac/valcac、tsrna-3030a-tyrgta、tsrna-5032b-aspgtc、tsrna-3012a-leucaa/leucag、tsrna-3012b-leucaa/leucag、tsrna-3022a-ileaat、tsrna-5010a-ileaat/ilegat/seract、tsrna-3018b-metcat、tsrna-5007a-glyccc、tsrna-5017a-alaagc/alacgc/alatgc/cysgca/valaac、tsrna-3004a-glnctg、tsrna-5022b-seraga/sertga、tsrna-3027b-glygcc、tsrna-5015a-alaagc/cysgca/tyrgta、tsrna-5008b-glytcc、tsrna-3018a-metcat、tsrna-5013c-proagg/protgg/procgg、tsrna-5005c-lysctt、tsrna-1025-ileaat、tsrna-1001-sertga、tsrna-5030b-gluctc、tsrna-5005b-lysctt、tsrna-5008c-glytcc、tsrna-3031b-tyrgta、tsrna-5005c-lysttt、tsrna-3011b-leucag、tsrna-5021b-glnctg、tsrna-5003b-glygcc、tsrna-5023b-leucag、tsrna-5020c-valtac、tsrna-5026a-valaac/valcac、tsrna-3021b-alacgc/alatgc、tsrna-3020b-alatgc、tsrna-5022a-seraga/sertga、tsrna-3015a-gluttc、tsrna-5023a-leucaa/leucag、tsrna-3016a-lysctt、tsrna-5004b-glygcc/glyccc、tsrna-5026c-valaac、tsrna-5030c-gluctc、tsrna-5019b-leuaag/leutag、tsrna-5026b-valaac、tsrna-3006b-lysttt、tsrna-3029a-gluctc/gluttc/phegaa、tsrna-5027b-valaac/valcac、tsrna-3016b-lysctt、tsrna-5019a-leuaag/leutag、tsrna-3006a-lysttt、tsrna-5005a-lysctt、tsrna-3015b-gluttc、tsrna-5016c-cysgca、tsrna-5009b-valcac、tsrna-5014a-argacg、tsrna-3002b-proagg/protgg/procgg、tsrna-3019b-alaagc、tsrna-5032c-aspgtc;表达下调的tsRNAs有3种,分别为:tsrna-5027c-valaac/valcac、tsrna-5004c-glygcc/glyccc、tsrna-5009c-valcac。
3 讨 论
Small RNA包括miRNA、tsRNA、piRNA、siRNA等。miRNA为基因表达转录后调控因子,属于非编码RNA,结合其靶mRNA的非翻译区导致mRNA翻译过程被抑制[9],它在肿瘤发生发展、侵袭转移、耐药等方面起至关重要的调节作用[10];piRNA是一类长度为24-31nt单链的小RNA,大部分集中在29-30nt,与PIWI蛋白家族成员相结合才能发挥调控作用,在细胞增殖、肿瘤的发生发展、干细胞分化等过程中起着重要作用[11];tsRNA是近年来发现的、存在于多种生物体内的一类非编码小RNA,来源于成熟tRNA或tRNA前体,其表达和修饰具有组织和细胞特异性,tsRNA参与应激反应、蛋白质翻译调控、核糖体生物合成、肿瘤发生、细胞增殖与凋亡、表观遗传信息的跨代传递等多种生理和病理过程[12]。Small RNA与许多疾病和肿瘤密切相关[13-15],在乳腺癌的发生发展、肿瘤转移、肿瘤耐药等方面奕发挥重要作用[16-18]。
越来越多的基础和临床研究表明,外泌体与肿瘤的发生、发展和转移有关[19,20],其能够调控免疫功能,促进肿瘤血管新生和侵袭转移,甚至直接作用于其它肿瘤或非肿瘤细胞,从而影响细胞或组织的命运[21]。外泌体可携带多种类型的small RNA参与不同肿瘤的发生发展,侵袭转移[22-24],在肿瘤耐药方面亦发挥重要作用,如外泌体miR-744可通过调控PAX2,促进肝癌细胞HepG2的增殖,并抑制HepG2细胞对索拉非尼的化学敏感性[25]。外泌体携带small RNA在乳腺癌的发生发展中的研究,主要集中在miRNA[26]和siRNA[27],而在乳腺癌耐药性方面的研究主要集中在miRNA,如Mao等[28]研究外泌体可通过传递miRNA降低乳腺癌细胞对阿霉素的敏感性,Chen等[29]研究外泌体亦可通过传递miRNA降低乳腺癌细胞对多西紫杉醇的敏感性,但外泌体携带piRNA和tsRNA影响乳腺癌耐药性的研究少见报道,因此,本文对乳腺癌耐药细胞株外泌体中多种类型的small RNA进行了测序检测,除了获得了960种表达上调和29种表达下调的miRNA外,还获得了44种表达上调和60种表达下调的piRNA以及93种表达上调和3种表达下调的tsRNA,为外泌体携带small RNA影响乳腺癌耐药性方面的研究提供实验基础。在乳腺癌耐药机制研究中,有研究报道,外泌体可携带miRNA通过MAPK,TGF-β,Wnt,mTOR和PI3K/Akt等多种信号通路,参与乳腺癌的耐药性[30,31]。而根据本文测序得到的实验数据,结合生信分析方法,并通过分子生物学实验证实,可获得外泌体携带small RNA通过其他未知通路在乳腺癌耐药中的作用,因此,本文的测序结果还可为泌体携带small RNA在乳腺癌耐药中的分子机制研究提供依据。
然而,siRNA由双链RNA(Double Strand RNA,dsRNA) 在细胞内被RNase III (如Dicer) 切割成21-25bp大小的双链RNA,因siRNA可以是外源的,如病毒RNA复制中间体所形成或由人工导入;也可以是内源的,如细胞中单链RNA在RNA依赖的RNA聚合酶的作用下所形成,用常规测序方法难以区分,因此,在本研究中并未测序检测。
综上所述,本研究测序检测了乳腺癌耐药株外泌体中small RNA表达差异,为外泌体携带small RNA在乳腺癌耐药中的机制研究提供依据。

