基于水溶性硅量子点的氯化血红素荧光检测新方法
李文静, 许惠凤, 詹 妍, 胡燕霞, 朱 希*, 杨桂娣
(1.福建农林大学生命科学学院,福建福州 350002;2.福建省中西医结合老年性疾病重点实验室,福建中医药大学中西医结合研究院,福建福州 350002)
血红素(Hemin)是一种由卟啉和Fe(Ⅱ)结合形成的铁卟啉类化合物,存在于高等动物的血液和肌肉中,在氧气转运过程中起到关键作用[1]。在药学领域,血红素除了能够作为制备抗癌和半合成胆红素药物的原料,还在抗疟疾中起着重要作用[2]。然而,过量的血红素能嵌入脂膜,催化生成 ·OH,破坏细胞膜,从而造成细胞溶解和死亡[3,4]。因此,血红素的定量检测对于医药卫生、食品工业、环境科学、生物科学等领域具有非常重要的意义。
血红素的常用检测方法有电泳法[5]、高效液相色谱法[6]和火焰原子吸收法[7]等方法。这些方法需要昂贵的仪器,专业培训的实验人员,以及复杂的日常维护过程,很大程度上限制了在血红素检测中的应用。血红素在波长400 nm附近具有较强的吸收峰,可采用简便且低成本的分光光度法对其进行直接检测[8],然而该方法因抗干扰能力相对较差,且灵敏度较低,在复杂样品的检测应用受到一定限制。荧光分析法具有操作简单、灵敏度高和选择性好等特点,这些优点极大拓展了它在分析领域的应用。Guan等人[9]利用肝素和巯基丙酸修饰的硫化镉量子点作为荧光探针,实现对血红素的免标记荧光检测。Kang等人[10]提出了一种基于原卟啉Ⅸ与G -四联体体系的荧光方法对血红素进行检测。但这些方法或用到了具有一定毒性的硫化镉量子点,或需要繁杂的实验过程。因此,设计一种安全无毒,简便、稳定、灵敏度高、可靠的新方法用于检测血红素势在必行。
硅量子点(SiQDs)是一种零维纳米材料。与Ⅱ-Ⅵ族、Ⅲ-Ⅴ族的半导体量子点相比,SiQDs不仅有着优异的光学性能,还具备环境友好、低合成成本、无细胞毒性和高生物相容性等优点[11,12]。为了得到水溶性较好的SiQDs,研究者通常需要采用两步法进行制备:首先,通过“top-down”的过程得到疏水性SiQDs,然后再通过表面功能化的过程得到水溶性SiQDs。尽管这种方法能得到水溶性较好的SiQDs,但它需要繁琐的操作过程。近年来,研究人员以3-氨基丙基-三甲氧基硅烷(APTMS)等作为硅源[13],在还原剂存在下,采用水热合成方法合成了具有高亲水性的水溶性SiQDs。这些水溶性SiQDs在金属离子和生物小分子检测领域有着巨大应用前景[14-18]。本研究以APTMS为硅源,柠檬酸三钠为还原剂,采用水热法合成了水溶性良好和高荧光活性的水溶性SiQDs。利用血红素与SiQDs间的内滤作用,构建一种简便快速的荧光方法实现对血红素的检测。本方法与现有的检测手段相比具有简便快速、选择性好、灵敏度高等优点。
1 实验部分
1.1 仪器与试剂
Cary Eclipse荧光分光光度计(美国,瓦里安公司);UV1750紫外-可见分光光度计(北京普析通用仪器有限责任公司);FEI Tecnai G2 F20透射电子显微镜(美国,FEI公司);F4500稳定/瞬间荧光光谱仪(英国,爱丁堡公司);KQ300DE数控超声波清洗器(昆山市超声仪器有限公司);pHS-3C pH计(上海越平科学仪器有限公司)。实验所需光学测量均在室内环境温度条件下操作。实验所需荧光测量均在统一的石英比色皿中操作。
3-氨丙基-三甲氧基硅烷(APTMS)购自Sigma公司;柠檬酸三钠、氯化血红素、甲硫氨酸、半胱氨酸、组氨酸、酪氨酸、葡萄糖、NaOH、Na2HPO4、NaH2PO4,均购于国药集团化学试剂有限公司。实验所需用水均为Millipore Milli-Q系统净化的超纯水。
1.2 实验方法
1.2.1 水溶性SiQDs的合成参照文献方法[12]并进行适当修改,具体步骤如下:准确称取1.1038 g柠檬酸三钠,吸取5 mL APTMS,将上述两种试剂加入10 mL 水中搅拌混匀,并将所得溶液转移至聚四氟乙烯反应釜中,于160 ℃下反应2 h。再将反应得到的均匀透明的溶液转移至透析袋(1 kDa)中透析48 h,除去杂质。最后把溶液收集存储于4 ℃冰箱中作为储备溶液。另取1 mL溶液冻干后称重,计算出SiQDs母液的浓度为3 mg/mL。使用硫酸奎宁(QY=54%)作为参比标准品,在0.5 mol/L的H2SO4中测得该SiQDs 的量子产率为28.7%。
1.2.2 光谱测试实验过程中,紫外吸收曲线通过紫外-可见分光光度计检测。荧光光谱图通过荧光光度计扫描得到,荧光的激发波长为350 nm,发射波长范围为380~600 nm。
1.2.3 血红素对SiQDs的荧光响应取4 μL上述SiQDs母液,加入290 μL 0.1 mol/L的磷酸盐缓冲溶液(PBS,pH=7.0),得到最终浓度为0.04 mg/mL的SiQDs溶液。移取6 μL不同浓度的血红素溶液,分别加入到上述SiQDs溶液中,静置5 min后进行荧光测定。
1.2.4 干扰实验6 μL 1 mmol/L的血红素和6 μL 10 mmol/L的干扰物质(组氨酸、酪氨酸、半胱氨酸、甲硫氨酸、葡萄糖),分别加入到“1.2.3”所制备的SiQDs溶液中,静置5 min后进行荧光测定。
2 结果与讨论
2.1 SiQDs的合成及表征
实验首先对所合成的SiQDs进行透射电镜(TEM)及荧光光谱表征。从图1(A)中看出,SiQDs表现为规整的类球形,且分布均匀,平均粒径2.0 nm。从荧光光谱图(图1(B))可以看出,合成的水溶性SiQDs的最大激发波长和最大发射波长分别在350 nm和441 nm附近。制备的SiQDs在日光下是无色透明的均相溶液,在365 nm的紫外灯下则呈现明亮的蓝色荧光(图1(B)插图)。这些结果与之前文献报道[12]一致,表明本实验成功制备出了水溶性荧光SiQDs。
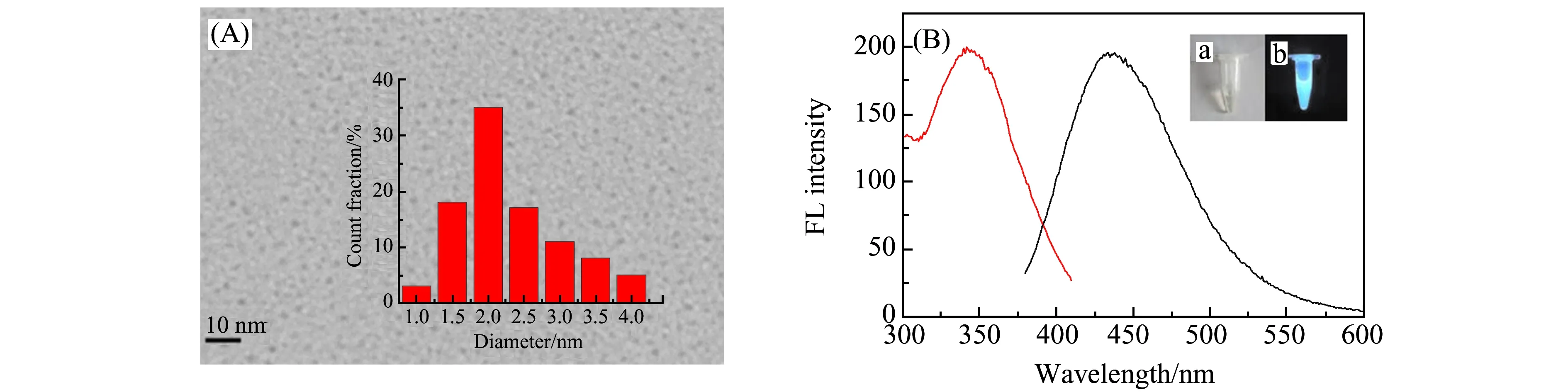
图1 (A) SiQDs的透射电镜(TEM)图;(B) SiQDs荧光光谱图(红色曲线为激发光谱,黑色曲线为发射光谱,插图为SiQDs在日光下(a)和紫外灯下(b)照片)Fig.1 (A) TEM image of SiQDs;(B) Fluorescence spectra of SiQDs(excitation(red) and emission(black) spectrum of SiQDs,inset:the photograph of SiQDs under daylight(a) and UV lamp(b))
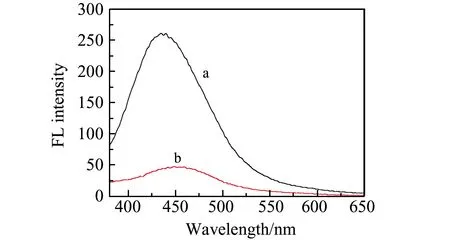
图2 SiQDs加入血红素前(a)后(b)的荧光光谱Fig.2 Fluorescence spectra of SiQDs in the absence (a) and presence (b) of hemin
2.2 血红素对SiQDs的荧光信号影响
图2是加入血红素前后SiQDs的荧光光谱图。从图可以看出,加入血红素后SiQDs的荧光信号明显下降,以空白SiQDs的荧光值作为F0,加入血红素的荧光值作为F,计算血红素对SiQDs的荧光猝灭率为81.7%。另外,加入血红素前后SiQDs的荧光峰的峰形没有变化,最大激发波长出现了稍微的红移,这可能是由于血红素加入后引起SiQDs晶型结构发生变化引起的。
本实验进一步考察了血红素猝灭SiQDs荧光的可能机理。首先,通过荧光寿命实验(图3(A))发现,加入血红素后的SiQDs的荧光寿命与未加入血红素时SiQDs的荧光寿命相比,基本没有变化。另外,通过紫外-可见吸收光谱(图3(B)),可以看出血红素的强吸收范围在波长300~450 nm(曲线a),这与SiQDs的紫外吸收范围(曲线b)重叠,同时也覆盖了SiQDs的最大发射波长。这些结论表明,血红素对SiQDs的荧光抑制主要由于内滤作用所引起。
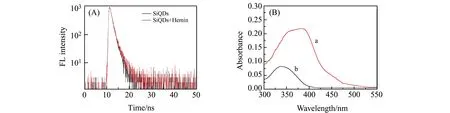
图3 (A) 加入血红素前后SiQDs的荧光寿命对比图;(B) 血红素(a)和SiQDs(b)的紫外-可见吸收光谱图Fig.3 (A) Fluorescence lifetime of SiQDs;(B) UV-Vis absorption spectra of hemin(a) and SiQDs(b)
2.3 实验条件优化
2.3.1 缓冲溶液pH本实验分别选定pH为4.5、5.0、5.5、6.0、6.5、7.4、8.0和9.0来考察SiQDs的荧光信号变化情况。在图4中,SiQDs的荧光信号随着pH的增大先上升而后下降,在pH为7.4的时候达到最大值,并且pH为7.4是人体生理pH值,故选定pH=7.4作为该实验体系的pH值。
2.3.2 血红素与SiQDs反应时间实验考察了不同反应时间下荧光强度的变化情况,结果如图5所示。从图中可以看出,在5 min内反应体系的荧光强度逐渐降低。当反应时间超过5 min,荧光强度几乎不再降低,因此该体系最佳反应时间应为5 min。
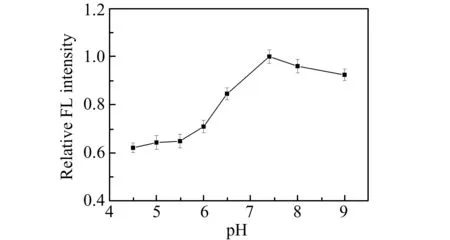
图4 不同pH的PBS中SiQDs的荧光光谱Fig.4 Fluorescence spectra of SiQDs in PBS with different pH
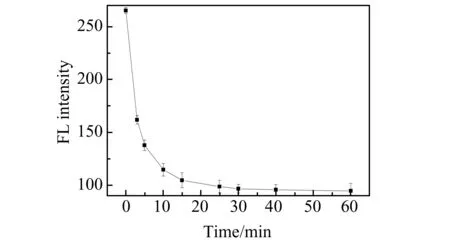
图5 不同时间下血红素对SiQDs的荧光猝灭情况Fig.5 Fluorescence quenching of SiQDs by hemin at different reaction times
2.4 线性范围及检出限
在上述最佳实验条件下,考察了不同浓度血红素对体系荧光强度的影响。如图6(A)所示,体系的荧光强度随血红素浓度的升高逐渐降低,血红素的浓度在2.67~200 μmol/L之间时,荧光强度变化值ΔF(ΔF=F0-F)与血红素浓度的对数呈良好线性关系(图6(B)),线性方程为:ΔF=120.12logc-38.39,相关系数R为0.997,该方法的检出限(S/N=3)达到0.83 μmol/L。
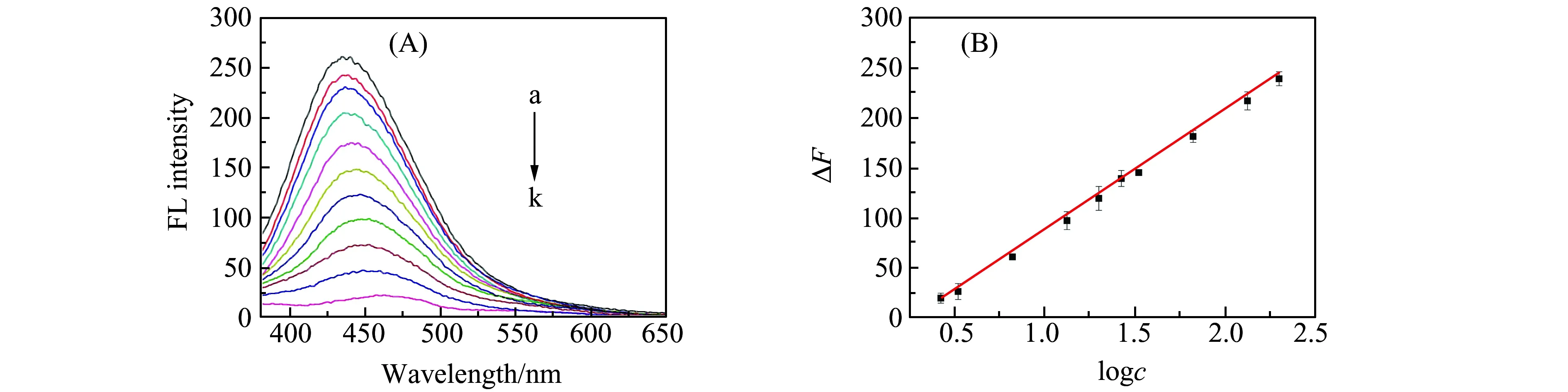
图6 (A)不同血红素浓度下的荧光光谱图;(B)血红素浓度对数与荧光强度变化值ΔF间关系Fig.6 (A) Fluorescence spectra of SiQDs at different hemin concentrations(a-k:The concentrations of hemin are 0.00,2.67,3.33,6.66,13.33,20.00,26.66,33.33,66.66,133.33,200.00 μmol/L,respectively);(B) Linear plot of fluorescence intensity change ΔFvs.logarithm of hemin concentrations
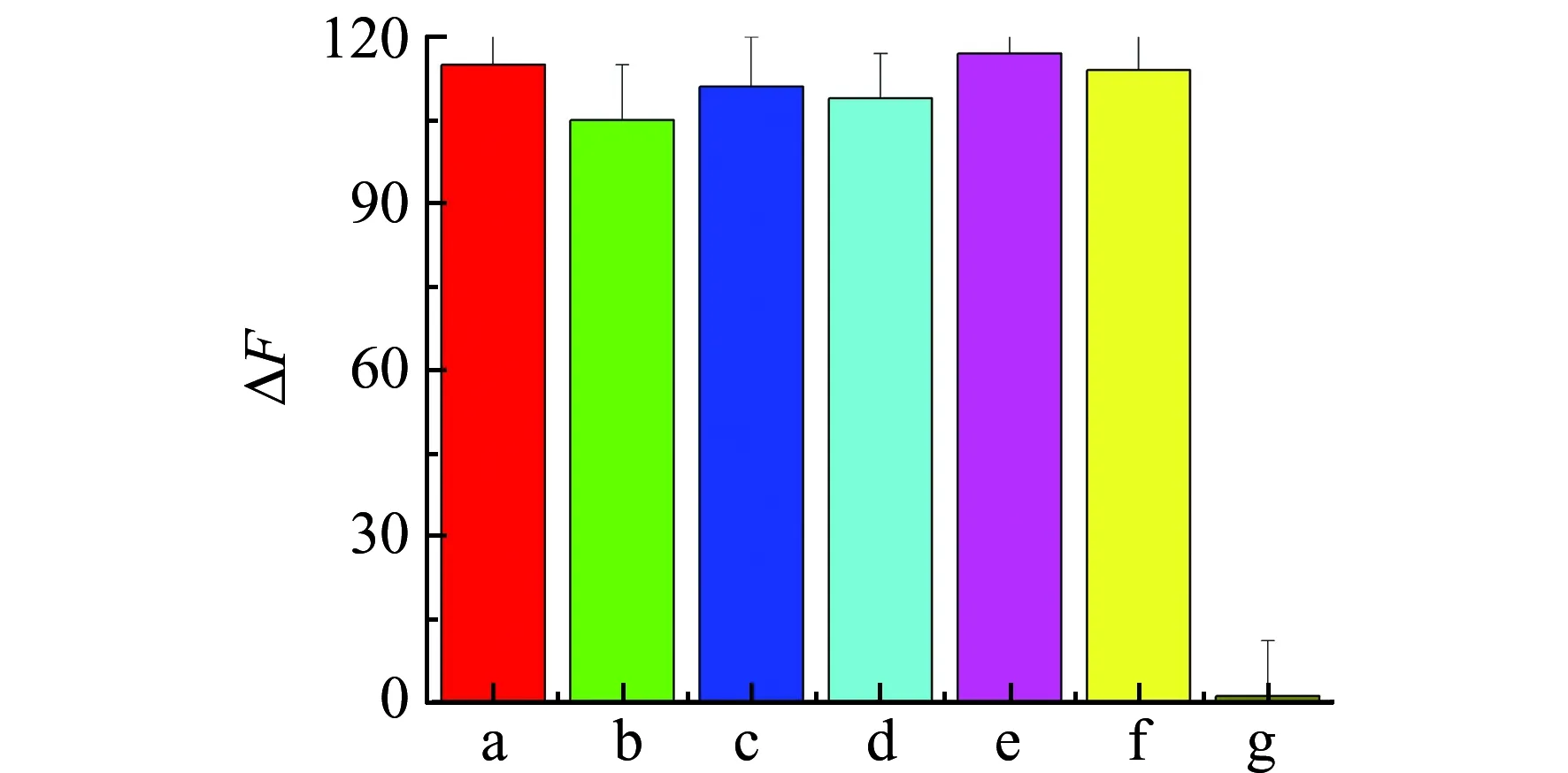
图7 不同物质和SiQDs共存时荧光强度变化图Fig.7 Fluorescence intensity change of SiQDs in the presence of different substances a-g stand for SiQDs,SiQDs+histidine,SiQDs+tyrosine,SiQDs+cysteine,SiQDs+methionine,SiQDs+glucose,and SiQDs+hemin.
2.5 干扰实验
实验以几种可能共存的氨基酸和小分子为干扰物质,考察了它们对体系荧光强度的影响。这些干扰物质的浓度是200 μmol/L,而血红素浓度为20 μmol/L。从图7可以看出,只有血红素存在时,才能引起荧光显著变化,而这些干扰物的存在则不会引起SiQDs荧光信号显著改变,表明这种方法对血红素的检测具有良好的选择性。
2.6 实际血清样品中血红素的检测
为了进一步评估该方法的实用性,实验进一步将稀释的人血清样品用作血红素检测的样品基质,在样品中未检测到血红素。在样品中加入了不同浓度的血红素进行加入回收率实验。表1中的结果表明,检测出的血红素含量与添加值基本一致,回收率在97.8%~103.2%范围内。表明本研究所提出的方法有望用于实际样品中血红素的检测。

表1 血清样本中血红素的检测(n=3)
3 结论
本文通过水热法制备了具有较高荧光强度且环境友好的水溶性SiQDs。基于该水溶性SiQDs与氯化血红素间存在着内滤作用,建立了快速检测氯化血红素的荧光新方法。该方法操作简便,所用试剂安全无毒,检测结果具有高的灵敏度和良好的选择性,在氯化血红素的快速检测方面具有应用潜力。

