错配修复基因在右半结肠癌的表达对病理特征的影响
严万能,马海洁,沈朝敏
(浙江省舟山医院a.普外科,b.细胞分子生物学实验室,浙江 舟山 316000)
结肠直肠癌是一种常见的消化道恶性肿瘤,据2012年WHO统计数据显示其发病率在全球列第3位,死亡率第4位[1]。中国癌症统计数据显示,2015年结肠直肠癌的发病率及死亡率均居全部恶性肿瘤的第5位,死亡病例19.1万,新发病例37.6万,发病率显著上升[2]。因此,寻找预测结肠癌临床病理学特征的生物学标志,从而提高诊治效果、改善预后,意义重要。
1990年,Bufill[3]依据胚胎起源、生理解剖、内环境和分子生物学特征等差异提出,应以结肠脾曲为界将左、右结肠癌分成两种不同的疾病。近年来,关于左、右结肠癌基因表达差异的研究有新的进展。研究发现,错配修复基因(mismatch repair,MMR)是影响结肠直肠癌发病的重要分子标志,维持基因组的稳定性与高保真性,降低基因编码过程中突变的概率[4]。MMR 包括 MLH1、MSH2、MSH3、MSH6、PMS1、PMS2,MLH1和 MSH2是重要的 2个基因。90%以上的MMR缺失都属于MLH1和MSH2的缺失[5-6]。MMR基因表达缺失的机制通常是基因启动子甲基化致表达沉默[7-9]。国外研究发现散发性结肠直肠癌中右半结肠癌出现MMR基因表达缺失的概率是左半结肠癌的10倍[10]。本研究回顾分析206例我院手术治疗的散发性结肠癌 MLH1、MSH2、MSH6和PMS2基因的表达水平。进一步研究左半、右半结肠癌 MLH1、MSH2、MSH6和 PMS2蛋白质表达差异,探讨MMR蛋白质表达缺失对右半结肠癌病理特征的影响及意义。
资料与方法
一、临床资料
2015年1月至2020年8月我院手术治疗且病理资料完整的结肠癌病例共206例。男115例,女91例。中位年龄70(32~92)岁。左半结肠癌116例,右半结肠癌90例。病人特征如下:①行外科根治手术的原发结肠癌;②病理诊断为结肠癌;③术前未行放、化疗或分子靶向治疗。本研究病例无家族性腺瘤型息肉病和遗传性非息肉型结肠直肠癌。
研究指标为手术切除组织病理检查结果:肿瘤分化程度、TNM分期、神经与脉管浸润、淋巴结转移。
二、MLH1、MSH2、MSH6和PMS2蛋白质表达情况
采用免疫组织化学法检测。石蜡包埋结肠癌组织块连续切片,厚度约4 μm。经脱蜡、抗原修复后,采用二步法染色检测MLH1、MSH2、MSH6和PMS2蛋白质表达。一抗来自河南赛诺特生物公司(克隆号为 C12A19、G219-1129、GM024 和 EP51)。阴性对照用PBS磷酸缓冲液替代一抗。二抗采用DAKO EnVisionTM二步法,抗兔、鼠通用型免疫组织化学试剂。将显色后的片子用清水冲洗后,浸泡于苏木素溶液中染色30 s,完成细胞核复染。脱水后,完成封片。
三、免疫组织化学检测结果判定
病理切片中正常肠黏膜、肿瘤间质细胞、炎症细胞为内对照,核阳性着色。以1%为阳性界值,≥1%的肿瘤细胞核阳性着色判定为阳性,<1%判定为阴性(见图1)。MLH1、MSH2、MSH6 和 PMS2 的4个蛋白质中,任意一个染色为阴性即判定为MMR蛋白质表达缺失;4个蛋白质均为阳性判定为MMR蛋白质表达正常。判定过程由2位高年资病理科医师双盲法独立进行。有异议的病例,提交上级医师重新判读。
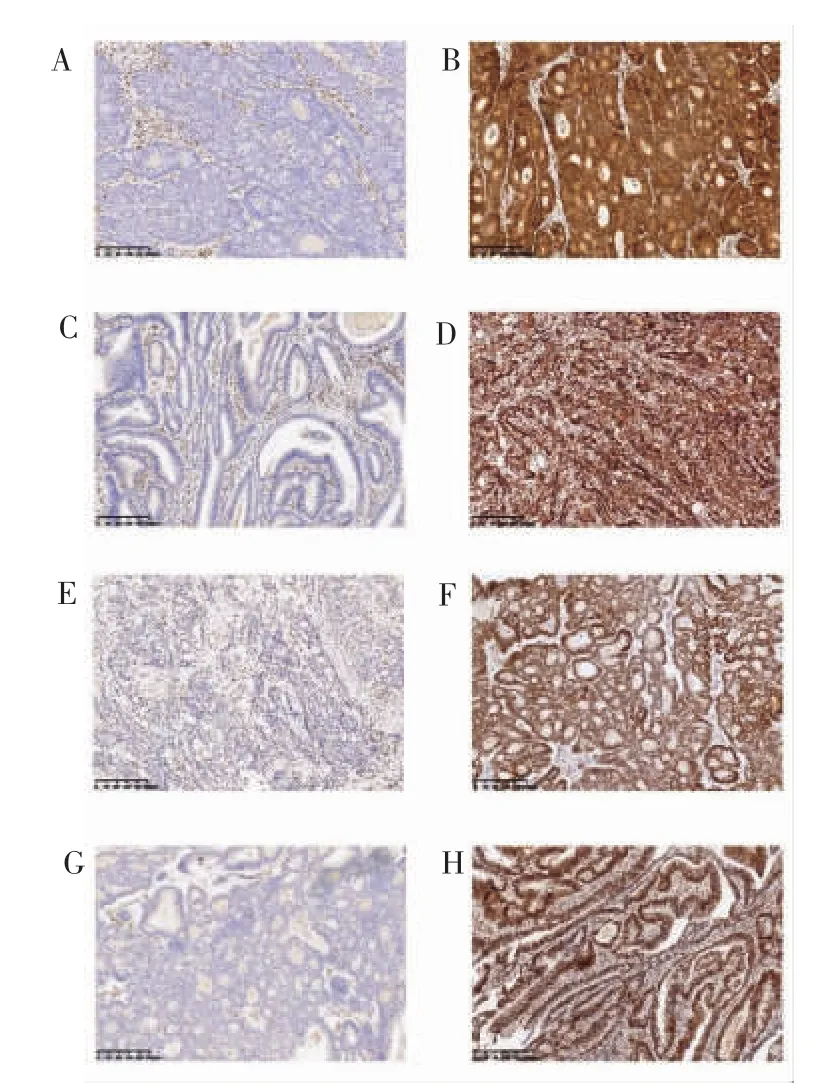
图1 结肠癌组织MLH1、MSH2、MSH6和PMS2免疫组组化学检测阴性与阳性结果
四、统计学分析
采用SPSS 22.0软件进行统计学分析。Pearson卡方检验、连续校正卡方检验和Fisher精确检验分析MMR蛋白质表达与结肠癌病理特征之间的关系。P<0.05为差异有统计学意义。
结 果
一、结肠癌MMR蛋白质表达情况
右半结肠癌MMR蛋白质表达缺失12例(13.33%)。其中 MLH1 缺失 9 例(10.00%),MSH2缺失 3 例(3.33%),MSH6 缺失3例(3.33%),PMS2缺失 9 例(10.00%)。MMR 表达阳性 78 例(86.67%)。左半结肠癌MMR表达缺失9例(7.76%),其中MLH1 缺失 6 例(5.17%),MSH2 缺失者3例(2.59%),MSH6 缺失者3例(2.59%),PMS2 缺失者6 例(5.17%),MMR 表达阳性者 107 例(92.24%)。虽然现有数据分析差异并无统计学意义,但表中结果直观显示右半结肠癌MMR蛋白质缺失率高于左半结肠癌(见表1)。
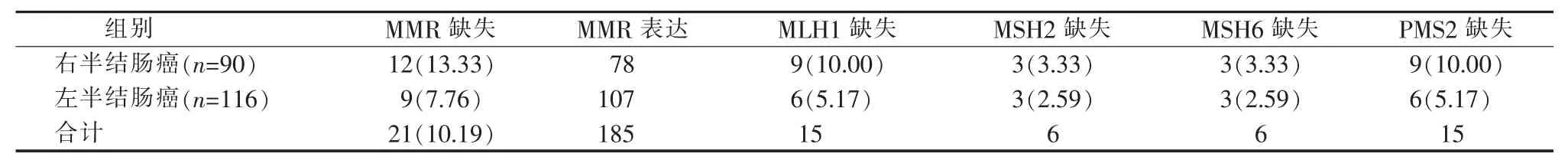
表1 MMR表达情况[n(%)]
二、MMR蛋白质表达与右半结肠癌病理特征的关系
90例右半结肠癌,MLH1、MSH2、MSH6和PMS2蛋白质表达与肿瘤分化程度有关(P<0.05)。58.33%的蛋白质表达缺失病人表现为肿瘤组织病理低分化,该比例明显高于有MMR表达病人的15.38%。5例黏液腺癌病人均有MMR表达。MMR蛋白质表达缺失的12例右半结癌病人无神经浸润,而有蛋白质表达者约28.21%神经浸润(P<0.05)。右半结肠癌MMR蛋白质表达与其他病理特征无相关性(见表2)。

表2 MMR蛋白质表达与右半结肠癌病理特征的关系
讨 论
国内、外研究发现,结肠直肠癌发生是在遗传和环境因素共同作用下,多基因突变积累导致的复杂生物学演变过程。目前结肠直肠癌发生的分子生物学路径主要分3类:微卫星不稳定、染色体不稳定和CpG岛甲基化表型[11-13]。微卫星不稳定路径是Aaltonen等[14]于1993年首次发现,由MMR突变引起的基因突变路径。DNA复制过程中,尤其是微卫星,可能会出现碱基错配等错误,累积并代代相传,最终产生基因突变进而导致细胞癌变。DNA复制过程中产生的一些简单重复序列的插入或缺失,导致微卫星不稳定[15-16]。因此,MMR基因缺失可能是导致结肠直肠癌发生的主要影响因子,又称为“门卫基因”[17-18]。
MMR 基因主要包括 MLH1、MSH2、MSH6 和PMS2。其中MLH1与PMS2蛋白质形成异源二聚体,MSH2与MSH6蛋白质形成异源二聚体,MLH1和MSH2蛋白质是二聚体的主导蛋白质。本研究发现,206例结肠癌病人中,右半结肠癌MMR蛋白质表达缺失率为13.33%,高于左半结肠癌的7.76%。其中MLH1蛋白质缺失率为10.00%,MSH2蛋白缺失率为 3.33%,MSH6 蛋白质缺失率为 3.33%,PMS2蛋白质缺失率为10.00%。本研究MLH1和PMS2的缺失率高于国内文献报道的4%~6%,可能是海岛地区的特殊地域差异所致[19-20]。本研究发现右半结肠癌MMR蛋白质表达缺失更易表现为低分化,但不易出现神经浸润(P<0.05)。
综上所述,MMR 的 MLH1、MSH2、MSH6 和PMS2蛋白质表达缺失好发于右半结肠癌,且具有一定的病理特征。更大样本研究的开展,有助于分析MMR蛋白质表达缺失影响结肠肿瘤分化程度及神经浸润的机制,以及右半结肠癌MMR蛋白质表达缺失的影响。

