减重平板训练对脊髓损伤大鼠神经病理性疼痛及脊髓后角谷氨酸脱羧酶-65/67表达的影响
李向哲,丁洁,王庆华,董传明,王彤,吴勤峰
1.南京医科大学附属苏州科技城医院,江苏苏州市 215153;2.浙江大学医学院附属邵逸夫医院,浙江杭州市 310016;3.南通大学实验动物中心,江苏南通市 226001;4.南通大学医学院,江苏南通市 226001;5.南京医科大学第一附属医院康复医学中心,江苏南京市210029
神经病理性疼痛(neuropathic pain,NPP)是脊髓损伤后常见的并发症之一,可多方面损害患者的身心健康,降低生活质量[1-2]。虽然目前的诊疗技术和治疗手段不断进展,但由于发病机制的复杂性,NPP 的治疗效果仍不尽如人意[3-6]。脊髓损伤后,脊髓内γ-氨基丁酸(γ-aminobutyric acid,GABA)合成减少可能是导致NPP 的主要原因之一[7]。动物实验表明[8-9],坐骨神经损伤后,运动训练可通过增加脊髓后角内GABA 合成酶——谷氨酸脱羧酶-65/67 (glutamate decarboxylase-65/67,GAD65/67)的合成以改善NPP。
本研究观察减重平板训练对脊髓损伤大鼠机械性痛阈和热痛阈的影响,以及远端脊髓内GAD-65/67 的表达,探讨运动训练改善脊髓损伤大鼠NPP 的可能机制。
1 材料与方法
1.1 动物和分组
成年雌性Sprague-Dawley 大鼠24 只,体质量210~230 g,随机分为假手术组(Sham 组)、脊髓损伤-不运动组(SCI-Sed 组)和脊髓损伤-运动组(SCI-Ex 组),每组8 只。所有大鼠均饲养于恒温环境(22±2)℃,湿度50%~60%,自由饮食,自然光照。
本研究经南京医科大学伦理委员会批准通过(No.2019-792)。
1.2 模型制作
采用Allen 法制作T10不完全性脊髓损伤模型[10-11]。损伤装置采用NYU脊椎冲击损伤仪Model I型(美国新泽西州立大学神经科学联合中心实验室提供,打击头直径2.5 mm),损伤剂量为10 g×25 mm。Sham 组仅暴露脊髓。术后膀胱按摩辅助排尿,每天2 次,连续5~7 d,直至形成自主排尿。
1.3 减重平板训练
SCI-Ex 组于脊髓损伤后第8 天进行减重平板训练[10]。每次运动训练前手法按摩膀胱区排空尿液。跑台速度6 m/min,每次训练20 min,每天2 次,每周5 d,共4周。训练时根据大鼠的功能状态,减重范围设为20%~40%,随大鼠后肢运动恢复逐渐减小减重程度。
1.4 疼痛评估
1.4.1机械性痛阈
采用Chaplan 等[12]改良的评估法。室温、安静环境中,先将大鼠放置于透明隔笼中适应15 min。随后将一系列von Frey 细丝(0.4 g、0.6 g、1.0 g、1.4 g、2.0 g、4.0 g、6.0 g、8.0 g 和15.0 g)从2.0 g 力度开始垂直刺激大鼠后肢脚掌中部皮肤,每次刺激持续6~8 s,依大鼠的反应依次进行评估(up-down 法[13]),大鼠出现缩足或舔足反应记为阳性(×),无反应记为阴性(○),每只大鼠评估时间应小于1 min。以von Frey单丝刺激强度小于4 g 时考虑NPP 的存在[14]。评估时间点:脊髓损伤术前,脊髓损伤后7 d、14 d、21 d、28 d和35 d。
1.4.2热痛阈
使用热刺激痛觉测试仪进行热痛阈评估。参照Hargreaves[15]提供的评估方法进行。评估前将大鼠置于树脂玻璃评估笼中适应15 min,每只大鼠评估3次,取缩足反应平均值作为每只大鼠的热痛阈,每次评估间隔10 min,热刺激强度设定为20%,最长刺激时间20 s[16]。评估时间点与机械性痛阈评估相同。
1.5 免疫组化染色
痛阈评估结束后,每组取4 只,10%水合氯醛3 ml/kg深度麻醉大鼠,打开胸腔暴露心脏,使用灌注泵生理盐水250 ml 进行心脏灌注,后使用4%多聚甲醛250 ml 灌注,取出脊髓后,分离L4~L5脊髓节段,放入4%多聚甲醛4 ℃后固定过夜。酒精梯度脱水,石蜡包埋。石蜡切片机连续水平横切,厚5 μm,每隔5 张收1 张,每个样本收取3 张。脱蜡水化、H2O2孵育、微波修复、封闭液封闭后,滴加兔抗GAD65 多克隆抗体(ab203063,1∶200,美国ABCAM 公司)和鼠抗GAD67 单克隆抗体(MAB5406,1∶1000,德国MINIPORE 公司),4 ℃过夜孵育。次日PBS 冲洗后,使用生物素标记的山羊抗兔或山羊抗小鼠二抗在37 ℃恒温箱中孵育1 h,洗片、DAB 显色、封片。摄片后使用Image-Pro Plus 6.0进行光密度分析。
1.6 Western blotting
痛阈评估结束后,每组取4 只,10%水合氯醛3 ml/kg 深度麻醉大鼠,断头处死,离断L4~L5脊髓节段,在液氮中研磨破碎后,加入适量RIPA 裂解液,4 ℃冷库摇床上消化30 min,4 ℃、12 000 r/min 离心15 min,吸取上清液,BCA 法测定蛋白浓度,按照测定浓度加入4×上样缓冲液使得样品浓度相同。沸水中变性10 min,分装后-80 °C 保存备用。12% SDSPAGE 胶,上样蛋白80 μg,20 mA 恒流电泳至目的条带区分开,100 V 恒压转膜80 min。封闭并加入兔抗GAD65 多克隆抗体(ab203063,1∶1000,美国ABCAM 公司)和鼠抗GAD67 单克隆抗体(MAB5406,1∶5000,德国MINIPORE 公司)和鼠抗GAPDH 单克隆抗体(ab181602,1∶5000,美国ABCAM 公司),4 ℃孵育过夜。次日用山羊抗兔或山羊抗小鼠二抗(1∶2000)室温孵育1 h,TBST 洗膜。ECL 法显影,摄片后使用Image J软件进行灰度分析。
1.7 统计学分析
采用SPSS 20.0 软件进行统计学分析。计量资料符合正态分布,以(±s)表示。机械痛阈和热痛阈数据建立一般线性模型,进行重复测量方差分析,后采用Tukey's POST hoc 对3 组大鼠同一时间点数值进行两两比较。免疫组化和Western blotting 数据采用单因素方差分析,若单因素方差分析有统计学差异,再使用POST hoc进行两两分析。显著性水平α=0.05。
2 结果
2.1 痛阈
脊髓损伤后各时间点,三组机械性痛阈和热痛阈的时间、分组和交互效应均显著(P<0.001)。脊髓损伤后各时间点,SCI-Ex 组和SCI-Sed 组机械性痛阈和热痛阈均显著低于Sham 组(P<0.001)。脊髓损伤后21 d、28 d 和35 d,SCI-Ex 组的机械性痛阈和热痛阈均明显高于SCI-Sed 组(P<0.01)。脊髓损伤后7 d 和14 d,SCI-Sed 组和SCI-Ex 组机械性痛阈和热痛阈均无显著性差异(P>0.05)。见表1、表2。
2.2 Western blotting
三组间损伤远端脊髓内GAD-65 和GAD-67 表达量均有非常高度显著性差异(P<0.001)。与Sham 组相比,SCI-Sed组和SCI-Ex组的GAD-65和GAD-67表达量减少(P<0.05)。与SCI-Sed 组比较,SCI-Ex 组GAD-65 和GAD-67 表达量升高(P<0.05)。见 图1、表3。
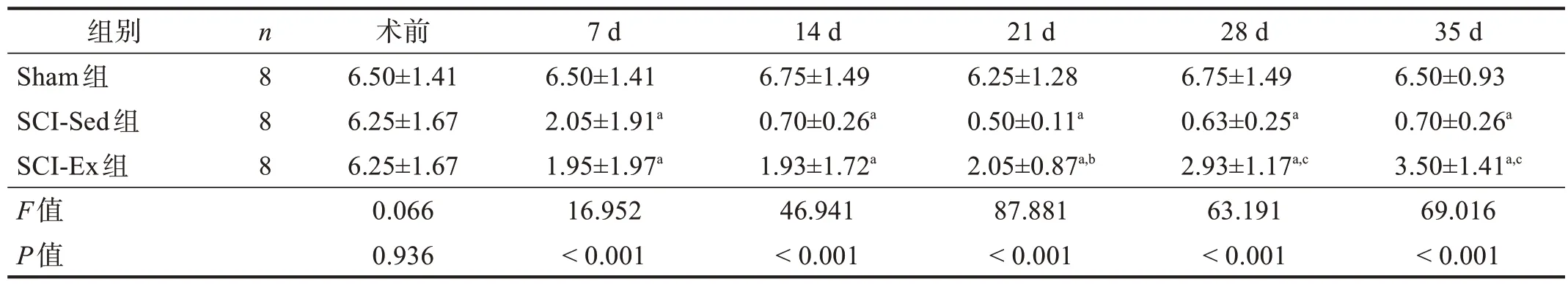
表1 各组von Frey机械性痛阈比较(g)
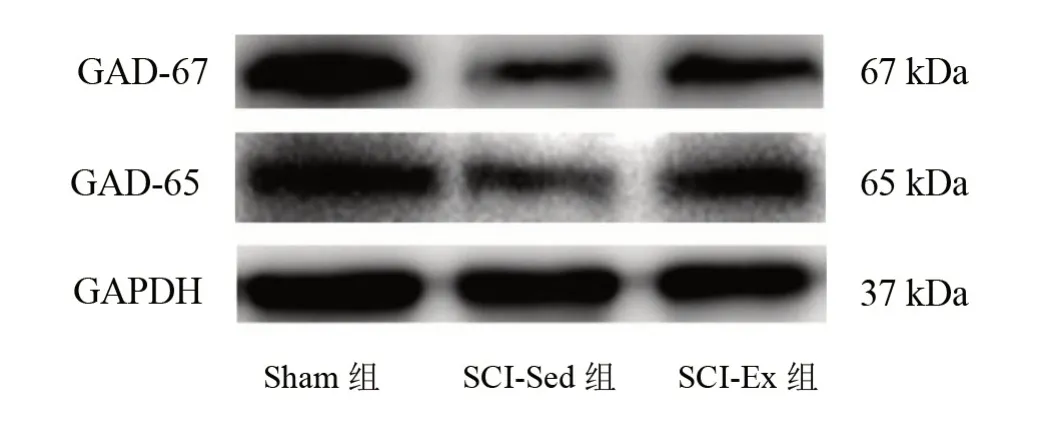
图1 各组GAD65和GAD-67的Western blotting相对表达量
2.3 免疫组化染色
在脊髓后角,GAD-65 和GAD-67 主要表达于Lamina I-III。SCI-Sed 组和SCI-Ex 组GAD-65 和GAD-67 相对免疫强度明显低于Sham 组(P<0.01)。SCI-Ex组GAD-65 和GAD-67 相对免疫强度显著高于SCI-Sed组(P<0.001)。见图2、表4。
3 讨论
脊髓损伤后的NPP 多出现在损伤平面以下,可表现为自发性疼痛、触诱发痛或痛觉过敏等[1-2]。脊髓损伤后NPP 的综合发生率约为53%[17],严重影响患者的身心健康[2]。运动训练是脊髓损伤后常用的功能性康复训练方案,可通过激活脊髓感觉运动神经环路促进神经可塑性和神经功能恢复[10,16,18],调节脊髓神经元的兴奋性,减轻脊髓损伤后痉挛和NPP[16,19-20]。但运动训练对脊髓损伤后脊髓后角内的GABA 合成的影响却少见报道。
GABA 是脊髓内重要的抑制性神经递质之一,由其限速酶GAD-65/67 合成[21]。在中枢神经系统中,GAD-65 主要表达于轴突终末,而GAD-67 主要表达于抑制性神经元胞体和神经终末[21-22]。在大鼠和狗的脊髓内,GAD-65 和GAD-67 广泛表达于脊髓灰质,尤其是点状分布于腰髓Lamina I-III[21,23],与本研究免疫组化结果一致。当GABA 与GABAA受体通道蛋白结合后,可引起突触后神经元的Cl-内流和超极化膜电位,发挥突触后抑制作用,使神经元的兴奋性降低[7]。而激活GABAB受体蛋白可通过减少Ca2+内流而发挥突触前抑制作用,使初级传入神经纤维膜电位超极化,抑制神经末梢的递质释放[7]。
本研究结果显示,脊髓损伤可降低大鼠后肢的痛阈,并减少GAD-65/67 的合成,与Meisner 等[23]和Gwak等[7]的研究一致。可能由于在脊髓损伤后,大鼠脊髓后角GABA 能神经元丢失或者是缺乏初级出入纤维的刺激所致[7]。运动训练可明显改善T10不完全性脊髓损伤大鼠的痛觉过敏,并增加脊髓内GAD-65 和GAD-67的合成。
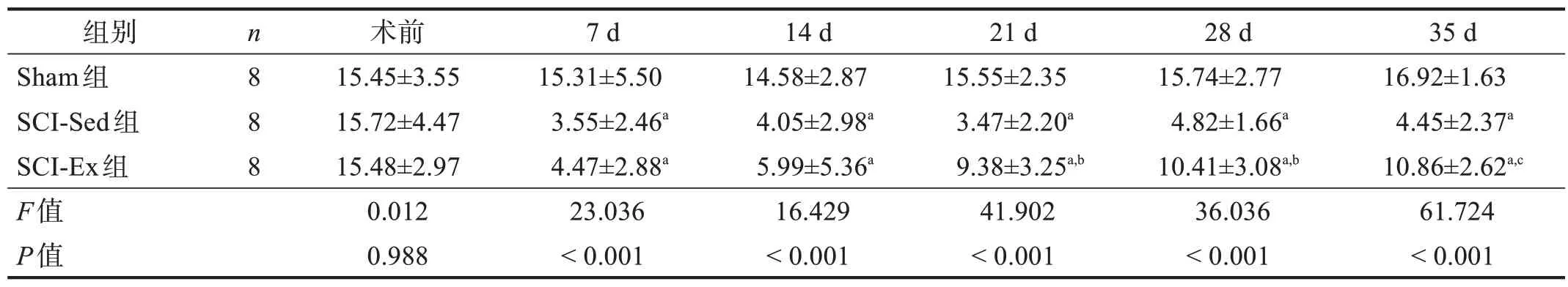
表2 各组热痛阈比较(s)
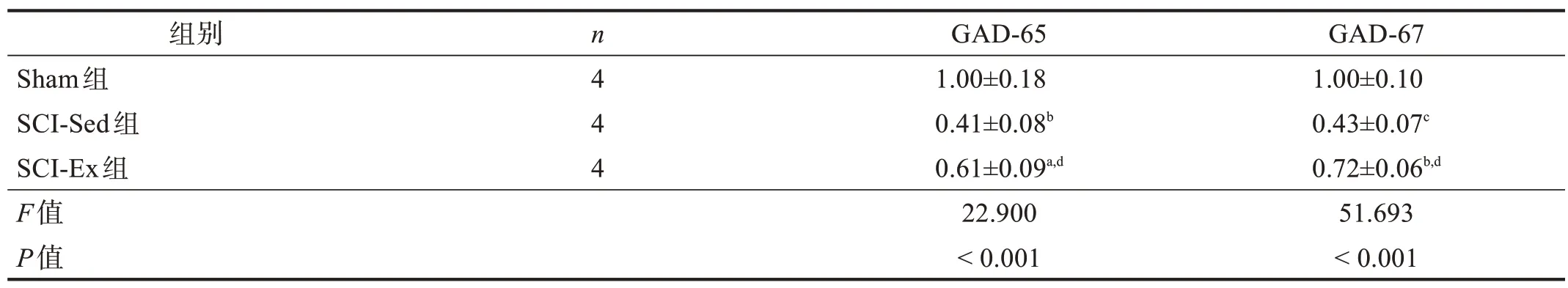
表3 各组GAD65和GAD-67 Western blotting相对表达量
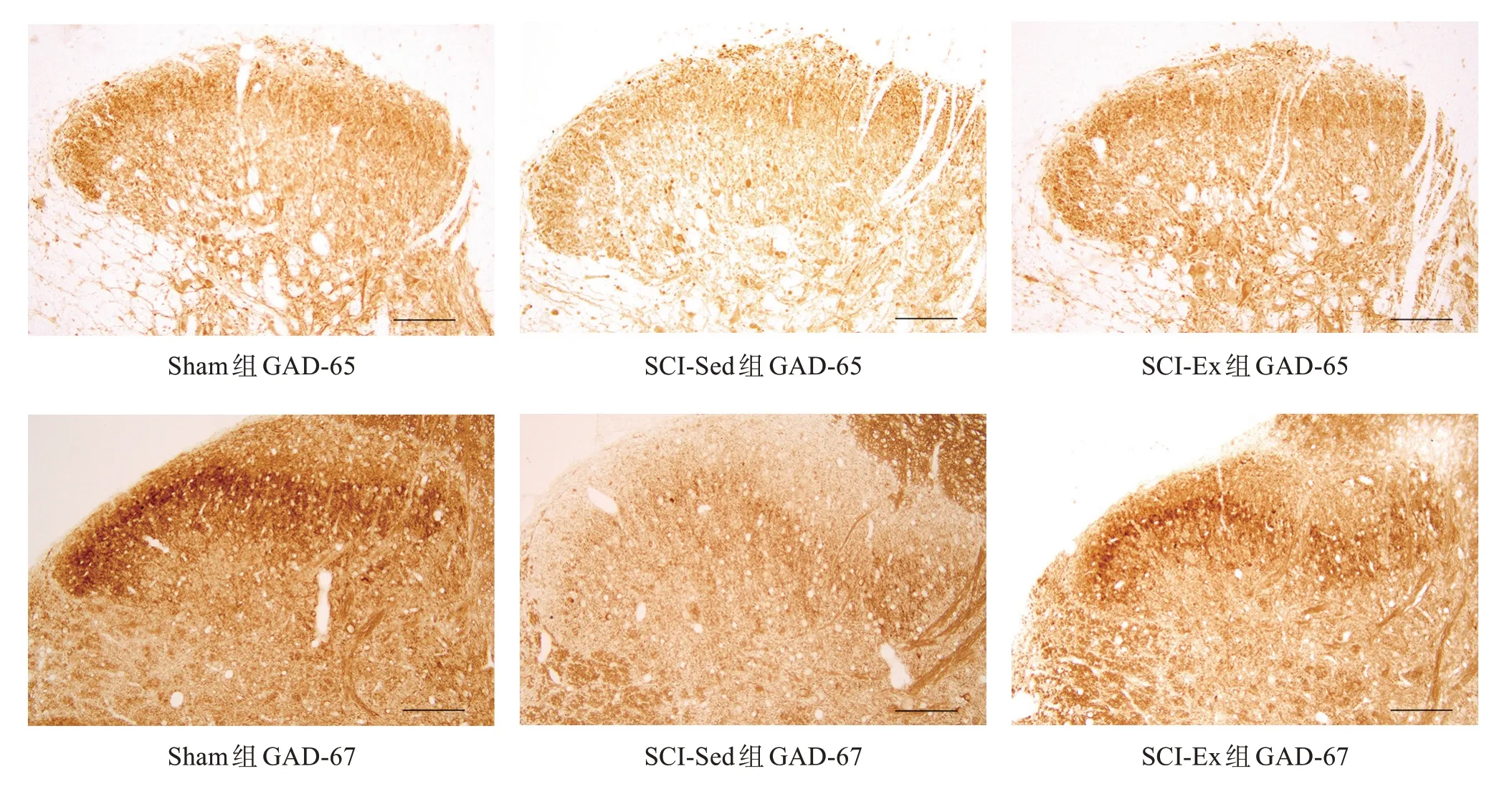
图2 各组GAD-65和GAD-67表达(免疫组化染色,bar=100 μm)
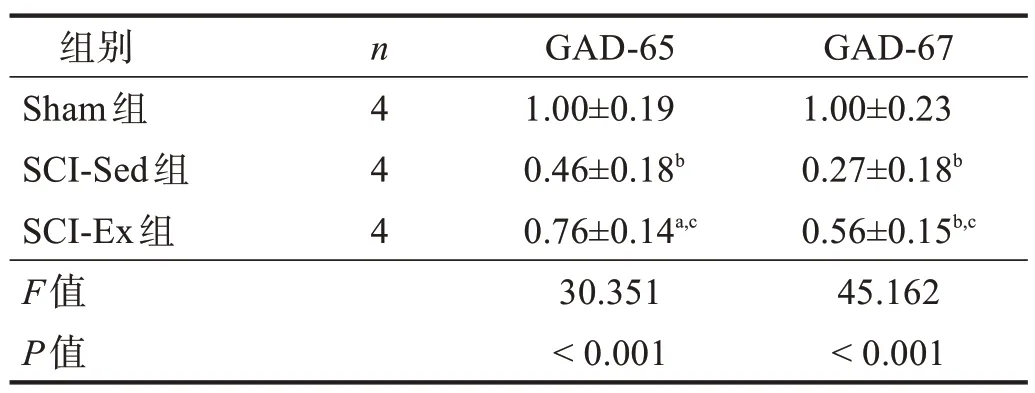
表4 各组脊髓后角GAD-65和GAD-67相对免疫强度比较
坐骨神经损伤后,运动训练可通过增加脊髓后角GAD-65 和GAD-67 合成,调节脊髓神经元兴奋性,减轻NPP程度[8-9]。此外,早期运动训练还可通过减少脊髓后角降钙素基因相关肽[24],增加神经胶质细胞源性的神经营养因子[25]和钾-氯协同转运蛋白-2(potassium chloride cotransporter 2,KCC2)表达[16],改善脊髓损伤后NPP。但是也有研究发现[26],早期运动训练可通过TrkB 信号通路,增加脊髓后角神经元兴奋性,促进脊髓损伤后NPP的发生,可能是采用的运动方式不同所致:后者采用的是机械臂辅助下踏步训练,而减轻NPP的运动训练多采用主动运动[27]。
Takeoka 等[28]认为,运动训练可通过肌梭感觉传入途径改善脊髓损伤后的运动功能恢复和神经功能重组。Li 等[29]发现,在小鼠出生后阻断脊髓感觉传入,可明显减弱脊髓后角GABA 能神经元的可塑性,并可能促进NPP的发生。由此可见,感觉信息的传入可能对脊髓后角神经网络的功能及重塑具有重要的调节作用。运动训练是否能够通过影响感觉传入而改善脊髓损伤后NPP,尚需进一步研究证实。
综上所述,运动训练可增加不完全性脊髓损伤大鼠损伤远端脊髓后角GAD-65/67 的合成,并增加大鼠后肢的机械性痛阈和热痛阈。但运动训练通过何种途径和机制增加GAD-65/67 的表达并改善脊髓损伤后的NPP,尚需进一步研究证实。

