肺放线菌病的临床和CT 表现特征分析
王露萍 贺文广 王小丽 李 君 楼海燕
肺放线菌病是一种少见的慢性肺化脓性肉芽肿性炎症,病变以局部化脓或肉芽肿性炎症、多发脓肿、瘘管窦道形成和分泌含硫磺颗粒脓液为特征[1]。放线菌感染可侵及全身各个器官,肺放线菌病约占人体放线菌病15%,仅次于头颈部(55%)和盆腹部(20%)放线菌病[2-3]。肺放线菌病无特征性临床表现,常误诊为肺结核、肺脓肿、肺癌等[4-5]。正确识别该疾病影像征象、及时诊断和有效治疗可避免病情恶化和不必要的外科手术。本研究通过回顾性分析经病理证实的16 例肺放线菌病患者的临床及影像资料,总结其共性特征以提高对该病的认识。
1 资料与方法
1.1 一般资料 收集浙江大学医学院附属第一医院2014 年6 月—2019 年5 月经病理确诊的16 例肺放线菌病患者临床及影像资料。4 例经纤维支气管镜活检、1 例经CT 引导下穿刺活检、11 例经手术病理确诊。男13 例、女3 例,年龄46~69 岁,平均57.9 岁。慢性基础疾病9 例,其中高血压病3 例、乙型病毒性肝炎及乙型病毒性肝炎携带者3 例、痛风2 例、高血压合并冠心病1 例。吸烟8 例、酗酒6 例。
1.2 仪器与方法 采用Philips Brilliance 64 排螺旋CT 机,16 例均行CT 平扫,11 例加增强扫描。由两名经验丰富的副主任医师对CT 图像进行分析、诊断;记录病变的形态及分布,病灶内的空洞、坏死、钙化及淋巴结肿大等特征。扫描参数:标准重组算法,管电压120kV,管电流250mA,螺距0.981,球管转速0.75/周,扫描层厚5mm,层间隔5mm,重组层厚1mm,层间隔1mm。增强扫描使用非离子型对比剂(碘普罗胺,300mg I/mL)100mL,高压注射器经前臂浅静脉注射,流率3.5mL/s,延迟至静脉期扫描(约60s)。
2 结果
2.1 临床表现和实验室检查 临床表现:咳嗽15例,咳痰15 例,痰中带血或咯血9 例,发热4 例,胸闷4 例,胸背部痛2 例。实验室检查:中性粒细胞比例增高(>70%)6 例、淋巴细胞比例增高(>30%)4 例,CRP 水平升高(>8mg/dL)7 例。
2.2 CT 表现特征
2.2.1 病灶分类 本组16 例中肺实质型放线菌病15 例,支气管扩张型放线菌病1 例。
2.2.2 病灶分布 本组16 例均位于单侧肺,其中右肺12 例,左肺4 例;下叶8 例,上叶5 例,中叶4 例,跨叶生长1 例。胸膜下分布7 例,见图1。
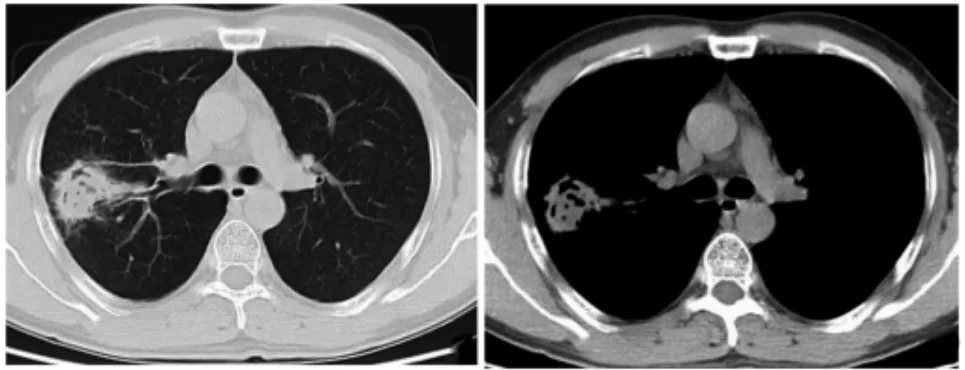
图1 患者男,46 岁;胸部CT 平扫示右肺上叶后段不规则团片影,边缘模糊,内见虫蚀样空洞,周围可见磨玻璃影
2.2.3 形态特征 肺实质型放线菌病表现为团片影5 例,团块影7 例,节段性实变2 例,结节1 例(见图2);病灶内低密度区7 例;虫蚀样空洞7 例(见图1);钙化2 例(见图3)。支气管扩张型肺放线菌病1 例,表现为支气管囊柱状扩张伴周围炎症(见图4)。
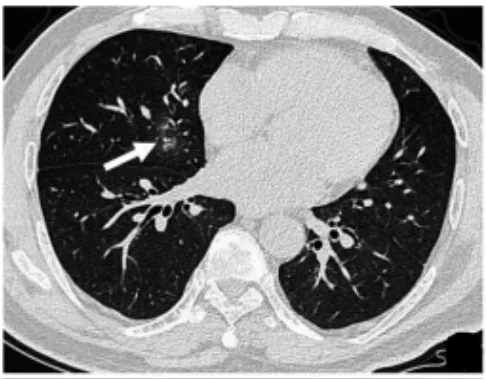
图2 患者男,64 岁;HRCT 示右肺中叶内侧段混合密度结节(箭头),边界欠清,周围可见磨玻璃影
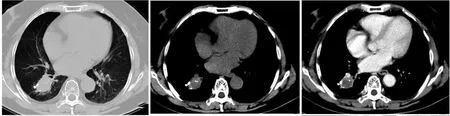
图3 患者女,65 岁。胸部增强CT 示右肺下叶团块影,边界尚清,内见斑片状低密度影及多发斑点状钙化,病灶周围见斑点状、条索状高密度影,增强扫描内低密度影未见强化
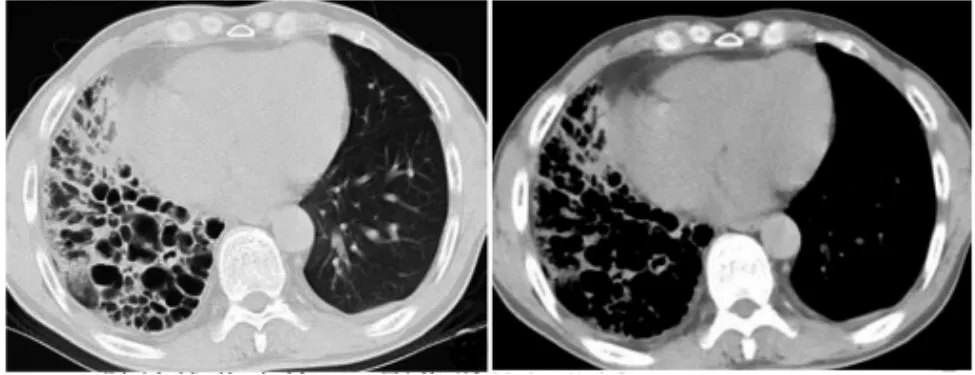
图4 患者男,54 岁;胸部增强CT 示右肺中下叶支气管囊柱状扩张,周围斑片状高密度影
2.2.4 纵隔及肺门淋巴结情况 纵隔及患侧淋巴结肿大5 例,纵隔淋巴结肿大1 例,两肺门淋巴结肿大1 例,纵隔及两肺门淋巴结钙化1 例。
2.2.5 增强表现 病灶均呈轻中重度不均匀强化,病灶内低密度坏死无强化,6 例血管穿行其中未见中断及受侵犯,见图5。
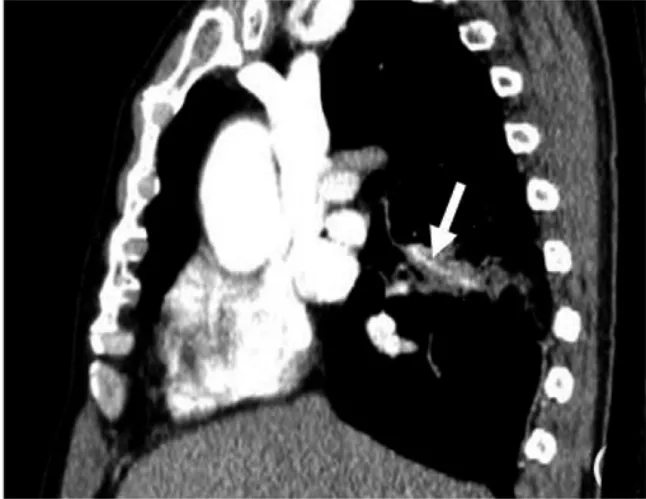
图5 患者男,61 岁;支气管动脉CTA 示右肺下叶团片影内见血管穿行(箭头),未受侵犯
2.3 病理表现 病理组织特点为慢性化脓性炎伴肉芽组织增生,周围肺组织慢性炎伴炎性纤维组织增生、炎性细胞浸润及淋巴组织增生,局灶化脓性炎或微脓肿形成。镜下见放线菌菌团,见图6,菌丝呈环绕放射状排列,末端呈棒状。11 例行特殊染色,其中11例六胺银染色和过碘酸雪夫(PAS)染色均阳性,7 例抗酸染色均阴性。3 例纤维支气管镜下可见淡黄色硫磺颗粒,见图7。
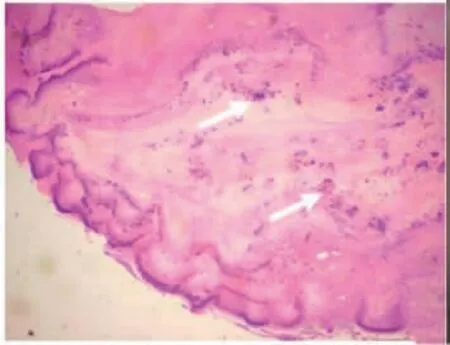
图6 经皮肺穿刺病理显示(HE ×50)
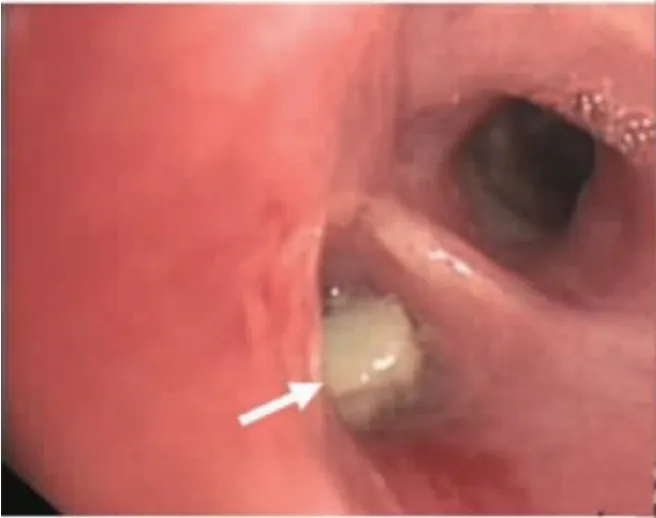
图7 纤维支气管镜显示
3 讨论
放线菌是革兰阳性分支状抗酸阴性的兼性厌氧菌[1],可寄生于健康人口腔、胃肠道和生殖器黏膜,并且通常是无感染性的[5];但放线菌相关疾病可发生在特定宿主中,如伴有肺实质损害的基础肺疾病、各种慢性衰弱性疾病、吸烟及酗酒等人群[2]。本组16 例中,慢性基础疾病9 例,吸烟8 例,酗酒6 例,与文献报道大致相符。Bartlett 等[6]研究发现,在免疫功能低下患者中该病的发病率并没有增加。无基础疾病人群亦可感染放线菌[7]。肺放线菌病可发生在各个年龄段,且无性别及种族偏好[6,8]。本组16 例中,男性(13例)占主要部分,部分原因是由于男性口腔卫生较差和/或面部创伤发生率较高[2]。本组患者年龄比以往文献报道中稍大,平均诊断年龄为57.9 岁,范围从46~69 岁。
肺放线菌病的临床表现缺乏特征性,常见症状包括咳嗽、咳痰、咯血、发热、胸痛,部分患者可伴有盗汗、体质量减轻、乏力等症状,常与一些慢性肺部疾病的临床表现相类似。本组16 例中,咳嗽、咳痰各15 例,痰中带血或咯血9 例,发热及胸闷各4 例,胸背部疼痛2 例,虽然肺放线菌病缺乏特征性的临床表现,但若患者痰液、脓液、瘘管壁或病理组织等发现“硫磺样颗粒”(见图7),则应考虑到肺放线菌病的诊断[7,9]。
放线菌常跨肺段、肺叶及解剖间隙播散,多数患者常发病于肺下叶,双肺叶、多部位感染较少见[10]。本研究16 例中均为单侧发病,12 例病变位于右肺,8例病变位于肺下叶,与文献报道相一致,这也与肺放线菌的吸入性传播途径相符[2]。Kim 等[11]把胸部放线菌病分为肺实质型、支气管扩张型、支气管内放线菌病:(1)肺实质型放线菌病病变早期CT 常表现为胸膜下分布为主的不规则小结节,周围见磨玻璃样密度(晕征),伴或不伴小叶间隔增厚[7]。其病理组织为放线菌引起的支气管肺炎及早期的炎性肉芽肿,病灶周围的磨玻璃影可能为放线菌浸润周围肺实质或局部血管导致肺泡积血[11]。本组1 例CT 表现为混合密度结节伴周围晕征。病变中晚期呈团块影和/或节段性实变,病灶内可见斑片状无强化低密度坏死灶,并可见散在分布气体密度影[11]。病灶内气体分布与重力无关,且气体与液化的坏死区不形成气-液平面而是悬浮存在,这是肺放线菌病区别于其他空洞性病变最具特征性的表现[10]。但也有报道提出大部分空洞内可见气-液平面[12]。本研究15 例肺实质型放线菌病,呈胸膜下分布7 例;表现为团片影5 例,团块影7例,与上述文献报道相符。本研究仅7 例出现虫蚀样空洞,考虑可能因为患者就诊时间较早,病灶尚未充分液化坏死,以及部分患者无基础肺部疾病,因此病灶所在肺组织局部通气及血供坏境较好,不利于组织充分坏死。病变晚期可呈大范围的肺实变并跨越叶间裂延伸至邻近肺叶,侵犯胸膜、胸壁或纵隔,引起脓胸、软组织肿胀、骨质破坏、瘘管等[11]。(2)支气管扩张型放线菌病CT 特征性表现为局部支气管扩张伴支气管壁不规则增厚,支气管周围可见脓肿形成[11]。本研究仅1 例。(3)支气管内放线菌病CT 常表现为支气管内异物或结石伴远端阻塞性肺炎[11],此型罕见。
增强CT 显示病灶实性部分明显渐进性强化,病灶周围呈不均匀轻中度强化,中央低密度液化坏死区无明显强化[7]。组织学上,CT 上的中央低密度区代表含放线菌或硫黄颗粒的微脓肿,而周围强化部分代表含少量纤维的肉芽组织和炎性细胞组成[13]。本组16 例病例,11 例行CT 增强扫描,病灶实性部分呈轻中重度强化,病灶内低密度坏死区无强化,与上述文献报道相符。另外6 例可见血管穿行其中且未受明显侵犯,这一征象既往并未予以重视,但笔者认为尚有一定的鉴别意义。
其他CT 表现包括纵隔或肺门淋巴结肿大、钙化、局部胸膜增厚或粘连、胸腔积液等[7,11]。本组16 例病例中,纵隔和/或肺门淋巴结肿大共7 例,肿大淋巴结边界清且密度均匀,考虑炎性病变所致反应性增生可能性大。2 例病灶内见钙化,虽然文献报道不多且没有特异性,但是笔者认为当病灶出现钙化时并不能排除肺放线菌病的诊断。
肺放线菌病需要与以下肺部疾病相鉴别:(1)周围型肺癌:CT 表现为形态不规则实性肿块,呈分叶状并有细短毛刺,可有胸膜凹陷征及血管集束征,癌性空洞内壁常不光整并可见壁结节;(2)真菌性肺感染:常形成真菌球,典型表现为“空气半月征”的偏心性空洞性结节,病灶周围多伴“晕征”;(3)浸润性肺结核:多发于上叶尖后段及下叶背段,肺结核周围可有卫星灶,空洞壁较薄、可有钙化,周边可见纤维化。
目前青霉素G 为标准用药,传统上采用大剂量青霉素静脉滴注2~6 周,后可改用口服青霉素V 或阿莫西林6~12 个月维持治疗[2]。对于一些抗生素治疗长达12 周仍无效果、持续咯血、复杂的肺放线菌病或与肺恶性肿瘤难以鉴别情况下应尽早实施外科手术[8]。
综上所述,肺放线菌病临床少见且缺乏特异性临床表现。对于有吸烟酗酒史、不良口腔卫生习惯和慢性基础疾病,CT 表现为胸膜下分布为主的实变性肉芽肿、实变中坏死及虫蚀样空洞者需考虑到该病的诊断。(病例为作者在浙江大学医学院附属第一医院放射科规培学习时采集。)

