经皮内镜下胃造瘘术肠内营养对重症脑卒中呼吸机相关性肺炎患者的影响
陈 妍,叶 梅,郑 菁,吕心阳*
(1.福建省立金山医院 福建福州350028;2.福建省立医院)
机械通气是重症脑卒中患者呼吸衰竭治疗常用方法之一,机械通气常伴有肺部感染风险增加,该类患者需要营养支持治疗[1]。营养支持分为肠外营养支持和肠内营养支持,肠外营养支持营养素单一、易引发代谢综合征,适合短期或与肠内营养联合使用[2]。由于重症脑卒中患者伴有应激性溃疡、呕吐症状,容易引发窒息、吸入性肺炎,传统鼻-胃营养置管肠内营养支持增加重症脑卒中呼吸机相关性肺炎的易感性。经皮内镜下胃造瘘术(PEG)肠内营养是指通过胃镜介导放置胃造瘘管进行胃或空肠肠内营养的微创技术,与传统鼻-胃营养置管肠内营养支持比较,具有留置时间长、并发症少等优点[3]。目前,未见关于PEG肠内营养支持干预对重症脑卒中患者呼吸机相关性肺炎影响的研究。因此,本研究拟通过对重症脑卒中机械通气患者的PEG肠内营养支持追踪调查,探讨其对呼吸机相关性肺炎的影响,为该类患者的治疗提供理论依据。现报告如下。
1 资料与方法
1.1 临床资料 采用病例对照方法,收集2017年3月1日~2019年3月1日福建省立医院、福建省立金山医院确诊并行呼吸机支持治疗重症脑卒中患者216例为研究对象。纳入标准:①重症脑卒中患者,格拉斯哥昏迷指数(GCS)评分≤8分;②不能经口进食者;③合并呼吸衰竭并行有创机械通气者;④近期无胃肠道有创手术或检查史、溃疡史者;⑤无严重肝肾功能障碍、肿瘤、代谢性疾病者。排除标准:①脑卒中患者,GCS评分>9分;②能经口进食者;③不需机械通气者;④近期胃肠道有创手术或检查史、消化道溃疡史者;⑤合并严重肝肾功能障碍、肿瘤、代谢性疾病者。采用住院号末尾两位加入住日期末尾两位查DOLL随机数据表取样,将患者分为实验组106例和对照组110例。实验组男64例(60.4%)、女42例(39.6%),年龄(63.41±6.24)岁;GCS评分(5.42±1.23)分;抑酸药使用时间(1.24±0.11)d;肺部基础疾病:有12例(11.3%),无94例(88.7%);吸烟史:有16例(15.1%),无90例(84.9%);脑卒中类型:缺血性脑卒中42例(39.6%),出血性脑卒中64例(60.4%)。对照组男69例(62.7%)、女41例(37.3%),年龄(62.96±5.74)岁;GCS评分(5.37±1.19)分;抑酸药使用时间(1.36±0.14)d;肺部基础疾病:有15例(13.6%),无95例(86.4%);吸烟史:有18例(16.4%),无92例(83.6%);脑卒中类型:缺血性脑卒中45例(40.9%),出血性脑卒中65例(59.1%)。两组一般资料比较差异无统计学意义(P>0.05)。本研究获得本院医学伦理委员会批准。
1.2 方法 患者入院后常规留置胃管胃肠减压,防止误吸,动态观察呕吐、消化道出血并处理。入院1~3 d内实施营养措施。对照组给予鼻-胃肠内营养支持,内容如下。①无消化道出血和胃食管反流即行鼻-胃营养置管肠内营养支持(肠内营养乳液:瑞代,华瑞制药生产);②肠内营养不足时应用肠外营养补充[肠外营养液为脂肪乳氨基酸葡萄糖注射液(卡文,华瑞制药生产)];③出现消化道出血和食管反流以全肠外营养代替至并发症纠正;④补充能量≥1500 kcal/(kg·d)。实验组给予PEG肠内营养支持,具体内容如下:①床旁胃镜胃内充气至胃前臂紧贴腹壁;②造瘘置管:胃实体与腹壁结合部中央为穿刺点用套管针穿刺插入导丝并送入圈套器,通过胃镜夹持导丝把圈套器拉出口腔外,把造瘘管和圈套器固定送回胃内,从腹壁外将造瘘管拉出并固定,经造瘘管送入空肠管并固定;③无消化道出血、胃食管反流行胃肠内营养,出现并发症行胃肠减压,空肠肠内营养(肠内营养乳液:瑞代,华瑞制药生产);④造瘘局部消毒;⑤补充能量≥1500 kcal/(kg·d)。干预时间为入住ICU 1~21 d。
1.3 观察指标 ①采用肺炎严重指数(PSI)[4]测评患者干预前后呼吸机相关性肺炎的严重程度,按总分<50分、51~70分、71~90分、91~130分、>130分别为Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级、Ⅴ级,分值越高表明患者肺炎程度越重。②营养相关指标:比较两组干预前后白蛋白和前白蛋白水平。③免疫功能,炎性因子:比较两组干预前后肿瘤坏死因子-α(TNF-α)、肿瘤坏死因子-β1(TNF-β1);T淋巴细胞亚群检查:比较两组干预前后CD4+/CD8+。④胃肠道并发症:比较两组胃潴留、食管反流、腹胀、腹泻、消化道出血发生情况。
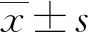
2 结果
2.1 两组干预前后PSI评分、营养相关指标、免疫功能比较 见表1。
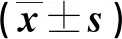
表1 两组干预前后PSI评分、营养相关指标、免疫功能比较
2.2 两组胃肠道并发症发生情况比较 见表2。
2.3 实验组患者呼吸机相关性肺炎多因素Logistic回归分析 以实验组患者PSI得分为因变量,年龄、性别、吸烟史、胃肠道并发症、白蛋白、前白蛋白、CD4+/CD8+、TNF-α、TNF-β1为自变量进行多因素Logistic回归分析。见表3。

表2 两组胃肠道并发症发生情况比较
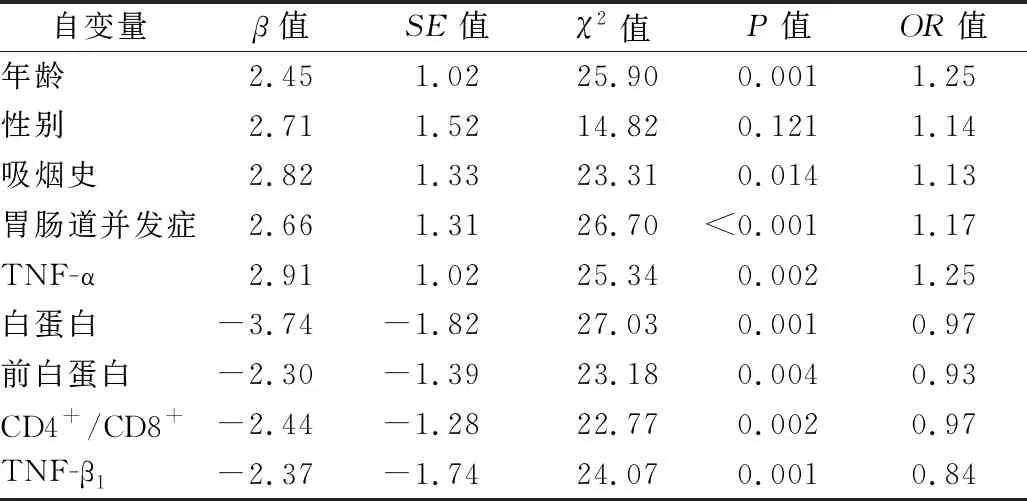
表3 实验组患者呼吸机相关性肺炎多因素Logistic回归分析
3 讨论
本研究结果显示,实验组胃肠道并发症发生率低于对照组(P<0.05)。首先,重症脑卒中由于颅内压增高易引发呕吐、消化性溃疡症状,以上因素容易引发患者营养失衡且通过鼻-胃置管肠内营养治疗不耐受[5]。然而,出现上述症状时,PEG肠内营养干预患者可通过胃管引流胃内容物,同时通过空肠途径营养支持保证肠内营养的有效性。其次,重症脑卒中患者意识障碍程度重,鼻-胃置管肠内营养治疗不耐受时胃肠蠕动障碍导致腹胀、肠源性感染风险增加。PEG肠内营养有效性可刺激肠蠕动,降低肠内内环境失调风险及肠内细菌转移血液的风险[6]。
本研究结果显示,干预后,实验组白蛋白、前白蛋白水平高于对照组(P<0.05),结果提示PEG肠内营养对重症脑卒中呼吸机支持患者营养状况改善效果显著。与PEG肠内营养的有效性且可持续性有关[7]。本研究结果显示,干预后,实验组CD4+/ CD8+、TNF-β1水平高于对照组(P<0.05),TNF-α水平低于对照组(P<0.05),结果提示经PEG肠内营养对重症脑卒中呼吸机支持患者免疫系统有调节作用。结果考虑:首先,PEG肠内营养干预的有效性可维持胃肠道免疫屏障内环境平衡,同时能稳定正常菌群、维持肠道生物屏障[8]。其次,T淋巴细胞维持正常功能需要能量支持,有效的肠内营养为能量支持提供必要和持续的支撑。再次,重症脑卒中患者由于应激反应,表现为TNF-α增高、TNF-β1降低。CD4+/ CD8+的比值提高可促进抑炎因子TNF-β1提高和促炎因子TNF-α的降低,从而调节炎性反应[9]。
本研究结果显示,实验组干预后PSI水平低于对照组(P<0.05),结果提示PEG肠内营养对重症脑卒中呼吸机相关肺炎的控制有促进效应。多因素回归结果显示,白蛋白、前白蛋白、CD4+/CD8+、TNF-β1是减轻PEG肠内营养重症脑卒中患者呼吸机相关肺炎的保护性因素,TNF-α是危险性因素。以上结果考虑:首先,PEG肠内营养干预可有效控制呕吐和食管反流引发的吸入性肺炎的风险性。其次,有效、持续的肠内营养保证肠内内环境平衡、降低肠内内源性感染风险,同时能缓解机体的负氮代谢,提高机体应对能力,表现为机体白蛋白、前白蛋白水平升高,为减轻肺部感染提供较好的内环境基础。再次,有效的营养供能提高机体的抗炎能力,调整机体免疫反应,表现为CD4+/CD8+、TNF-β1水平升高和TNF-α水平降低,有利于重症脑卒中呼吸机相关性肺炎的控制[10]。同时,回归分析结果显示,年龄、吸烟史、胃肠道并发症是加重PEG肠内营养重症脑卒中患者呼吸机相关性肺炎的因素。结果考虑:首先,伴随年龄增加,患者内环境应对能力下降,增加肺部感染易感性[11]。其次,吸烟可以患者降低肺部内环境抵抗炎症的能力[11]。再次,胃肠道并发症容易引发吸入性肺炎,增加肺部感染的风险。

