橙皮素早期干预对APPswe/PS1dE9小鼠学习记忆能力和Aβ42、NEP的影响
王志成,李宝群,吴晓光,申兴斌,赵 杨,王瑞婷*
(1.承德医学院,河北承德 067000; 2.承德医学院附属医院病理科)
β-淀粉样蛋白(amyloid β-protein,Aβ)沉积形成的神经炎性斑块和神经纤维缠结是目前最具特征的AD病理特征[1]。Aβ是由淀粉样蛋白前体蛋白(APP)依次被β-分泌酶(BACE1)和γ-分泌酶连续式蛋白水解代谢生成,主要生成Aβ1-40和Aβ1-42[2,3],而Aβ1-42具有更强的神经毒性[4],脑啡肽酶(neprilysin,NEP)是Aβ的主要代谢酶,通过水解将Aβ切为小分子肽进而降低其毒性。AD发生具有不可逆性,多数临床患者已经长期处于AD轻度认知功能障碍期(mild cognitive impairment,MCI)和痴呆期。2014年,有学者构想出比临床前驱期更早的主观认知减退(subjective cognitive decline,SCD)概念[5],以便更早的对AD患者进行积极治疗。近200种针对MCI期和痴呆期AD患者的药物临床试验失败,使得美国FDA于2018年在AD的相关指南中支持极早期干预。有研究指出,在出现临床认知功能障碍的无症状临床前驱期,Aβ经历了漫长的沉积,从可检测至阈浓度约需12年,海马萎缩约4.2年,记忆力减退约3.3年[6],为早期干预减少Aβ沉积,延缓AD进展提供了机会。
橙皮素是天然二氢黄酮化合物,本身具有抗炎、抗氧化的药理作用。有研究表明,黄酮类化合物对AD具有改善AD学习记忆能力和保护神经元的作用[7]。本课题组前期实验表明,早期橙皮素给药会降低β、γ分泌酶的活性,减少Aβ的生成[8],本次实验采用APPswe/PS1dE9双转基因小鼠,橙皮素不同剂量灌胃早期干预,探究橙皮素对Aβ42生成以及Aβ代谢酶NEP的影响。
1 材料和方法
1.1 实验动物
3月龄SPF级APPswe/PS1dE9双转基因雄性小鼠12只[许可证号SCXK(京)2014-0004],3月龄C57BL/6J野生型雄性小鼠48只[许可证号SCXK(京)2014-0004],体重(23±3)g,均购自北京华阜康生物科技股份有限公司。饲养于承德医学院实验动物中心(SPF级),许可证编号SYXK(冀)2017-001,符合实验动物伦理要求(CDMULAC-20190308-004)。
1.2 试剂
橙皮素、羧甲基纤维素钠(CMC-Na)(上海阿拉丁生化科技股份有限公司),RIPA组织/细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒(北京索莱宝科技有限公司), 小鼠Aβ42 ELISA试剂盒(江苏酶标生物科技有限公司),Aβ42兔抗小鼠抗体(abcam),脑啡肽酶NEP抗体(美国genetex公司),β-Actin抗体(上海Abways生物科技有限公司),羊抗兔二抗(SeraCare Life Sciences公司),超敏ECL化学发光试剂盒(沈阳万类生物科技有限公司)。
1.3 仪器
Morris水迷宫(中国医学科学院药物研究所);全自动化学发光仪(Tanon-6100);组织处理机(Shandon Excelsior);轮转式切片机(Leica RM 2235);恒温摊片烤片机(TK-218II);光学显微镜(日本OLYMPUS公司)。
1.4 动物分组与给药
3月龄C57BL/6J野生型小鼠12只设为对照组;3月龄APPswe/PS1dE9双转基因小鼠48只,随机分为模型组和橙皮素低、中、高剂量组,每组12只,每日一次,灌胃给药,灌胃溶剂体积按小鼠体质量0.01L/kg,对照组和模型组为0.5% CMCNa,橙皮素低、中、高剂量组为20mg/kg、40mg/kg、80mg/kg。
1.5 检测指标
1.5.1 Morris水迷宫实验 水迷宫水池直径120cm,平台直径为8cm,水温为18~22℃。第1天为小鼠适应性学习,2~5d为定向航行实验,设计时长为60s,若小鼠没有登上平台则将小鼠引导至平台,停留20s并且记录为60s;第6天撤走平台进行空间探索实验,记录小鼠穿越平台次数。
1.5.2 HE染色 每组各取4只小鼠麻醉,心脏灌注4%多聚甲醛后取脑组织固定、脱水、石蜡包埋、切片、400倍镜下观察小鼠海马CA1区神经元。
1.5.3 ELISA酶联免疫吸附 严格按照ELISA试剂盒说明书操作。
1.5.4 Western Blot蛋白印迹法 取新鲜脑组织全脑匀浆,离心提取蛋白,BCA法定量检测蛋白浓度,以每孔40ug蛋白上样。电泳分离后,转至0.45μm PVDF膜条带。用5%脱脂奶粉封闭,加入一抗Aβ42(1:500)、NEP(1:1000)、β-Actin(1:6000),摇床孵育,TBST洗膜,加入二抗(1:10000),洗膜,显影,使用ImageJ软件分析蛋白表达水平。
1.6 数据统计分析

2 结果
2.1 实验动物状态
C57BL/6J野生型小鼠饲养过程中食欲旺盛、毛发光滑,对外界刺激有所反应,存在应激争斗现象;APPswe/PS1dE9双转基因小鼠不论模型组或给药组均对食物欲望降低、嗜睡、外界刺激反应较差、没有发现争斗或应激反应,但在饲养过程中偶尔出现类似癫痫发作亢奋后抽搐表现,致死率约20%~30%。灌胃结束小鼠存活数目,见表1。
表1 各组小鼠存活数目及体重(

表1 各组小鼠存活数目及体重(
分组存活数目(只)体重(g)对照组1132.37±2.30模型组1133.57±1.59橙皮素低剂量组830.81±1.99橙皮素中剂量组1231.57±2.46橙皮素高剂量组1030.80±1.54
2.2 Morris水迷宫行为学
在定向航行实验阶段:模型组到达平台的潜伏期明显高于对照组(P<0.05),与模型组相比,橙皮素低、中、高剂量组潜伏期明显降低(P<0.01),且橙皮素低剂量组潜伏期低于橙皮素中剂量组潜伏期(P<0.05)。在空间探索实验阶段:模型组穿越平台区域次数明显少于对照组(P<0.05),与模型组相比,橙皮素低、中、高穿越平台区域次数明显增加(P<0.01)。见表2,图1,图2。

表2 各组小鼠Morris水迷宫行为学实验结果(n=8)
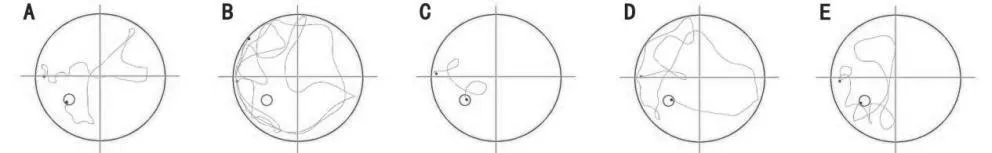
图1 定向航行实验轨迹图
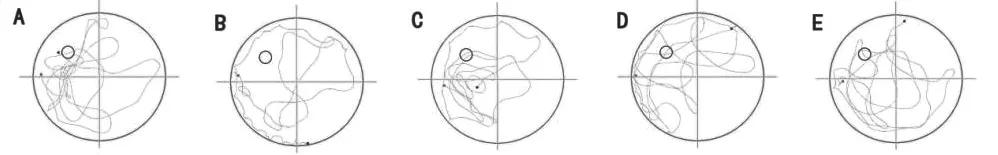
图2 空间探索实验轨迹图
2.3 HE染色
对照组海马CA1区神经元层数为4~5层,排列较为紧密,结构较为完整;模型组小鼠海马CA1区神经元细胞层数为2~3层,数目明显减少,细胞间隙明显增宽,排列紊乱甚至断裂,有明显的胞体肿胀,神经元周围组织出现损伤、病变现象。橙皮素低、中、高剂量组神经元排列相对规则、紧密,且神经元细胞形态均有不同程度的改善,见图3。
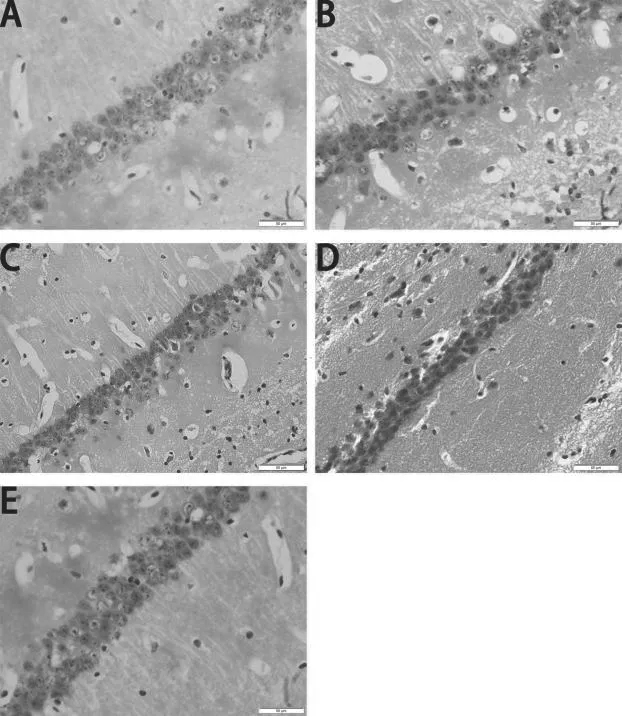
图3 各组小鼠海马CA1区HE染色结果(×400)
2.4 ELISA酶联免疫吸附
模型组血清中Aβ42含量明显高于对照组,与模型组相比,橙皮素低、中、高剂量组Aβ42含量明显降低(P<0.01),橙皮素中剂量组低于橙皮素低剂量组(P<0.05)。见表3,图4。
表3 各组小鼠血清中Aβ42含量(ELISA ,n=5)

表3 各组小鼠血清中Aβ42含量(ELISA ,n=5)
与对照组相比*P<0.05,**P<0.01;与模型组相比#P<0.05,##P<0.01;与低剂量组相比△P<0.05,△△P<0.01
分组剂量mg/kg/dAβ42(μg/L)对照组-57.11±7.14模型组-65.88±3.30*橙皮素低剂量组2054.80±4.72##橙皮素中剂量组4047.73±3.91##△橙皮素高剂量组8050.90±5.02##
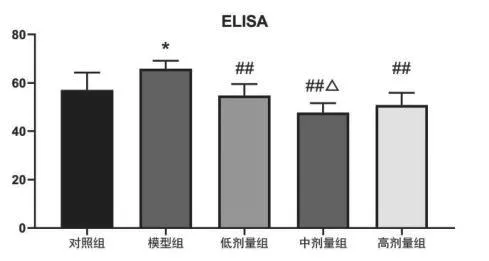
图4 各组小鼠血清中Aβ42含量(ELISA)
2.5 Western Blot蛋白质印迹法
2.5.1 脑组织中Aβ42含量 模型组表达明显高于对照组(P<0.01),与模型组相比,橙皮素低、中、高Aβ42表达明显低于模型组(P<0.01)。见图5,图6。
2.5.2 脑组织中NEP含量 模型组与对照组无统计学差异;与模型组相比,橙皮素中、高剂量组明显高于模型组(P<0.01)。见图5,图7。

图5 Aβ42和NEP在各组小鼠脑组织表达(Western Blot)
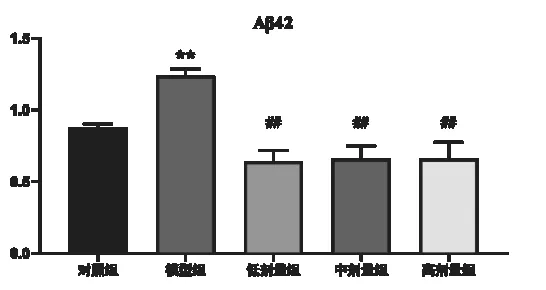
图6 Aβ42在各组小鼠脑组织表达(Western Blot)

图7 NEP在各组小鼠脑组织表达(Western Blot)
3 讨论
Aβ是AD患者大脑中老年斑的主要成分,在临床研究期间,Aβ作为关键的生物标志物之一,可通过脑脊液和血浆测定浓度[9],这对早期判断AD病情发展阶段具有重要意义。实验所使用的APPswe/PS1dE9双转基因小鼠是由Jankowsky实验室在2004年建立的AD小鼠模型[10]。APPswe基因突变会导致β淀粉样蛋白前体蛋白出现新的切点,更容易被β-分泌酶(BACE1)和γ-分泌酶作用产生Aβ淀粉样蛋白沉淀。PS1属于早老素基因(presenilin,PS),参与APP相关的转运、合成、加工过程[11]。有研究证实[12],该AD小鼠在6月龄会显著形成中枢神经系统淀粉样斑块,是较为理想的AD小鼠模型。本实验模型组APPswe/PS1dE9双转基因小鼠的学习能力与认知能力明显下降,神经元出现明显的损伤,血清与脑组织中Aβ42含量上升,提示该小鼠符合AD的发病特征。
大量针对Aβ在MCI期和痴呆期患者的临床试验失败结果证实,在MCI期和痴呆期单纯减少Aβ含量难以达到有效的治疗效果,有学者[13]对临床前驱期患者进行了2年的干预,但并无显著效果,因此,有学者提出,需要更长时间更早的干预。AD作为神经退行性疾病发病原因极其复杂,王延江等[14]提出,需要针对AD发病机制的复杂行进行多靶点综合干预。
橙皮素是一种天然黄酮类化合物,属于酚类抗氧化剂。橙皮素早期干预后,脑组织和血清中Aβ42含量明显降低,小鼠学习能力有所提升,提示橙皮素早期干预可以降低小鼠脑内Aβ42的含量,保护海马神经元,提高小鼠学习记忆能力。实验结果显示橙皮素早期干预后Aβ42不仅含量明显低于模型组,也明显低于对照组,分析对照组小鼠9月龄时已进入老年状态,进一步证明橙皮素更适合早期干预。
目前可通过减少Aβ生成、增强脑组织中Aβ的清除来减少脑内Aβ含量[15,16]。课题组前期研究结果提示橙皮素早期干预可降低β分泌酶、γ分泌酶活性,减少Aβ生成。脑啡肽酶(neprilysin,NEP)是Aβ的主要代谢酶,也是Aβ蛋白代谢降解的限速酶[17,18],其表达部位与Aβ沉积部位呈负相关。NEP存在于海马体CA1-3区域的锥体层,腔隙层,以及齿状回分子层[18,19]。黄酮类化合物具有活性成分多样、作用靶点广泛的优势[20]。模型组AD小鼠的脑组织中NEP含量与对照组无明显差异,推测AD小鼠的APPswe基因突变和PS1基因突变会增加脑组织中Aβ42的含量,但对NEP的活性没有影响。橙皮素早期干预6个月后,AD小鼠脑组织中NEP表达有明显增加。有研究证实[20],AD小鼠经过黄酮类化合物灯盏花素干预三个月后,其NEP活性增加,Aβ生成减少,学习记忆能力提高。还有研究[21]发现,黄酮类化合物姜黄素早期干预AD小鼠六个月后,NEP表达增加,Aβ含量减少,进一步证实NEP活性的增加能有效提高Aβ的代谢。
结合我们前期实验[22]证实,橙皮素能抑制小鼠脑组织中TLR2和NF-κB的生成,提高HO-1活性,启动脑组织内抗氧化、抗炎机制。同时,可减少Aβ生成,促进Aβ代谢,提示橙皮素具有多靶点作用,进一步研究其早期干预延缓AD进展具有重要意义。

