NOS1AP基因非编码区位点多态性与精神分裂症的关联研究
胡国芹,吕钦谕,赵 静,朱明环,禹顺英,易正辉#,陈 健#
1.上海市黄浦区精神卫生中心精神科,上海200011;2.上海交通大学医学院附属精神卫生中心精神科,上海200030;3.上海市浦东新区精神卫生中心精神科,上海200122
精神分裂症是一种常见的严重慢性精神疾病,患病率约1%[1]。研究者们对精神分裂症的具体病因和潜在的病理生理机制仍然知之甚少。18 岁之前起病的患者,被定义为早发性精神分裂症(early onset schizophrenia,EOS),较晚发精神分裂症患者具有更多的遗传学基础[2]。精神分裂症患者发病年龄越早,其亲属患精神分裂症的比例越高[3]。
来自不同种族人群的大样本关联研究[4]表明,位于1 号染色体的一氧化氮合成酶1 接头蛋白(nitric oxide synthase 1 adaptor protein,NOS1AP)基因是与精神分裂症显著相关的基因之一。诸多研究者在精神分裂症尸脑组织中发现不同脑区NOS1AP 蛋白表达水平发生变化[5]。3 种NOS1AP 蛋 白 亚 型(NOS1AP-L、 NOS1AP-S、NOS1AP-S')在精神分裂症患者尸脑组织的背外侧前额叶区域表达升高,在小脑区域表达降低[6]。但是关于NOS1AP 基因变异如何影响蛋白表达的病理机制研究较少。课题组前期关于EOS 核心家系的研究[7]发现,NOS1AP 基因rs12742393 位点与EOS 存在显著相关趋势,且通过病例-对照研究发现精神分裂症和正常对照相比,外周血NOS1AP mRNA 和蛋白表达明显增加。本研究拟在中国汉族人群中进一步扩大样本研究NOS1AP 基因与精神分裂症的相关性,并且通过在线预测软件进一步探讨rs12742393位点变异对RNA和蛋白质空间结构的影响。
1 对象与方法
1.1 研究对象
选择2012年10月—2015年12月期间上海交通大学医学院附属精神卫生中心收治的精神分裂症住院或门诊患者,以及同一时期在上海交通大学医学院附属精神卫生中心的职工和复旦大学附属中山医院青浦分院体检中心的受检者中招募的健康志愿者作为研究对象,分为EOS组、非早发性精神分裂症(non-early onset schizophrenia,non-EOS)组和正常对照(health control,HC)组。
EOS 组纳入标准:①汉族,年龄18~65 岁,性别不限。②符合美国《精神障碍诊断与统计手册》(第4 版)(Diagnostic and Statistical Manual of Mental Disorders,4th edition,DSM-Ⅳ)精神分裂症的诊断标准。③首次确诊精神分裂症的年龄≤18岁。④受教育背景及文化足以理解研究内容和知情同意书。EOS组排除标准:①合并符合DSM-Ⅳ其他诊断的精神疾病。②合并中枢神经系统器质性疾病、糖尿病等重大躯体疾病者。non-EOS 组纳入标准:首次确诊精神分裂症的年龄>18岁,其他纳入标准同EOS组。non-EOS组排除标准同EOS组。HC组纳入标准:①年龄18~65岁。②性别不限。③汉族。HC组排除标准:①符合DSM-Ⅳ中任何精神疾病。②严重脑器质性疾病或躯体疾病。③精神活性物质使用者。④妊娠期及产后1年女性。3组研究对象之间无血缘关系。研究得到上海交通大学医学院附属精神卫生中心伦理委员会的批准(批件号2012-26R)。所有研究对象均签署书面的知情同意书,对于精神分裂症患者,其监护人同时签署知情同意书。
1.2 研究方法
1.2.1 诊断工具 入组时至少由2 名副高级职称以上的精神科医师采用DSM-Ⅳ诊断标准对精神症状进行评定。
1.2.2 DNA 提取 采集各组研究对象静脉血各2 mL,2%乙二胺四乙酸抗凝。采用1 mL 血液基因组DNA 小量提取试剂盒(北京天根生物科技有限公司)提取DNA,测量DNA浓度。提取好的DNA保存于-80 ℃冰箱备用。
1.2.3 多态性位点的选择 在人类基因组序列第37 版(http://grch37.ensembl.org/Homo_sapiens/Info/Index)下载NOS1AP基因染色体位置信息,将位置信息输入到千人基因 组 数 据(http://www.internationalgenome.org/vcf-pedconverter#online-version)中进行转换;选择中国北京汉族(Chinese Han origin in Beijing,CHB)人群,chr11:2763301~27699871, 导 出ped 和info 文 件, 导 入Haploview 4.2 单倍型分析软件,以相对连锁不平衡系数r2>0.8、次等位基因频率>20%为标准选择标签多态性位点。结合既往文献研究结果进一步进行筛选,最终选择NOS1AP 基 因 非 编 码 区 的rs12742393、 rs4145621、rs1415263位点(图1)。
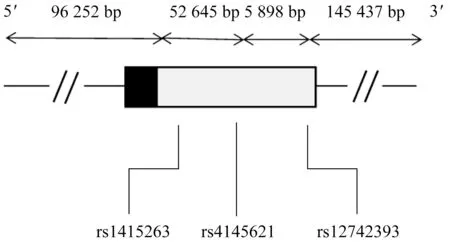
图1 NOS1AP基因中多态性位点Fig 1 Location of polymorphism loci in NOS1AP gene
1.2.4 等位基因和基因型检测及频率分析 采用美国Applied Biosystems TaqMan 检测试剂盒对NOS1AP 基因rs12742393、rs4145621 和rs1415263 位点进行分型。通过SHEsis在线软件[8]对EOS组、non-EOS组和HC组3个多态性位点进行哈迪-温伯格(Hardy-Weinberg,H-W)平衡检验以及等位基因和基因型频率分析。确定等位基因和基因型频率分布差异有统计学意义的多态性位点(阳性位点)。
1.2.5 遗传模型的分析 利用SNPstats 在线工具进行最优遗传模型的分析,采用似然比检验(likelihood ratio test,LRT)评估不同模型间的拟合优度。利用SNPstats在线网站将相对复杂的模型(显性、隐性、超显性遗传模型)与一个简单的模型(共显性模型)进行比较,根据P<0.05 的情况下阿凯克信息准则(Akaike information criteria,AIC)值进行最优遗传模型判断;AIC 值越小,模型越精确,可视为最优遗传模型。
1.2.6 阳性位点变异引起编码RNA 和蛋白质二级结构变化的预测 采用RNAfold 在线软件预测阳性位点变异对NOS1AP基因的初级转录产物二级结构的影响,分别对不同等位基因的RNA 空间结构进行模拟和比对及自由能计算。利用DNAstar软件预测蛋白质二级结构,主要对α螺旋、β 折叠、β 转角、无规卷曲所占比例进行预测。由于NOS1AP蛋白与免疫功能相关,为进一步探究NOS1AP基因的功能,利用软件预测的方法来研究NOS1AP 基因多态性对T 细胞抗原表位的影响。细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)抗原表位通过CTLpred在线软件预测,辅助T 细胞(helper T cell,Th)表位利用ProPred在线软件预测。
1.3 统计学分析
采用SPSS 13.0软件进行统计学分析。定量资料以x±s表示,组间比较采用单因素方差分析;定性资料以n(%)表示,组间比较采用χ2检验。等位基因和基因型频率分布差异有统计学意义的进一步采用Bonferroni 法进行校正。纳入样本的统计效能通过Quanto 1.2.4 软件计算,本研究统计效能>0.8。P<0.05认为差异有统计学意义。
2 结果
2.1 一般人口学资料
研究共入组333 例EOS 患者、491 例non-EOS 患者和901 例HC 样本。各组对象性别和年龄的分布均符合正态分布,统计分析结果显示3 组对象的性别和年龄均匹配(P>0.05,表1)。
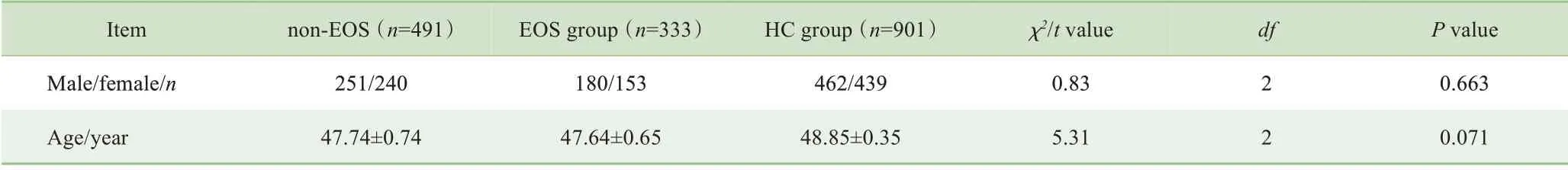
表1 EOS组、non-EOS组与HC组一般人口学资料的比较Tab 1 Comparison of general demographic data among EOS group,non-EOS group and HC group
2.2 H-W平衡检验
使用SHEsis在线软件对EOS组、non-EOS组和HC组的3 个位点基因型频率分布进行H-W 平衡检验,结果显示EOS 组、non-EOS 组和HC 组3 个位点基因型频率分布均符合H-W 平衡检验(P>0.05),故将3 个位点的基因型和等位基因数据纳入后续分析。
2.3 NOS1AP基因型和等位基因频率分布的比较
使用SHEsis在线软件对符合H-W平衡的3个多态性位点的等位基因和基因型频率进行病例-对照关联分析。结果显示:EOS 组与HC 组rs12742393 位点等位基因及基因型频率分布差异均有统计学意义(χ2=8.22,df=1,P=0.004;χ2=8.66,df=2,P=0.013);EOS 组与non-EOS 组,non-EOS 组与HC 组3 个位点等位基因及基因型频率分布差异均无统计学意义(均P>0.05)。详见表2~4。经Bonferroni校正后,EOS 组与HC 组rs12742393 位点等位基因及基因型频率分布差异仍有统计学意义(χ2=8.22,df=1,P=0.012;χ2=8.66,df=2,P=0.039),说 明NOS1AP 基 因rs12742393位点与EOS的发病显著相关。
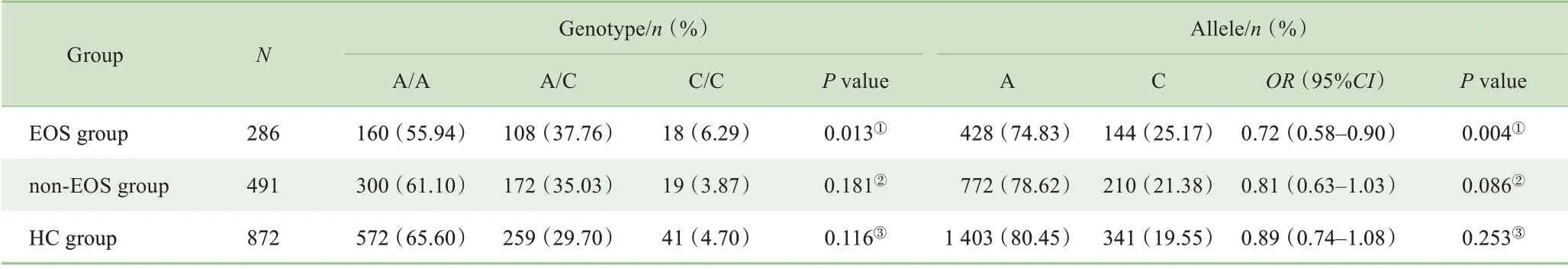
表2 EOS组、non-EOS组和HC组rs12742393位点等位基因和基因型的频率分布Tab 2 Frequency distribution of alleles and genotypes of rs12742393 in EOS group,non-EOS group and HC group
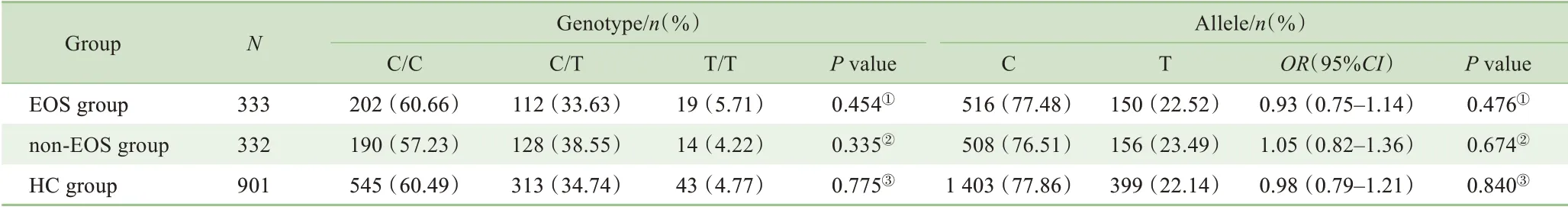
表3 EOS组、non-EOS组和HC组rs4145621位点等位基因和基因型的频率分布Tab 3 Frequency distribution of alleles and genotypes of rs4145621 in EOS group,non-EOS group and HC group
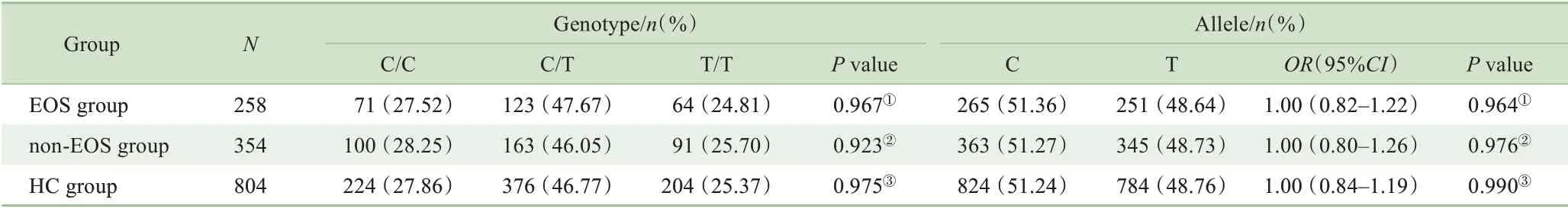
表4 EOS组、non-EOS组和HC组rs1415263位点等位基因和基因型的频率分布Tab 4 Frequency distribution of alleles and genotypes of rs1415263 in EOS group,non-EOS group and HC group
2.4 最优遗传模型的预测
分析rs12742393位点在显性、隐性、超显性和共显性4 个不同遗传模型下所得的P 值和AIC 值,结果发现共显性和显性遗传模型AIC 值最小,其值为1 290.10,但是同等情况下显性遗传模型P 值为0.004,共显性遗传模型P值为0.014,说明显性遗传模型为最优遗传模型(表5)。
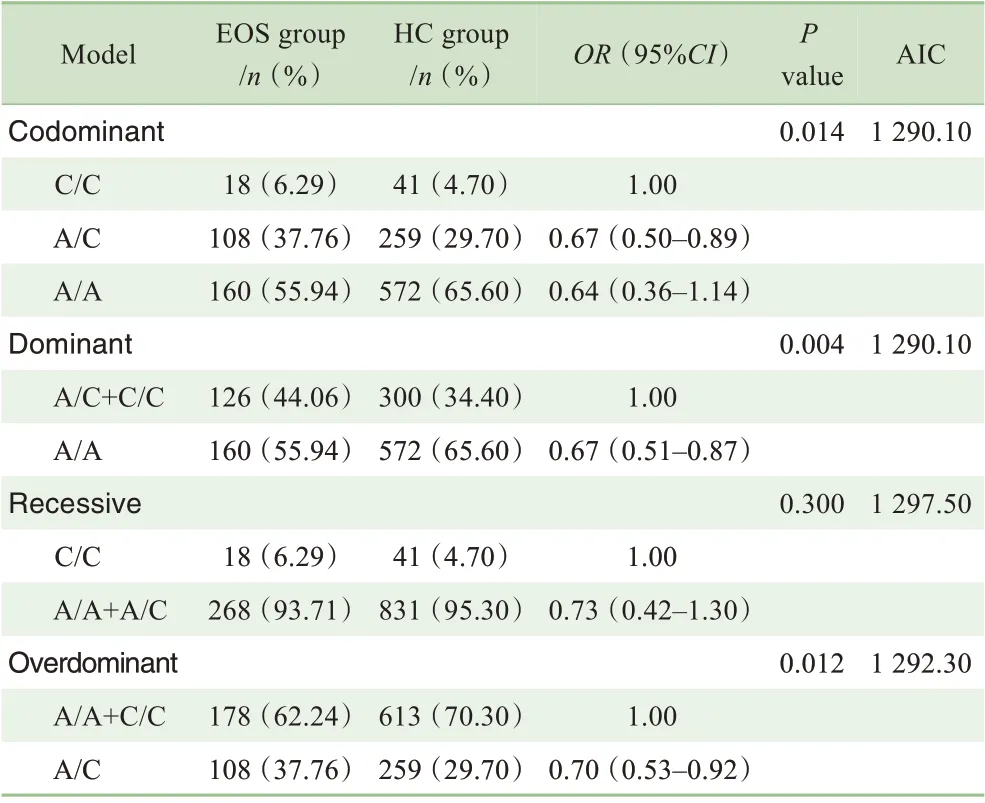
表5 rs12742393位点最优遗传模型的预测Tab 5 Prediction of rs12742393 locus optimal genetic model
2.5 NOS1AP基因编码RNA和蛋白质的二级结构预测
利用RNAfold在线软件对NOS1AP基因的初级转录产物二级结构进行预测,结果发现NOS1AP基因rs12742393位点为C 碱基(RNA 上为G)时,较A 碱基(RNA 上为U)具有更大的自由能,同时在多态性位点附近的空间结构也发生一些改变,包括位点在内的环状结构由1个小环变成了1个大环,下游的2个大环变成了2个小环(图2)。表明野生型与突变型RNA 二级结构明显不同,突变型所需自由能更大,更不稳定。因此rs12742393位点C危险等位基因会影响NOS1AP基因RNA二级结构的稳定性。
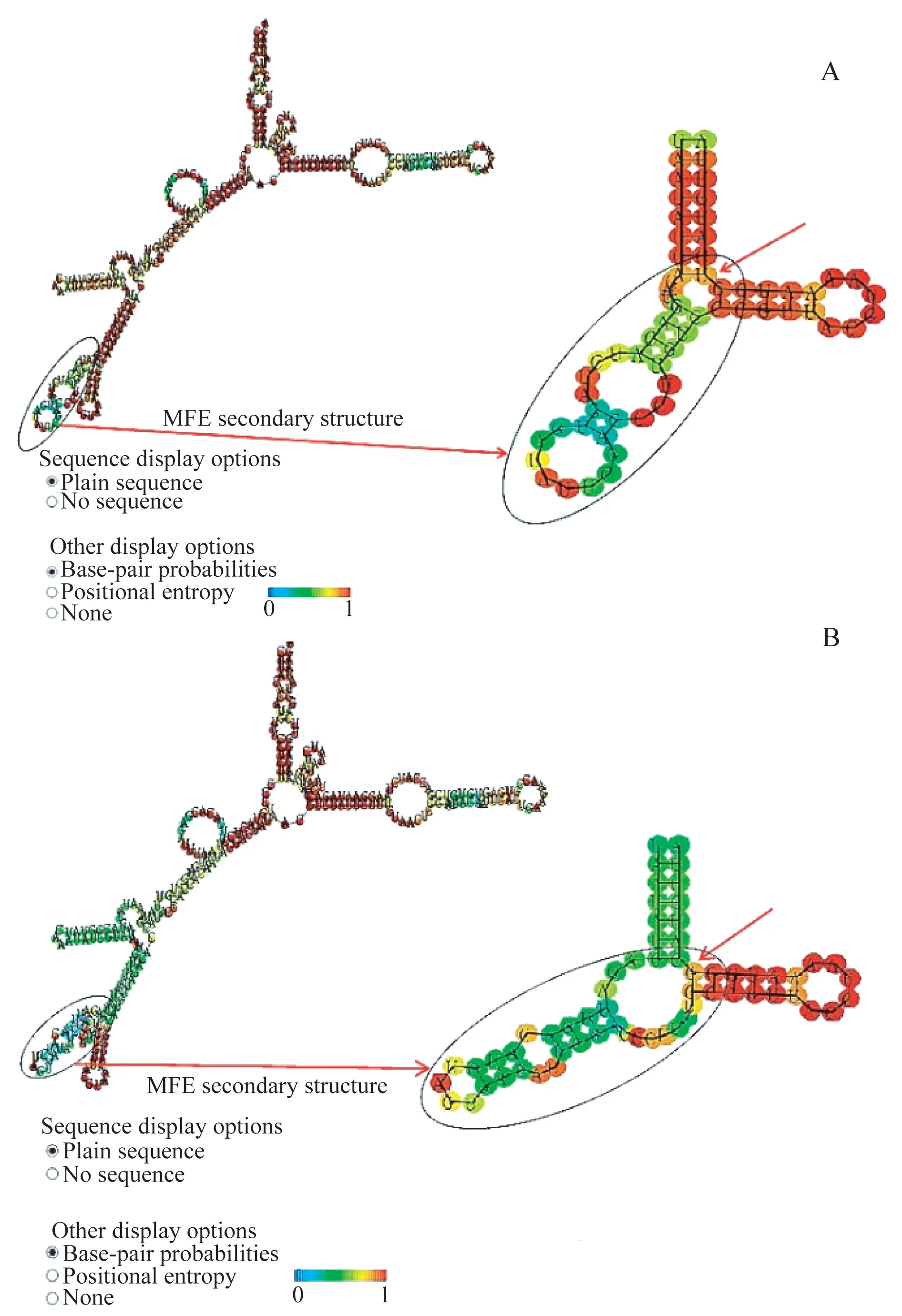
图2 RNAfold在线软件对NOS1AP基因编码RNA二级结构的预测示意图Fig 2 Schematic diagram of the secondary structure of RNA of NOS1AP gene predicted by RNAfold online software
NOS1AP 蛋白、主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ复合物和MHC-Ⅱ复合物在中枢神经系统神经元生长和发育中发挥重要作用。NOS1AP 蛋白对于MHC 分子结合配体发挥重要衔接作用。蛋白质二级结构预测软件发现rs12742393位点为A碱基时,其编码的MHC-Ⅰ复合物和MHC-Ⅱ复合物配体结合区域α1 结合NOS1AP 蛋白第50 位氨基酸为色氨酸;当为C 碱基时,MHC-Ⅰ复合物和MHC-Ⅱ复合物配体结合区域α1 结合NOS1AP 蛋白第50 位氨基酸为丙氨酸(表6)。氨基酸的不同可能会影响MHC 复合物与受体结合的亲和力。二级结构空间构象的组成比例:A 碱基时,α螺旋17.02%,β折叠28.72%,β转角88.51%,无规卷曲45.74%;C 碱基时,α 螺旋15.96%,β 折叠30.85%,β 转角8.51%,无规卷曲44.68%。蛋白质二级结构的空间构象主要依靠α 螺旋的氢键的作用力。当NOS1AP 基因rs12742393 位点为C 碱基时,α 螺旋比例下降,从而导致蛋白质二级结构稳定性下降。因此,软件预测发现NOS1AP 位点多态性会影响其RNA 和蛋白质二级结构的稳定性以及MHC复合物与配体结合的亲和力。
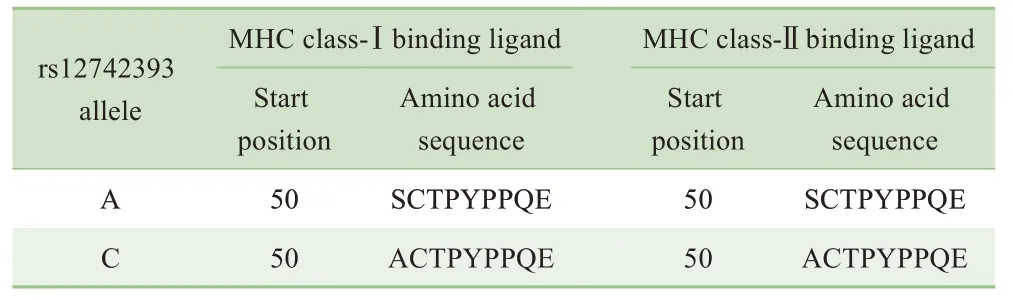
表6 DNAstar在线软件对NOS1AP基因翻译的氨基酸序列的预测Tab 6 Translated amino acid sequence of NOS1AP gene predicted by DNAstar online software
3 讨论
NOS1AP 基因位于1 号染色体,包含10 个外显子[9]。既往研究[10]发现精神分裂症在神经发育过程中存在各种障碍,包括树突分支的变化、树突回缩或缺失、棘的数量或形态的变化。而NOS1AP 蛋白对神经元发育过程中树突的生长和棘的发育起着重要的作用[11]。因此,NOS1AP基因多态性与精神分裂症的关联研究值得关注。
本研究结果发现EOS 组和HC 组之间NOS1AP 基因rs12742393 位点的等位基因和基因型频率分布存在差异,表明NOS1AP 基因rs12742393 位点与EOS 存在显著关联,但是与non-EOS关联性不明显;而rs4145621和rs1415263位点与EOS 和non-EOS 的发病均无显著关联。同时SNPstats在线软件分析发现rs12742393位点最优遗传模型为显性遗传模型,说明A/A 基因型患者较A/C、C/C 基因型患者EOS 发病风险降低(OR=0.67,95%CI=0.51~0.87)。本研究与国内外诸多研究结果存在异同。Wratten等[12]的研究纳入24 个欧裔加拿大精神分裂症家系,检测NOS1AP 基因60 个多态性位点与精神分裂症的连锁不平衡的后验概率 (posterior probability of linkage disequilibrium,PPLD),结果发现3 个多态性位点PPLD>40% (rs12742393 为 41.90%, rs4145621 为 44.50%,rs1415263 为49.70%)。Ramirez 等[13]在22 个凯尔特人和1 个德国人中进行NOS1AP 基因与精神分裂症的关联研究,发现rs12742393 位点及另外4 个多态性位点(rs4557949、rs11584803、rs4145621、rs12084492)的单倍型的连锁不平衡与精神分裂症的发病显著相关。Brzustowicz 等[14]在24 个加拿大家族精神分裂症家系样本中检查了1q22 染色体最强连锁的区域,以寻找连锁不平衡的证据。该研究通过D1S1653 和D1S1677 之间5.4 Mbp 区域的14 个微卫星和15 个多态性位点与精神分裂症的关联分析,发现精神分裂症与2 个微卫星和6 个多态性位点之间存在连锁不平衡(P<0.05);与精神分裂症具有显著连锁不平衡的多态性位点均属于NOS1AP 基因,使NOS1AP 基因成为1q22 上与精神分裂症易感性显著相关的基因,但未发现任何精神分裂症相关变异存在于NOS1AP 基因外显子,均存在于非编码区。Puri 等[15]选择英国450 例精神分裂症和450 例对照样本检测NOS1AP基因与精神分裂症的相关性,结果没有发现与精神分裂症相关的等位基因或单倍型的证据。分析Puri等[15]的研究与国内外其他研究的不同,原因可能为:①不同种族的人群等位基因的频率存在差异。rs12742393 A等位基因的频率在高加索地区的人群中约为40%,在亚洲人群中约为70%,而在非洲人群中约为80%[16]。rs1415263、rs4145621位点在不同种族的人群中频率也存在显著差异。②精神分裂症可能是多基因遗传性疾病,单个基因的作用比较微弱,多个基因的微效作用共同作用导致疾病的发生[17]。
通过二级结构预测软件发现,rs12742393位点的多态性可能影响NOS1AP 基因转录产物二级结构的稳定性。蛋白质软件预测发现rs12742393 位点碱基变异会改变氨基酸序列,可能导致蛋白质二级结构的稳定性或MHC 复合物配体与受体结合的亲和力受到影响。经预测,NOS1AP基因上的rs12742393位点多态性可能会影响转录产物序列和蛋白质二级结构的空间稳定性,进而影响基因的表达。本研究与国外某项研究有共同之处。Wratten等[12]用包含每个NOS1AP 多态性位点的等位基因变异体、NOS1AP 启动子的荧光素酶报告基因载体转染2 种人类神经细胞系(SK-N-MC 和PFSK-1),结果发现在2 种细胞中携带rs12742393 A 等位基因的质粒表达水平显著高于携带C 等位基因的质粒表达水平,差异具有统计学意义。该多态性位点等位基因的变异改变了核蛋白结合区域的DNA,从而改变了转录因子与其结合区域的亲和力,进而影响蛋白的表达水平。细胞学实验也证明,转录因子与其结合区域的亲和力改变会影响基因的表达水平。
综上所述,本研究支持NOS1AP 基因作为汉族人群EOS 的易感基因,且rs12742393 位点多态性可能会影响转录产物和蛋白二级结构的稳定性。然而研究仍存在一些局限性:①未包括NOS1AP 基因所有标签多态性位点,在今后的研究中可适当增加位点,在汉族人群中更加全面地评估NOS1AP 基因与精神分裂症的相关性。②仅采用二级结构预测软件来分析rs12742393 位点变异对转录产物和蛋白质空间结构的影响,未来需继续深入开展细胞学或动物学研究以验证预测结果,并进一步探索NOS1AP基因及其转录产物在精神分裂症发生过程中的病理生理机制。

