黄芫花黄酮提取物的制备及抗氧化活性研究
王雯皓 ,梁雪 ,焦莹莹 ,李石飞 ,张立伟
(1.山西大学分子科学研究所化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西大学中医药现代研究中心,山西 太原 030006)
0 引言
瑞香科植物河朔荛花(WikstroemiaChamaedaphneMeisn.)的干燥花蕾黄芫花产于山西、陕西、河北等地。始载于《图经本草》,《中华本草》及《本草纲目》等也有记载和描述,收载于《山西省中药材标准》1987年版和《中国药典》1977年版一部[1]。黄芫花主要用于治疗水肿、痰饮胀满及现代医学中的急慢性肝炎等[2],以黄芫花为主的中成药芫蒿护肝片用于解毒护肝,治疗肝脏损害导致的肝区疼痛、失眠、急慢性病毒性肝炎等,其独特的功效能显著改善慢肝患者的临床症状和体征,促进胆汁分泌,加速胆汁排泄,提高机体抵抗力[3]。
乙型肝炎病毒(hepatitis B virus,HBV)是一种DNA病毒,感染肝的闭合环状双链。据世界卫生组织统计,目前全球超过20亿人感染HBV[4],其治疗有抗病毒、对症治疗和抗氧化等[5]。治疗乙肝的药物除替诺韦福、恩替卡韦等核苷或核苷酸类似物外还包括大量中药,如半枝莲、大黄、黄芩等,中药中的黄酮类物质在抗HBV方面有较高活性,大黄与黄芩中提取出来的汉黄芩素在治疗指数方面有较高的价值[4]。张世军等得到的具有较高抗氧化活性的化合物也具有抗HBV的作用[6],黄酮抗氧化被认为是黄酮抗乙肝的作用机制之一。
本课题组在之前的研究中,对黄芫花(山西绛县)进行了化学成分研究,得到了系列新颖的二萜类成分,并对其进行抗乙肝病毒活性研究,结果表明,黄芫花中二萜类成分有一定的抗乙肝病毒活性[2,7],但是活性并不高。我们推测,黄芫花中发挥抗乙肝作用的药效成分极有可能是萜类之外的物质。目前关于黄芫花化学成分研究的报道较少,除了已报道二萜外,还有黄酮类等成分报道[8-9]。本课题组前期也从中发现系列黄酮、木质素等酚类成分[3],同时我们还在分离过程获得了一富含黄酮成分的有效部位提取物。鉴于黄酮在抗氧化、抗HBV等方面的活性,因此本文对黄芫花提取物是否有抗HBV的黄酮成分这一问题进行了研究。本实验制备得到黄芫花黄酮提取物,从中分离鉴定8个黄酮化合物,分别是:isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin和 luteolin-4′-O-glucoside;并建立了简便稳定、准确可靠,可用于黄芫花中黄酮类物质质量控制的HPLC含量测定方法。FRAP法和DPPH法检测结果显示黄芫花黄酮提取物有良好的抗氧化活性,具有广泛的应用前景。
1 仪器与材料
本实验所用仪器及材料信息如表1所示。黄芫花药材(采自山西省绛县)经张峰教授(山西大学黄土高原研究所)鉴定为瑞香科荛花属植物河朔荛花的花蕾,标本(201504012A)存放于山西大学分子科学研究所。isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin 和 luteolin-4′-O-glucoside作为对照品由实验室自制,经HPLC-DAD(面积归一化法)检测纯度均大于98.0%(质量分数)。

表1 仪器、材料及生产公司Table 1 Instruments,materials and production companies
2 黄酮提取物的制备
5.0 kg黄芫花花蕾,用10倍量的纯甲醇回流提取2次,提取液减压浓缩得浸膏约3 kg,将所得浸膏加入3倍量水,用同体积的石油醚、乙酸乙酯、甲醇萃取3次,萃取液回收溶剂,减压浓缩得各萃取物。甲醇萃取部位用中压ODS反相柱进行分离,依次用质量分数10%~100%的甲醇洗脱,得到10个流分:Fr1-Fr10,其中Fr4约为30 g。取4 g Fr4组分经Sephadex LH-20分离,用70%甲醇-水洗脱,得到3个组分:P1-P3,其中P2为黄芫花黄酮提取物约3 g,本实验重复3次,薄层色谱检验结果显示,3次得到的黄酮提取物在相同的位置上显相同颜色的斑点,收率为(75.6±1.3)%,RSD值小于3%,重复性良好。
3 结构鉴定
3.1 化合物分离制备
取1 g黄芫花黄酮提取物,采用制备液相色谱,以甲醇-水为流动相,流速为1.0 mL/min,制备得化合物 1(21.0 mg)、2(20.6 mg)、3(25.5 mg)、4(25.8 mg)、5(22.5 mg)、6(26.8 mg)、7(29.1 mg)、8(88.9 mg)。
3.2 化合物结构鉴定
化合物 1:淡黄色粉末,ESI-MSm/z:471[M+Na]+,分子式为C21H20O11;1H-NMR(600 MHz,DMSO-d6)δ:4.88(1H,d,J= 7.2 Hz,H-1),6.81(1H,s,H-3),7.51(1H,d,J= 8.4 Hz,H-6),7.24(1H,d,J= 8.4 Hz,H-2′),3.73(1H,d,J= 11.4 Hz,H-6a″),12.90(1H,s,5-OH);13C-NMR(150 MHz,DMSO-d6)δ:164.4(C-2),104.0(C-3),181.8(C-4),157.4(C-5),113.6(C-6),163.2(C-7),94.1(C-8),161.5(C-9),103.8(C-10),124.7(C-1′),113.6(C-2′),147.0(C-3′),148.6(C-4′),116.0(C-5′),118.6(C-6′)。与文献[10]报道数据相符,故鉴定化合物1为isoorientin。
化合物 2:黄色粉末,ESI-MSm/z:471[M+Na]+,分子式为 C21H20O11;1H-NMR(600 MHz,DMSO-d6)δ:6.27(1H,s,H-6),6.90(1H,d,J=8.4 Hz,H-5′),4.58(1H,s,H-1″),3.89(1H,s,H-6a″),3.59(1H,s,H-6b″),3.17~3.46(3H,m,H-3″,4″,5″);13C-NMR(150 MHz,DMSO-d6)δ:164.5(C-2),102.3(C-3),177.8(C-4),98.6(C-6),161.1(C-7),107.7(C-8),156.4(C-9),103.9(C-10),121.0(C-1′),119.5(C-2′),115.2(C-5′),120.9(C-6′),74.3(C-1″),70.0(C-2″),77.5(C-3″),71.9(C-4″),62.8(C-6″)。上述数据与文献[11]基本一致,故确定化合物2为orientin。
化合物 3:黄色粉末,ESI-MSm/z:433[M+H]+,分子式为C21H20O10;1H-NMR(600 MHz,DMSO-d6)δ:13.10(1H,s,OH-5),8.02(1H,d,J= 8.7 Hz,H-2′,6′),6.89(1H,d,J= 8.7 Hz,H-3′,5′),6.77(1H,s,H-6),6.25(1H,s,H-3),4.68(1H,d,J= 9.9 Hz,H-1′);13CNMR(150 MHz,DMSO-d6)δ:164.0(C-2),102.5(C-3),182.2(C-4),156.0(C-5),98.2(C-6),162.7(C-7),104.1(C-8),162.7(C-9),104.6(C-10),121.7(C-1′),129.0(C-2′,6′),115.9(C-3′,5′),160.5(C-4′),78.7(C-1″),73.4(C-2″),70.9(C-3″),70.5(C-4″),81.9(C-5″)。以上数据和文献[12]报道类似,故确定化合物3为vitexin。
第四,重视专业课教师在人体生命科学馆中的作用。通常情况下,人体生命科学馆在正常工作日的上课时间,职业技术学校的有关班级与带教老师进行正常的教学活动。在此期间,外来人员进行参观与学习过程中,需要专门的专业课教师给以引导与讲解,一方面错开教学活动;另一方面将专业知识传授给参观人员。在非教学时间,专业课教师同样需要在人体科学馆值班,一方面指导学生的学习,进行答疑;另一方面,进行登记与管理,严格遵循人体生命科学馆的规章制度,确保人体生命科学馆的正常运行。
化合物 4:黄色粉末,ESI-MSm/z:433[M+H]+,分子式为C21H20O10;1H-NMR(600 MHz,DMSO-d6)δ:13.56(1H,s,5-OH),7.93(2H,d,J= 8.0 Hz,H-2′,6′),6.92(2H,d,J= 8.0 Hz,H-3′,5′),6.77(1H,s,H-3),6.51(1H,s,H-8),4.58(1H,d,J= 9.0 Hz,H-1′′),3.10~4.04(5H,m,糖上质子);13C-NMR(150 MHz,DMSO-d6)δ:163.5(C-2),102.8(C-3),182.0(C-4),160.6(C-5),108.9(C-6),163.4(C-7),93.6(C-8),156.3(C-9),103.4(C-10),121.1(C-1′),128.5(C-2′,6′),116.0(C-3′,5′),161.2(C-4′),73.1(C-1′′),70.6(C-2′′),79.0(C-3′′),70.2(C-4′′),81.6(C-5′′),61.6(C-6′′)。数据和文献[13]报道一致,故确定化合物4为isovitexin。
化合物 5:黄色粉末,ESI-MSm/z:465[M+H]+,分子式为 C21H20O12;1H-NMR(600 MHz,DMSO-d6)δ:6.33(1H,d,J= 2.0 Hz,H-2′),6.13(1H,dd,J= 2.0,8.0 Hz,H-2),12.62(2H,d,J= 8.0 Hz,H-5,5′),5.44(1H,dd,J= 8.0,2.0 Hz,H-6);13C-NMR(150 MHz,DMSO-d6)δ:156.6(C-1),133.2(C-2),177.1(C-3),161.2(C-4),99.3(C-5),161.2(C-6),93.9(C-7),156.6(C-8),101.1(C-9),121.7(C-10),115.3(C-1′),145.0(C-2′),148.8(C-3′),116.0(C-4′),121.7(C-5′),101.1(C-6′)。数据归属结果和文献[14]报道相同,故确定化合物5为quercetin 3-O-β-glucopyranoside。
化合物 6:黄色针晶,ESI-MSm/z:449[M+H]+,分子式为C21H20O11;1H-NMR(600 MHz,DMSO-d6)δ:7.51(1H,dd,J= 8.4,2.4 Hz,H-6′),7.50(1H,d,J= 2.4 Hz,H-2′),6.82(1H,s,H-3),6.50(1H,d,J= 1.8 Hz,H—6),5.07(1H,d,J= 7.2 Hz,H-1″);13C-NMR(150 MHz,DMSO-d6)δ:163.2(C-2),104.0(C-3),181.8(C-4),161.4(C-5),99.0(C-6),163.2(C-7),94.1(C-8),157.4(C-9),105.5(C-10),124.7(C-1′),113.6(C-2′),146.9(C-3′),151.9(C-4′),116.0(C-5′),118.5(C-6′),100.1(C-1″),73.2(C-2″),77.3(C-3″),69.8(C-4″),76.1(C-5″),60.0(C-6″)。波谱数据和文献[15]报道相同,故确定化合物6为cynaroside。
化合物 7:淡黄色粉末,ESI-MSm/z:471[M+Na]+,分子式 C21H20O11;1H-NMR(600 MHz,DMSO-d6)δ:3.26(2H,m,H-2′′,3′′),3.44(1H,m,H-5′′),3.71(1H,d,J= 10.8 Hz,H-6b′′),5.07(1H,d,J= 7.2 Hz,H-1′′),6.44(1H,d,J= 1.8 Hz,H-6),6.78(1H,d,J=1.8 Hz,H-8),6.75(1H,s,H-3),6.90(1H,d,J= 8.4 Hz,H-5′),7.42(1H,d,J= 1.8 Hz,H-2′),7.45(1H,dd,J= 8.4,1.8 Hz,H-6′),12.99(1H,s,5-OH);13C-NMR (100 MHz,DMSO-d6)δ:164.6(C-2),103.2(C-3),182.0(C-4),163.0(C-5),99.6(C-6),161.3(C-7),94.8(C-8),157.1(C-9),105.4(C-10),121.5(C-1′),113.6(C-2′),145.9(C-3′),150.1(C-4′),116.1(C-5′),119.3(C-6′),99.6(C-1′′),73.2(C-2′′),76.5(C-3′′),69.6(C-4′′),77.3(C-5′′),60.7(C-6′′)。以上数据符合文献[16]报道,故确定化合物7为astragalin。
化合物 8:黄色针晶,ESI-MSm/z:471[M+Na]+,分子式 为 C21H20O11;1H-NMR(600 MHz,DMSO-d6)δ:12.90(1H,s,5-OH),7.52(1H,d,J= 8.4 Hz,H-2′),7.25(1H,d,J= 9.0 Hz,H-5′),6.82(1H,s,H-3),6.49(1H,d,J= 2.4 Hz,H-8),6.20(1H,d,J= 2.4 Hz,H-6),4.88(1H,d,J= 7.2 Hz,H-1″);13C-NMR(150 MHz,DMSO-d6)δ:164.5(C-2),104.0(C-3),181.7(C-4),161.4(C-5),99.0(C-6),163.2(C-7),94.0(C-8),157.4(C-9),104.0(C-10),124.7(C-1′),113.6(C-2′),146.9(C-3′),148.5(C-4′),116.0(C-5′),118.5(C-6′),101.2(C-1″),73.2(C-2″),77.3(C-3″),69.8(C-4″),75.8(C-5″),60.7(C-6″)。与文献[17]比对结果表明化合物 8为 luteolin-4′-O-glucoside。
4 含量测定
4.1 色谱条件
分析柱为Venusil XBP Polar-Phenyl色谱柱(250 mm×4.6 mm,5 μm),0.4%磷酸水(A)-甲醇(B)为流动相,梯度洗脱(0~27 min,35%B;27 min~40 min,35%~48%B;40 min~47 min,48%~35%B),检测波长 254 nm,柱温 30℃,流速1.0 mL/min,进样体积为 10 μL。
4.2 对照品溶液的配制
分别取8种对照品isoorientin,orientin,vitexin,isovitexin,quercetin 3-O- β-glucopyranoside,cynaroside,astragalin 和 luteolin-4′-O-glucoside 适量,加入甲醇制成浓度分别为0.97,1.02,0.98,1.00,1.05,0.95,0.97,1.10 mg/mL的对照品储备液。分别取上述储备液适量,用甲醇配置得混合对照品溶液。
4.3 供试品溶液的制备
取黄芫花黄酮提取物适量(约5.0 mg),用甲醇溶解,得到黄芫花黄酮提取物质量浓度为5.00 mg/mL,过滤,即得供试品溶液。
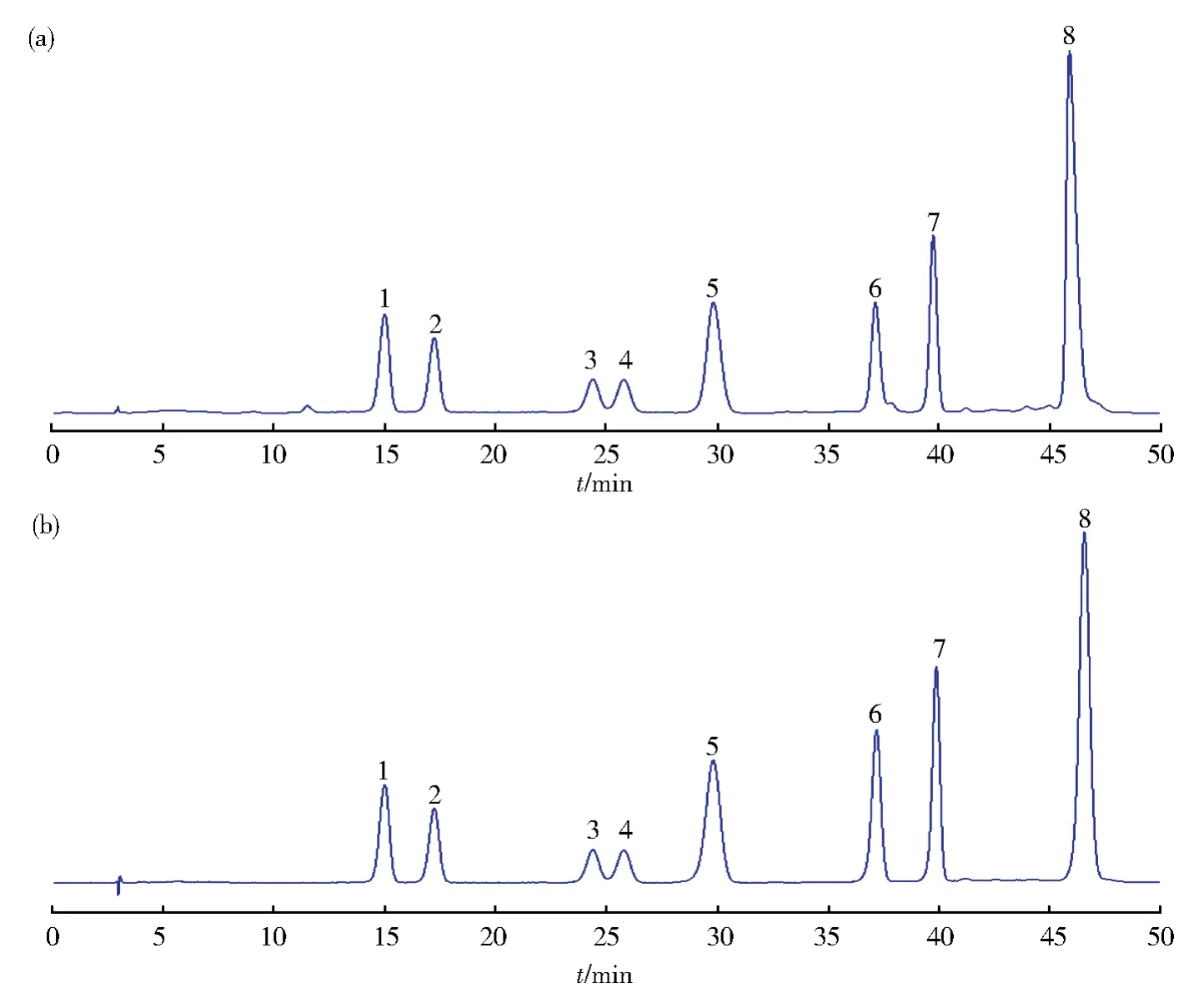
图1 黄芫花黄酮提取物(a)和混合对照品(b)溶液色谱图Fig.1 Chromatographic analyses of the extract of Wikstroemia chamaedaphne(a)and mixed control substance(b)
4.4 线性关系考察
准确吸取 0.5、2.0、4.0、5.0、6.0、8.0 mL混合对照品溶液至10 mL容量瓶,定容,按照“4.1”项下的色谱条件测定3次。线性分析结果见表2。从回归方程可知,8个对照品在一定质量浓度范围内呈现出较好的线性关系。

表2 8个化合物标准曲线Table 2 Calibration curves of the 8 flavonoids
4.5 精密度考察
取适量“4.2”项配制的混合对照品溶液,按照“4.1”项色谱方法连续进样6次,测定峰面积。结果显示 isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin和 luteolin-4′-O-glucoside峰面积的RSD分别为0.70%、0.68%、0.74%、0.77%、0.72%、0.80%、0.78%、0.75%,表明仪器的精密度良好。
4.6 重复性考察
按照“4.3”项的方法平行配制6份供试品溶液,按照“4.1”项色谱条件进测定,记录峰面积,计算含量,结果显示各份供试品溶液中isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin 和 luteolin-4′-O-glucoside RSD分别为 1.65%、1.76%、1.84%、1.81%、1.84%、1.93%、1.71%、1.46%。结果表明,上述8个化合物的重复性较好。
4.7 稳定性考察
按照“4.3”项的方法配制供试品溶液,按照“4.1”项的色谱条件在放置 0、2、4、6、12、24 h后进行测定。isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin和 luteolin-4′-O-glucoside峰面积的RSD分别为0.47%、1.71%、1.80%、1.27%、1.22%、0.62%、1.81%、1.38%。24 h内供试品溶液稳定性良好。
4.8 加样回收率试验
称取黄芫花黄酮提取物约0.005 g,精密称定,分别按质量百分含量的120%,100%,80%加入8种对照品,按供试品制备方法制得供试液,测定并计算 isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin和luteolin-4′-O-glucoside的加样回收率及RSD,在“4.1”项色谱条件下平行测定3次,8个化合物的加样回收率在100.15%~103.78%范围内。该方法回收率满足分析测定要求。
4.9 样品的含量测定
取6份黄芫花黄酮提取物,分别按“4.3”项的方法配制供试品溶液,按照“4.1”项的色谱条件进行检测,计算样品中isoorientin,orientin,vitexin,isovitexin,quercetin 3-O-β-glucopyranoside,cynaroside,astragalin和 luteolin-4′-O-glucoside的含量,结果见表3,8个化合物质量分数均在2%~8%之间,luteolin-4′-O-glucoside质量分数最高为(24.18±0.27)%,8个黄酮化合物总含量为(55.19±0.32)%。

表3 6份黄酮提取物中8个黄酮含量测定结果Table 3 Contents of 8 flavonoids in 6 flavonoid extracts
5 抗氧化活性测定
5.1 总抗氧化能力的测定
取20 μLVc、黄芫花黄酮提取物及黄酮化合物溶液,加入150 μL TPTZ工作液(300 mmol/L醋酸-醋酸钠缓冲液∶10 mmol/L TPTZ溶液∶20mmol/L FeCl3溶=10∶1∶1),混匀后 37℃恒温 30 min,读取593 nm处吸光度。不同浓度的FeSO4(0.07 μmol/L、0.16 μmol/L、0.33 μmol/L、0.49 μmol/L、0.66 μmol/L、1.32 μmol/L)测 定标准曲线,拟合得到方程y= 0.625x+0.047 9,R2=0.999 1。用同样吸光度值对应FeSO4的浓度表示Vc、黄芫花黄酮提取物及黄酮化合物溶液抗氧化活性(FRAP值)。
5.2 DPPH·清除率的测定
运用DPPH法,精密量取0.1 mmol/LDPPH乙醇溶液100 μL,再分别加入100 μL不同浓度的样品溶液(溶剂为50%乙醇溶液)中,摇匀,反应条件为避光10 min,测定波长为517 nm。DPPH·清除率Y=1—(A1—A2)/(A3—A4)×100%。式中A1、A2、A3、A4分别表示DPPH溶液与样品溶液、样品溶液与乙醇溶液、50%乙醇溶液与DPPH溶液、50%乙醇溶液与乙醇溶液混合的吸光度值,Vc作为阳性对照。
5.3 实验结果
8个黄酮及黄酮提取物总抗氧化能力和DPPH·清除率测试结果见表4。
表4 8个黄酮及黄酮提取物总抗氧化活性和DPPH·清除能力测试结果(±s,n=3)Table 4 Total antioxidant activity and DPPH free radical-scavenging of 8 flavonoids and flavonoid extracts(±s,n = 3)

表4 8个黄酮及黄酮提取物总抗氧化活性和DPPH·清除能力测试结果(±s,n=3)Table 4 Total antioxidant activity and DPPH free radical-scavenging of 8 flavonoids and flavonoid extracts(±s,n = 3)
名称isoorientin orientin vitexin isovitexin quercetin 3-O-β-glucopyranoside cynaroside astragalin luteolin-4′-O-glucoside黄芫花黄酮提取物Vc FRAP值/(μmol/mL)0.63±0.06 0.52±0.11 0.20±0.14 0.19±0.09 0.62±0.08 0.84±0.14 0.20±0.11 0.19±0.09 0.35±0.15 0.64±0.05 DPPH清除率IC50/(μg/mL)6.22±0.15 6.93±0.23 149.56±0.52 140.47±0.99 8.50±0.41 4.03±0.35 138.79±0.26 55.87±0.34 15.19±0.52 4.68±0.11
总抗氧化实验结果显示8个黄酮化合物及黄酮提取物 FRAP 值在 0.19 μmol/mL~0.84 μmol/mL范围内,能够将Fe3+还原为Fe2+,与阳性对照Vc相比 cynaroside的FRAP值更大为(0.84±0.14)μmol/mL,即还原Fe3+能力更强,抗氧化能力更强。DPPH·清除率的测定结果表明8个黄酮化合物及黄酮提取物具有较强的DPPH·清除能力,DPPH·清除率 IC50在 4.03 μg/mL~149.56 μg/mL范围内,与阳性对照物相比cynaroside的DPPH·清除率IC50更小为(4.03±0.35)μg/mL,清除DPPH·能力更强,抗氧化活性更高。综上所述得,8个黄酮化合物及黄酮提取物抗氧化能力较强,其中cynaroside抗氧化能力优于阳性对照Vc。
6 讨论
黄芫花是山西省的一味道地药材,具有泻下逐水功效,可用于肚腹胀满,痰饮,咳逆喘满,传染性肝炎,精神分裂症,癫痫等疾病。黄芫花收载于《中国药典》1977年版一部和《山西省中药材标准》,后来不知何故被移出了《中国药典》。尽管如此,以黄芫花为主的中成药芫蒿护肝片仍收载于《国家中成药标准汇编》,具有解毒护肝功效,治疗肝脏损害导致的肝区疼痛、失眠、急慢性病毒性肝炎等主肚腹胀满;仍是目前临床上常用一味护肝中成药。然而目前关于黄芫花及芫蒿护肝片的化学成分、药效和药理等研究都非常少。前期我们对黄芫花中的二萜类成分进行了研究,从中分离鉴定一系列二萜成分,并对其进行抗乙肝病毒活性研究,但结果显示这些二萜类的抗乙肝病毒的活性并不高。除了二萜成分外,黄芫花中还存在大量的黄酮类成分,因此,本文对黄芫花中的黄酮类成分进行了研究。
本文首先通过提取和富集技术,对黄芫花中的黄酮类成分进行了富集,获得富含黄酮类的黄芫花提取物。然后通过柱色谱分离,波谱数据分析,从该提取物中分离鉴定主要的八个黄酮成分,分别为isoorientin、orientin、vitexin、isovitexin、quercetin 3-O-β-glucopyranoside、cynaroside、astragalin、luteolin-4′-O-glucoside。同时以这8个标准品建立了同时测定8个黄酮含量的HPLC方法,对三批黄酮提取物进行测定后,结果显示黄芫花黄酮提取物中总黄酮含量为(55.19±0.32)%,其中 luteolin-4′-O-glucoside的含量最高,达到了(24.18±0.27)%。以上结果表明了黄芫花中确实富含黄酮类成分,同时也表明了本文所建立的同时测定8种黄酮的HPLC含量测定方法简便可靠,重复性好。
当组织器官受到外来干扰或刺激时,机体会自动产生发热、肿痛、功能障碍等炎症反应。同样地,当肝组织受到如酒精、药物、病毒等刺激后也会产生炎症反应,而炎症反应过程中一般都会诱导氧化应激反应,因此一般在治疗全身性炎症反应综合征及一般炎症治疗时都会辅以抗氧化治疗。所以,本文最后还通过总抗氧化能力和DPPH·清除率对8个黄酮及黄酮提取物进行了体外抗氧化能力测试,结果显示8个黄酮及黄酮提取物具有较强的体外抗氧化能力。此外,有研究表明提取物中orientin能抑制人肝癌 HepG2细胞增殖,促进其凋亡[19];isovitexin具有明显的抑制HBV DNA的复制活性[20],以上这些结果说明,黄芫花中的黄酮类物质可能是黄芫花治疗急慢性病毒性肝炎药效物质。不过本研究只是停留在体外的抗氧化能力测试上,除isovitexin外的黄酮类成分是否是黄芫花抗HBV活性药效物质还需要更多的研究进行证明。

