鸭疫里默氏杆菌50S L27转座子插入突变株的生物学特性分析
陈 妍,丁云竹,杨永胜,徐欣欣,王 西,宫艳杉,杜晓莉,常维山,成大荣,徐建生,胡青海
(1.扬州大学兽医学院,扬州225009;2.中国农业科学院上海兽医研究所,上海200241;3.山东农业大学动物科技学院,泰安271018)
鸭疫里默氏杆菌感染(Riemerella anatipesiferinfection)是鸭、鹅、火鸡等多种禽类的一种接触性传染病[1-2],也是当前危害全世界养鸭业的一种主要疾病,造成了较大的经济损失。目前已经确认的鸭疫里默氏杆菌血清型至少有21个[3-4],各血清型间的交叉保护性非常低,给使用疫苗防控疫病带来一定的难度。药物的使用是一些鸭场防治本病的重要手段,但是随着药物的广泛及长期使用,鸭疫里默氏杆菌耐药菌株也随之出现,导致一些鸭场在临床上采用药物治疗本病的效果显著降低。本实验室的前期研究表明,1997-2017年分离的所有鸭疫里默氏杆菌菌株都对卡那霉素耐受,但其耐受机制尚不清楚。构建细菌的转座子随机突变库是从基因组水平筛选毒力相关基因、生物被膜相关基因与特定表型相关基因等的一种重要手段[5-6]。本研究通过构建鸭疫里默氏杆菌Yb2株的转座子随机突变库,以期筛选和鉴定出鸭疫里默氏杆菌中与卡那霉素耐药相关的基因。
1 材料与方法
1.1 实验用菌株 鸭疫里默氏杆菌血清2型Yb2株由本实验室分离鉴定并保存;大肠杆菌BW19851(pEP4351)由美国University of Wisconsin-Milwaukee的Mark McBride教授惠赠,此大肠杆菌中携带的质粒pEP4351中含Tn4351转座子序列。
1.2 Yb2株Tn4351转座子随机突变库的构建和卡那霉素敏感性降低突变株的筛选 以大肠杆菌BW19851(pEP4351)为供体菌,鸭疫里默氏杆菌Yb2株为受体菌,通过接合转导的方法将质粒pEP4351导入Yb2菌株内[7],以含卡那霉素和红霉素的胰酶大豆琼脂(TSA,BD,USA)平板来筛选突变株,构建获得Yb2株的转座子Tn4351随机插入突变库。挑取突变库中的单克隆菌落在TSA平板和含有25 μg/mL卡那霉素的TSA抗性平板进行划线培养。挑取只在TSA平板生长,在含卡那霉素TSA平板上不生长的鸭疫里默氏杆菌克隆,即为卡那霉素耐药性降低的突变株。
1.3 突变株中转座子插入位点的鉴定 采用本实验室已建立的方法[8]来确定突变株中转座子插入基因组中的位置。挑取含25 μg/mL卡那霉素的TSA平板上不生长的单克隆菌,用PCR检测鸭疫里默氏杆菌的16S rRNA和ermF,双阳性的克隆为阳性结合子。然后采用基因组步移法(genomic walking kit,TaKaRa,大连)和BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)来鉴定转座子Tn4351插入基因组中的位置。
1.4 构建突变株DK-2的回复株 先以Yb2野生株基因组为模板,用PCR扩增50S L27亚基基因,连接至Promega pGEMTM-T载体后测序。再从T载体上切下50S L27亚基基因,连入大肠杆菌-鸭疫里默氏杆菌穿梭载体pRES[9],50S L27基因前面的启动子是pRES载体上的鸭疫里默氏杆菌ompA基因启动子[9],构建得到回复质粒pRES-50S L27。将此回复质粒转化到大肠杆菌BW19851中,以BW19851(pRES-50S L27)为供体菌,突变株DK-2为受体菌,采用接合转导的方法将回复质粒pRES-50S-L27导入突变株DK-2中,用PCR检测鸭疫里默氏杆菌的16S rRNA、穿梭载体pRES中携带的头孢西丁抗性基因cfxA(cfxAP1:5'-TTGTCCTGGCGAAATTGGTG-3',cfxAP2:5'-TGGTTTCCGATGTTCAGGGA-3'),以及50S L27基因来鉴定互补菌株,其表型为16S rRNA+cfxA+50S L27+,构建得到的回复菌株命名为cDK-2。
1.5 野生株Yb2、突变株DK-2及回复株cDK-2 生长曲线的测定 将野生株Yb2、突变株DK-2以及相应的回复株接种TSB(3管/菌)培养至对数生长期,按1∶100的比例转接到5 mL TSB液体中,于37℃条件下200 rpm振荡培养,分别在培养后第1、2、3、4、5、6、7、8、9、10、11、12、13、14 h时,取100 μL菌液测定OD600值,绘制生长曲线。
1.6 野生株Yb2、突变株DK-2及回复株cDK-2对卡那霉素最小抑菌浓度(minimum inhibitory concentration,MIC)的测定 采用96孔板微量法[9]来测定各株细菌的最小抑菌浓度。先在96孔板上加入100 μL浓度分别为800、400、200、100、50、25、12.5、6.25、3.125、1.5625、0.78125、0.39062 μg/mL的卡那霉素,再在每孔中加入100 μL新鲜菌液(107CFU/mL),置37℃、5% CO2培养箱中培养24 h,观察抑菌结果。
1.7 野生株Yb2、突变株DK-2及回复株cDK-2对药物敏感度的测定 将野生株Yb2、突变株DK-2和回复株cDK-2的新鲜菌液分别划TSA平板,再将药敏片均匀的贴到TSA板子上,37℃、5% CO2温箱中倒置培养20 h,观察结果。
2 结果
2.1 转座子插入Yb2株基因组中位置的鉴定 挑取PCR鉴定表型为16S rRNA+ermF+的单克隆菌,提取其基因组,用基因组步移的方法鉴定转座子插入基因组中的位置。结果显示,突变株DK-2中转座子Tn4351插入到编码50S L27的基因中(图1);序列分析表明,50S L27基因ORF全长为494 bp,插入Tn4351后,原ORF前半部分与Tn4351部分序列形成了一个234 bp的ORF,且原50S L27 ORF后半部分里的204 bp ORF仍然存在(图2)。

图1 双重PCR检测鸭疫里默氏杆菌的16S rRNA和转座子Tn4351中的红霉素抗性基因ermF鉴定阳性接合子Fig.1 Detection of 16S rRNA of Riemerella anatipestifer and ermF in transposon Tn4351 by duplex-PCR to identify positive conjugates

图2 Yb2株的 50S L27基因N端新形成的234 bp ORFFig.2 A new ORF of 234 bp formed at the N-terminal of Yb2 strain
2.2 突变株DK-2回复株的构建与鉴定 将回复质粒pRES-50S L27通过接合转导的方法导入突变株DK-2,构建得到互补菌株cDK-2。PCR检测结果表明,鸭疫里默氏杆菌16S rRNA扩增片段与预期大小一致,说明检测的菌株是鸭疫里默氏杆菌;PCR可扩增到约为1224 bp的cfxA片段,提示此鸭疫里默氏杆菌中携带穿梭载体pRES;PCR可扩增到约为300 bp的与50S L27 ORF预期大小一致的片段,提示此穿梭载体中携带50S L27 ORF。表型为16S rRNA+cfxA+50S L27+的菌株即为突变株的回复株。
2.3 DK-2、cDK-2和Yb2株的生长曲线测定 由图2可以看出,缺失株DK-2与回复株cDK-2、野生株Yb2的生长曲线差异不显著,不具有统计学意义(P>0.05)。表明缺失50S L27基因对鸭疫里默氏杆菌的生长特性无明显影响。
2.4 DK-2、cDK-2和Yb2株对卡那霉素最小抑菌浓度(MIC)的测定 采用96孔板微量法测得野生株Yb2、突变株DK-2和回复株cDK-2对卡那霉素的MIC分别为400 μg/mL、50 μg/mL和400 μg/mL。可见50S L27亚基中转座子的插入使其菌株对卡那霉素的敏感性由完全耐受变为具有一定的敏感性。
2.5 Yb2、DK-2、cDK-2株的药敏试验结果 由图3和表1可看出,回复株cDK-2和野生株Yb2的卡那霉素抑菌圈直径为0 mm,突变株DK-2的卡那霉素抑菌圈直径为10 mm,即对卡那霉素有一定的敏感性。2018年本实验室鉴定到1株鹅源鸭疫里默氏杆菌SC-17株对卡那霉素高度敏感(抑菌圈直径37 mm;另文发表),提示鸭疫里默氏杆菌卡那霉素抗性基因并不是原先认为的保守基因;而突变株DK-2对卡那霉素敏感性仍属于耐药(抑菌圈直径为10 mm,<13 mm),且对新霉素和利福平的敏感性也增强(表1),但与野生株Yb2相比,突变株DK-2对头孢类和青霉素类等抗生素的敏感性差异不显著。由以上结果可看出,鸭疫里默氏杆菌50S L27亚基基因并不是卡那霉素抗性基因,而可能是50S L27亚基插入Tn4351转座子后影响细菌蛋白质合成等因素致使鸭疫里默氏杆菌对卡那霉素、新霉素和利福平的敏感性增强。突变株DK-2和回复株cDK-2对红霉素耐受是由于Tn4351转座子中携带红霉素抗性基因ermF而导致的。

图3 亲本株Yb2株、突变株DK-2和其回复株cDK-2的生长曲线Fig.3 The growth curve of wild type strain Yb2, mutant DK-2 and the complemented strain cDK-2
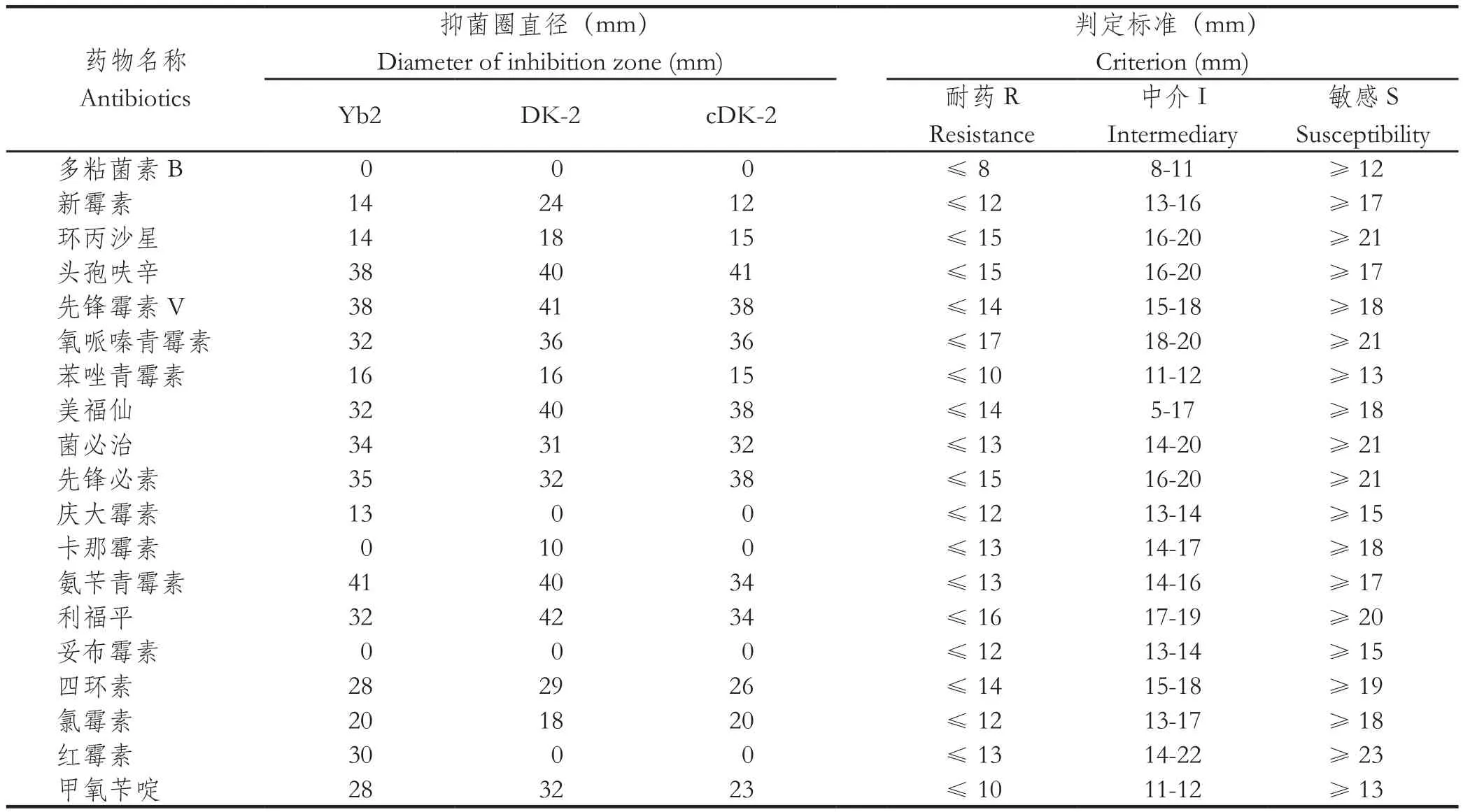
表1 药敏试验结果Table 1 Susceptibility of strains to antibiotics
3 讨论
细菌核糖体的沉降系数为70S,由大亚单位(50S)与小亚单位(30S)组成。50S L27亚基是大肠杆菌核糖体中最小的、也是最基本的多肽之一。缺失50S L27亚基的大肠杆菌缺失株,其生长速度比野生株降低5~6倍;进一步的研究表明,50S L27亚基与大肠杆菌核糖体的装配和功能有关[10]。鸭疫里默氏杆菌的50S L27作为核糖体的组成部分,可能与其生长有关。但本研究中筛选出的卡那霉素耐药性减弱突变株DK-2的生长与野生株Yb2相比并没有显著性差异,可能的原因:(1)在大肠杆菌上的研究表明,截断50S L27蛋白N端3个氨基酸,导致大肠杆菌的生长速度下降、氨基转移酶的活性降低等[11],我们推测鸭疫里默氏杆菌50S L27蛋白N端的功能也与大肠杆菌的类似,与细菌的生长特性等相关。由本研究的测序结果可知,转座子Tn4351虽然插入到了50S L27基因ORF中,但此ORF的N端从ATG开始的前半部分与Tn4351的部分序列形成234 bp ORF,可能此ORF中包含了核糖体50S L27亚基与细菌生长相关的结构域,此结构域没有被破坏,因此生长未受到影响;(2)原50S L27基因C端的204 bp ORF也没有破坏,可能此ORF与细菌生长特性相关;(3)鸭疫里默氏杆菌50S L27亚基与其生长特性无关;(4)其他未知的原因。

图4 突变株DK-2、野生株Yb2和回复株cDK-2对卡那霉素的抑菌圈Fig.4 Comparison of diameter of inhibition zones to kanamycin between the wild type Yb2, mutant DK-2, and complemented strain cDK-2
有很多已知抗生素的抗菌作用机制是针对细菌的翻译机器——核糖体。一般来说,这些抗生素分别在蛋白合成的不同阶段与核糖体的不同组分相结合,通过抑制这个组分的功能来抑制细菌的生长。如:大环内酯类抗生素是通过与核糖体50S亚单位的L27及L22蛋白质结合,在肽链延长阶段能促使肽酰基-rRNA从核糖体解离,从而抑制细菌蛋白质的合成[12]。在本研究中,与野生株Yb2株相比,突变株DK-2的卡那霉素药敏片直径为10 mm,即完全耐受性被打破;而且对新霉素和利福平抗生素的敏感性也增加。卡那霉素和新霉素属于氨基糖苷类抗生素,利福平属于利福平类抗生素。可能是鸭疫里默氏杆菌50S L27基因中插入Tn4351转座子后,影响突变株的蛋白质合成等,从而导致该突变株对氨基糖苷类和利福平类抗生素的敏感性增强。由于突变株DK-2的50S L27基因N端的表达及细菌的生长未受到明显的影响,进一步推测可能是转座子插入50S L27基因后,造成该蛋白的中间氨基酸受损,从而影响其功能。因此,DK-2株对卡那霉素、新霉素和利福平敏感性增强的具体机制还有待进一步研究。本研究对于解析鸭疫里默氏杆菌50S L27亚基的功能及此细菌耐药机制等有一定的意义。

