基于核酸适配体传感器快速检测鸡蛋中氟虫腈
程 慧,冯 灏,李诗瑶,刘 顺,周陶鸿,彭青枝
(1.湖北省食品质量安全监督检验研究院,湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430070;2.荆州职业技术学院,湖北 荆州 434000)
氟虫腈是1989年由法国罗纳普朗克公司生产的苯基吡唑类广谱类杀虫剂,因其可通过胃毒作用抵御害虫的抗药性,我国于1994年开始引入使用。现代毒理学研究表明,氟虫腈对害虫的神经膜氯离子通道有强烈的阻碍作用,因其属于内吸性农药,在动物性及植物性农产品中残留量日益得到关注[1-3]。食品中氟虫腈及其代谢物的残留可能会引起人体器官不同程度的损伤,国际食品法及我国食品安全标准规定氟虫腈在蛋类中限量为0.02 mg/kg,并且我国于2009年开始禁用氟虫腈。近年来氟虫腈再次得到关注,主要源于欧洲地区发现了被氟虫腈污染的鸡蛋,经过相关部门调查表明目前市场上所用消毒液中可能含有氟虫腈,养鸡场使用混有氟虫腈的消毒液后进而间接引起鸡蛋污染[4-6]。在“毒鸡蛋”事件之前,我国对于鸡蛋的污染物检测项目中未规定氟虫腈的检测方法及最大残留限量,但这并不表示我国生产的鸡蛋不存在氟虫腈的污染[7-9]。
市场监管总局在2019年12月发布了关于公开征集23 项食品快速检测方法的公告,其中13 项明确规定使用胶体金免疫法,将通过化学方法合成羧基修饰的目标分子与牛血清白蛋白键合成免疫原,胶体金免疫法的技术核心是合成羧基修饰的目标分子,即实现目标分子与羧基的连接。然而以小分子为模板形成的半抗原筛选抗体存在不确定性,每一次进行动物免疫实验的结果得出的抗体特异性存在差异,以此为基础建立的胶体金免疫法快速检测目标分子的不确定性同时也会增加。通过核酸适配体建立的比色法快速分析食品中小分子污染物是目前现场检测研究的重点项目,核酸适配体是体外合成的人工抗体,经过筛选试剂盒的分析得到与目标分子特异性结合的核酸适配体,建立适配体传感器放大识别信号直接获得目标分子的浓度,通过对识别信号的转导衍生出电化学法、荧光法、比色法等适配体传感器[10-13]。
在核酸适配体传感器中与目标分子特异性结合的适配体还有相对应的信号适配体,信号的转导可通过修饰信号适配体实现。适配体因合成的特殊性易于标记和修饰,连接活性基团后结合纳米材料和生物酶是适配体传感器实现信号放大的常用方法,将生物酶催化底物显色反应与适配体结合实现比色传感器非常符合食品中小分子污染物快速检测的要求,直接目视比色以快速判定食品中小分子污染物的含量,为食品的现场检测分析带来新的思路[13-16]。生物酶直接标记纳米材料是有限的,若将生物酶提前聚合再与纳米材料结合所达到的催化效果将远大于直接标记,同理在催化反应完成后将产物再次富集沉淀,加入终止剂分解与显色剂显色,这比直接催化底物显色更加稳定[17-19]。另外将识别小分子污染物的核酸适配体与纳米磁珠结合,使整个体系的分离与检测更加便利,进一步实现信号的放大和识别效应的加强[20]。本实验基于纳米磁珠-适配体识别鸡蛋中氟虫腈,利用金纳米粒子-聚合酶螯合物连接信号适配体与识别基质结合后,因聚合酶螯合物上聚集的脲酶可催化分解尿素,向反应体系中加入铜离子生成沉淀,加入铜离子显色剂后沉淀分解产生红色配合物,此时红色配合物的吸光度大小间接反映了与识别基质结合的氟虫腈含量大小,通过2 种纳米材料及聚合酶螯合物的信号放大,使本方法对于鸡蛋中氟虫腈的检测限可应用于食品中小分子污染物的快速检测(图1)。本实验所用检测方法目前国内外鲜见报道,但是利用聚合酶螯合物实现食品中小分子污染物快速检测分析是近几年研究信号放大降低检测限的热点[14],此检测方法的创新之处在于首次将可视化的分光检测与酶催化反应相结合实现基于核酸适配体的小分子污染物快速检测,对于其他农药或兽药的检测尚在研究探索[18-20]。

图1 基于互补链反应及聚合酶螯合物显色反应的比色分析原理示意图Fig.1 Schematic illustration of colorimetric analysis based on complementary chain reaction and chromogenic reaction of polymerase chelate
1 材料与方法
1.1 材料与试剂
鸡蛋样品 市购。
羧基磁珠(粒径1.0~2.0 mm,10 mg/mL) 美国C h a r m 生物科技有限公司;4-吗啡啉乙磺酸(2-morpholinoethanesulfonic acid,MES)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)、N-羟基丁二酰亚胺(N-hydroxy succinimide,NHS)、尿素(98%)、6-巯基己醇 美国Sigma-Aldrich公司;聚合酶螯合物 上海基因科技有限公司;氯金酸、五水合硫酸铜、三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,Tris)、盐酸、胱氨酸、碳酸钾、铜离子显色剂 国药集团化学试剂上海有限公司;氟虫腈、氟甲腈、氟虫腈砜、氟虫腈硫醚标准品 北京中科质检生物技术有限公司;聚合酶螯合物(EnVisionTM) 北京华安麦科生物技术有限公司。
实验中所用氟虫腈适配体(1)和互补适配体(2)均由上海生工生物工程有限公司提供,根据以下碱基序列定制合成:(1)5’-S H2-(C H2)6-ACGCGAATCGGAGTTGGGGGT-3’;(2)5’-NH2-(CH2)6-ACCCCCAACTCCGATTCGTCGGCT-3’。
1.2 仪器与设备
HC-100恒温混匀仪 杭州佑宁仪器有限公司;UV-1901紫外-可见分光度计 北京普析通用仪器有限公司;4500液相色谱-串联质谱 美国AB SCIEX公司。
1.3 方法
1.3.1 氟虫腈适配体的筛选
随机文库的固定:取2 nmol初筛文库与6 nmol生物素标记序列混合后,在金属浴中95 ℃水浴10 min,30 ℃振荡反应1 h,直到初始文库与生物素标记序列互补配对。进一步与链霉亲和素标记的磁珠在30 ℃条件下振荡反应1 h,用50 mmol/L pH 7.4 Tris-HCl缓冲溶液(50 mmol/L NaCl、10 mmol/L KCl、10 mmol/L MgCl2和5 mmol/L CaCl2)洗涤3 次,磁分离后除去未结合部分。正向筛选:取100 μg/kg氟虫腈溶液加入到初筛的随机文库中,在恒温振荡器中30 ℃反应1 h后,于4 ℃反应过夜,磁分离后得到氟虫腈结合的适配体上清液。反向筛选:取100 μg/kg氟甲腈、氟虫腈砜和氟虫腈硫醚混合液加入到初筛的随机文库中,在恒温振荡器中30 ℃反应1 h后,于4 ℃反应过夜,磁分离后得到未结合的适配体,再对其进行正向筛选得到结合的适配体。分离:将上清液加入2 μL 5 mg/mL糖原、50 μL 3 mol/L醋酸钠和1 400 μL无水乙醇,混匀后-20 ℃静置过夜,12 000 r/min冷冻离心10 min,弃去上清液,再加入1 mL 70%乙醇溶液复溶后12 000 r/min冷冻离心10 min,最后用100 μL无菌ddH2O复溶待用。以80、60、40 μg/kg和20 μg/kg的氟虫腈溶液重复对初筛核酸文库进行正向筛选、反向筛选[21-24]。
PCR扩增反应液体系:氟虫腈亲和性适配体模板链20 μL,20 μg/mL上、下游引物各20 μL,2h EsTaqMaster Mix (Dye) 25 μL,用无菌ddH2O补至100 μL。PCR扩增条件为三阶段循环:94 ℃变性330 s,58 ℃退火30 s,72 ℃延伸320 s。利用凝胶电泳分离和寡聚核苷酸纯化试剂盒纯化后进行测序。
1.3.2 信号适配体探针的制备
首先,将取500 μL已溶解的100 mL 1%氯金酸溶液,加入49.5 mL二级水,待该溶液加热至沸腾后边搅拌边加入1.25 mL 10 mg/L柠檬酸钠溶液,继续加热至沸腾后停止加热,冷却至室温待用。取2.0 mL制备好的金纳米粒子,加入0.1 mol/L K2CO3溶液调节pH值至8.5后与150 μg聚合酶螯合物搅拌过夜,离心除去未结合的物质。接着,取3 μg巯基化的互补适配体加入金纳米粒子-聚合酶螯合物体系中4 ℃振荡过夜,离心分离后加入巯基己醇封闭多余位点;最后得到金纳米粒子-聚合酶螯合物-信号适配体复合物,4 ℃静置过夜保存待用[25-28]。
1.3.3 磁珠与识别适配体的结合
识别氟虫腈的适配体经过氨基修饰可与羧基化磁珠通过化学键结合,利用EDC和NHS进行酰胺反应活化羧基磁珠,之后在其表面共价结合识别适配体制备反应基质。取4 μL 25 mg/mL羧基功能化磁珠,加入100 μL溶于pH 6.0 MES溶液中的2 mg/mL EDC和1 mg/mL NHS活化磁珠2 h,分离洗涤磁珠,加入10 μg识别适配体,在恒温振荡器中保持4 ℃振荡过夜,用pH 6.0 Tris-HCl缓冲溶液反复洗涤磁珠-适配体复合物,加入胱氨酸作为封闭剂,再洗涤分离得到复合物4 ℃保存待用[29-31]。
1.3.4 比色适配体传感器的信号转导
将上述实验合成的过量金纳米粒子-聚合酶螯合物-信号适配体与100 μL磁珠-适配体复合物混合,室温振荡2 h,磁分离得到信号适配体与识别适配体的结合物。进一步与100 μL不同浓度的氟虫腈溶液和鸡蛋提取液在室温振荡反应30 min,由于识别适配体与氟虫腈的特异性识别使金纳米粒子-聚合酶螯合物-信号适配体分离出来,随后向分离的探针中加入30 mmol/L尿素和20 mmol/L铜离子混合溶液100 μL,室温振荡反应10 min离心分离,加入铜离子显色溶液所得产物用于比色分析,建立吸光度与氟虫腈浓度之间的线性关系。
鸡蛋样品前处理:称取3 g打散的鸡蛋置于15 mL离心管中,加入2 mL乙酸乙酯,轻微颠倒30余次提取(颠倒不能剧烈以防乳化),4 000 r/min离心5 min,取0.5 mL有机层溶液空气吹干,用0.2 mL pH 6.0 Tris-HCl缓冲溶液复溶涡旋混匀待检。
2 结果与分析
2.1 信号探针的表征
通过柠檬酸钠还原法制备金纳米粒子,由于聚合酶螯合物中富集大量脲酶和抗体,金纳米粒子和聚合酶螯合物通过静电吸附作用结合后形成复合物,复合物与信号适配体的巯基通过Auü S键结合形成新的信号探针,实验通过透射电镜及紫外分光光度计验证复合物与信号探针的结合过程。如图2所示,金纳米粒子的平均粒径约为13 nm,连接聚合酶螯合物之后平均粒径明显增加,表明金纳米粒子与聚合酶螯合物成功结合。如图3所示,金纳米粒子在波长500 nm左右有一个特征吸收峰(曲线a),互补适配体在波长350 nm处有一个特征吸收峰(曲线c),信号探针合成后的紫外表征曲线b在波长350 nm和500 nm处均有吸收峰,证明信号探针的制备符合实验要求。
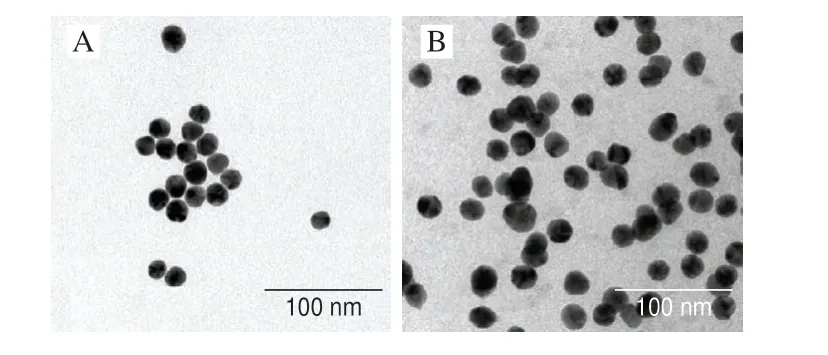
图2 金纳米粒子(A)、互补适配体探针(B)透射电镜图Fig.2 Transmission electron microscopy images of gold nanoparticles (A) and complementary aptamer probes (B)

图3 金纳米粒子紫外吸收光谱图Fig.3 UV absorption spectra of gold nanoparticles
2.2 磁珠-适配体的表征
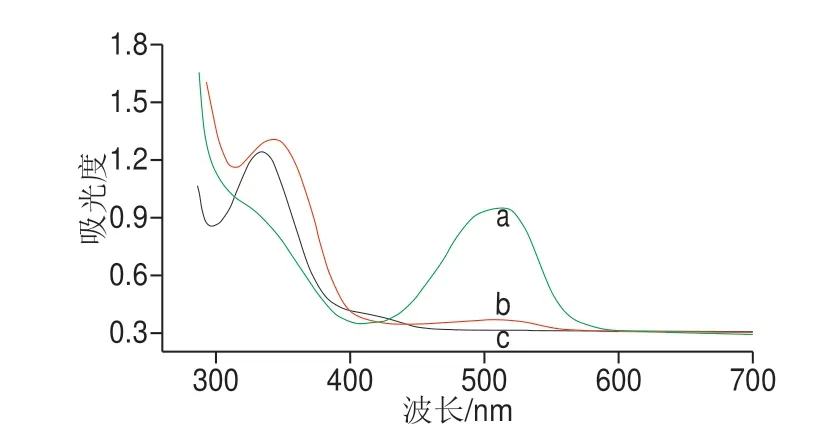
图4 50 mg/kg氟虫腈、空白对照用于比色分析的紫外-可见吸收光谱曲线Fig.4 UV-visible absorption spectra of flufenitrile at 50 mg/kg and blank control for colorimetric analysis
本方法基于适配体连接纳米磁珠进行鸡蛋中氟虫腈的分析检测,通过氟虫腈核酸适配体引发杂交链反应,并进一步结合聚合酶螯合物双功能化金纳米粒子标记物制备的纳米探针复合物,用于所得产物温育反应。基于磁珠连接的核酸适配体与其互补链之间的结合作用,使得金纳米探针得以成功捕获从而形成磁性复合物。利用该复合物上定量捕获的高含量脲酶分子的酶催化生物矿化作用,以及进一步溶解释放矿化富集的铜离子进行腙类显色剂(E)-1,2-二苯基-2-(2-(吡啶-2-基)亚肼基)乙酮E配位显色反应,从而可以成功实现本方法的比色信号转导。实验通过紫外-可见吸收光谱法考察本方法发展的上述信号转导策略对靶向分析物氟虫腈的信号响应情况。如图4所示,当将50 mg/kg氟虫腈用于比色反应后,所得显色溶液产物在波长502 nm处出现了一个很强的紫外-可见吸收峰;当没有将所得磁性复合物经过稀酸溶解处理时,所得产物溶液在300~700 nm波长范围内没有出现明显的特征吸收。同时,当在构建的磁珠平台上进行空白对照实验时,所得产物经显色处理之后只得到十分微弱的背景信号。这一结果充分证明了本磁珠分析平台上夹心免疫识别反应的成功进行以及该工作设计的比色信号转导策略的可行性。
2.3 条件优化
为了保证金纳米粒子-聚合酶螯合物纳米标记物的最佳酶催化信号转导能力,实验首先将不同用量的聚合酶螯合物和过量适配体互补链依次加入到1.5 mL制备好的金纳米粒子中进行纳米标记物的制备,然后将制备的几种不同产物分别用于50 mg/kg氟虫腈在构建的磁性分析平台上的比色分析信号转导。从图5A可以看出,实验所得显色产物的吸光度响应值首先随着聚合酶螯合物用量的增加而增大;当适配体互补链的用量大于3 μg后,显色产物的吸光度响应开始缓慢下降。导致这一现象的原因应该是:当金纳米粒子表面负载的适配体互补链量较少时,不能提供足够的脲酶以用于分解尿素产生显色物质;但是,由于金纳米粒子表面空间的制约,过量的适配体互补链则会导致制备所得的纳米标记物上聚合酶螯合物的负载量减少,从而减弱传感器的信号转导能力。本实验以3 μg适配体互补链和150 μg聚合酶螯合物作为纳米标记物制备的最佳用量。
在进行互补链反应时,充当生物识别的氟虫腈适配体用量和杂交链反应时间均为影响反应效率的重要因素。实验首先研究了在不同浓度氟虫腈适配体条件下,50 mg/kg氟虫腈在构建的磁珠分析平台上的紫外-可见光谱响应。如图5B所示,随着氟虫腈适配体用量不断增加,所得显色产物的吸光度也随之增加;当氟虫腈适配体用量大于10 μg之后,其所得显色产物吸光度开始趋向于一个稳定值。该结果说明,用量为10 μg的氟虫腈适配体足够识别磁珠平台上捕获的氟虫腈,以实现其比色信号转导。为此,将10 μg氟虫腈适配体用量用作本工作的最佳实验条件。同时,还对互补链反应时间进行优化。如图5C所示,随着反应时间的延长,所得显色产物的吸光度不断增加;当该时间延长至50 min之后,吸光度响应开始趋于稳定。这说明50 min足以使互补链反应完全进行,从而达到该方法的最佳信号转导与放大。图5D显示磁珠复合物与互补链及聚合酶螯合物修饰的金纳米粒子和氟虫腈反应时间变化对信号响应的影响,随着反应时间的延长,信号响应随之增加;当反应时间延长至30 min后信号响应强度趋于稳定,这表示适配体与氟虫腈反应饱和。因此,选择30 min作为最佳反应时间。
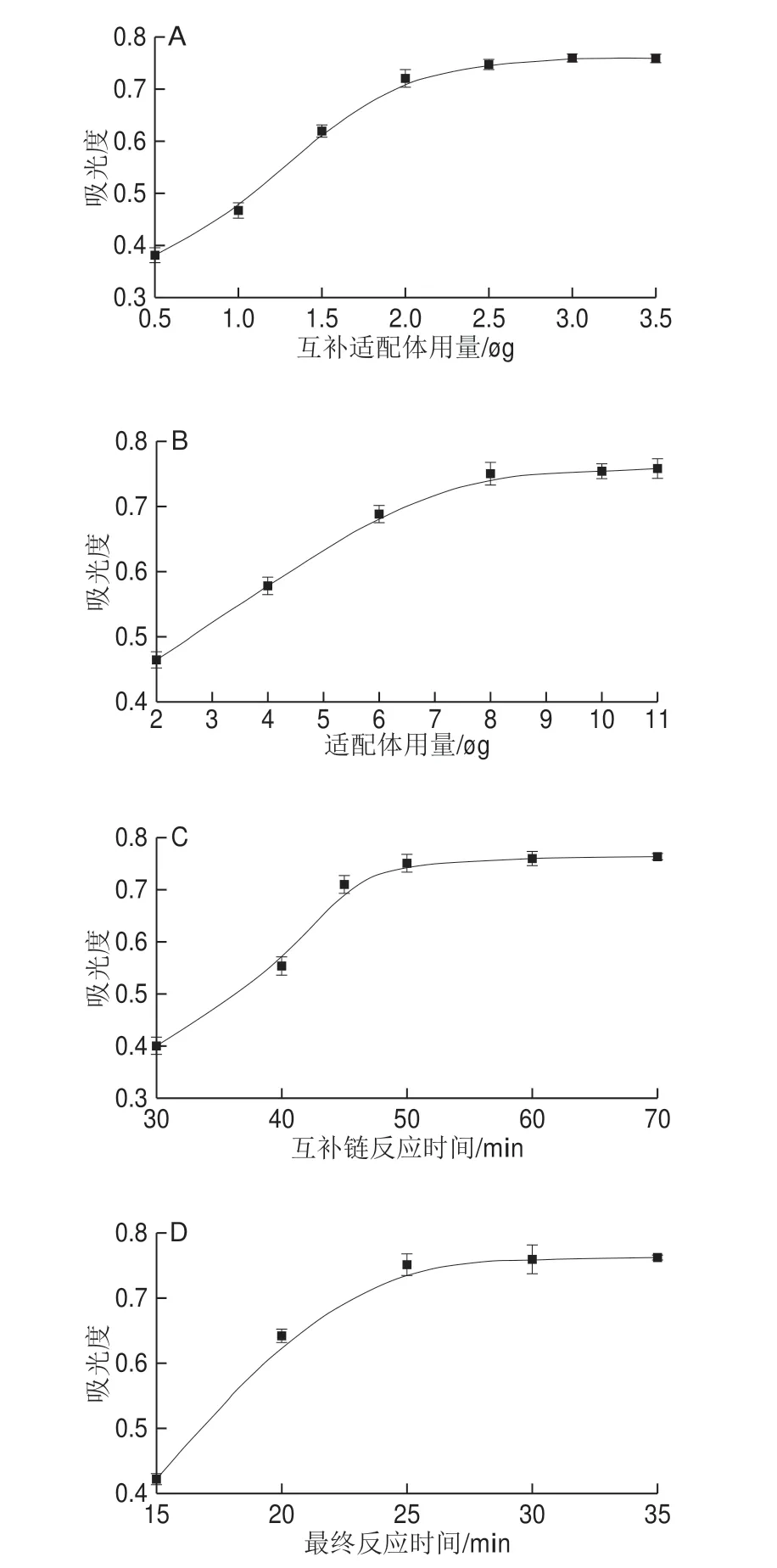
图5 各因素对50 mg/kg氟虫腈紫外-可见吸收响应的影响Fig.5 Effects of various factors on the UV-visible absorption response of flufenitrile at 50 mg/kg
2.4 性能分析
在上述最佳条件下,实验考察不同浓度氟虫腈在制备的磁性传感平台上的紫外-可见吸收光谱响应。结果表明,在0.1 μg/kg~50 mg/kg范围内,其吸光度与氟虫腈含量的对数值之间成良好线性关系,线性回归方程为A=0.582 33+0.010 21lgC,R2=0.998。在3 倍信噪比条件下,计算得到本方法的检测限为0.072 μg/kg。
2.5 特异性、重复性、稳定性和可靠性
为了进一步验证本实验开发比色适配体传感器的特异性和选择性,选择相同类型的50 mg/kg溴虫腈、氟虫脲、定虫隆、三氟氯氰菊酯作为交叉反应的目标物,日常监督抽检过程中阳性样品中此5 种农药的检出率较高,且目前用于该5 种农药的快速检测方法仍在研究中,故选择此5 种类型农药作为检验氟虫腈的特异性。实验分别考察在构建的磁珠免疫分析平台上交叉反应。从图6可以看出,氟虫腈目标分析物在磁珠平台上具有十分明显的吸收光谱响应,而溴虫腈、氟虫脲、定虫隆、三氟氯氰菊酯没有表现出较空白对照实验更为明显的信号响应。这一结果表明,该比色分析方法具有较好的特异性。为进一步证明该方法对于化学结构类似物的特异性,分别研究氟虫腈的主要代谢物如氟虫腈砜、氟虫腈亚砜、氟甲腈在含量为5 mg/kg时本方法检测结果均为阳性,说明本检测方法与GB 23200.115ü 2018《鸡蛋中氟虫腈及其代谢物残留量的测定 液相色谱-质谱联用法》同样适用于氟虫腈和氟虫腈的主要代谢物的检测。

图6 试剂空白和5 种农药在磁珠分析平台上的吸收强度响应Fig.6 Absorption intensity of reagent blank, bromozoonitrile fluolin and fluozoonitrile at 50 mg/kg on the magnetic bead analysis platform
同时,本工作还利用发展的信号策略考察不同含量氟虫腈在通过相同实验方法构建的磁珠传感平台上的重复实验结果。当氟虫腈含量分别为0.01、0.1 mg/kg和10 mg/kg时,5 次重复测定结果的相对标准偏差分别为3.6%、4.2%和2.7%。此外,制备的适配体磁珠和金纳米粒子标记物均于4 ℃条件下保存,2 周之后,将其用于含量为50 mg/kg氟虫腈的分析测定,仍然可以保持97.5%以上初始信号响应。这些结果表明,该比色免疫分析方法具有较为满意的重复性和稳定性。为进一步考察该方法的分析可靠性和准确性,实验还将其用于从农贸市场和超市购买的鸡蛋进行检测。按照1.3.4节方法处理。按照GB 23200.115ü 2018《鸡蛋中氟虫腈及其代谢物残留量的测定 液相色谱-质谱联用法》作为参考方法对样品进行检测。氟虫腈加标样品含量分别为5.0、20.0 mg/kg和50.0 mg/kg,通过本方法、传统酶联免疫和参考方法对加标前后的含量分别进行检测。如表1所示,样品回收率为93.1%~100.6%,3 种方法的检测结果一致,表明该方法用于鸡蛋中氟虫腈的检测是可行的,本方法在操作简便性和准确性上均符合市场需求,能够满足基层市场对于现场快速检测的基本需求。

表1 本方法与参考方法测定鸡蛋中氟虫腈含量结果对比Table 1 Comparison of recoveries and RSD values of fluoronitrile in spiked eggs by this method and conventional methods
2.6 传感器的假阴性和假阳性评价

表2 本方法测定鸡蛋加标样品的假阴性率和假阳性率Table 2 False negative rates and false positive rates calculated for detection of negative egg samples spiked with various concentrations of fluoronitrile by this method
将经过预处理的鸡蛋阴性样品中分别加入不同含量氟虫腈标准溶液进行检测,根据原食药总局颁布的《食品快速检测方法评价技术规范》[32]中快速检测方法性能指标计算假阴性率(假阴性总数/试验样品总数)和假阳性率(假阳性率总数/试验样品总数),每个浓度设置20 组实验,本实验阳性样品参照GB 2763ü 2019《食品中农药最大残留限量》[33]制定(蛋类中氟虫腈残留量≤0.02 mg/kg)。如表2所示,本实验构建的鸡蛋中氟虫腈快速检测方法与传统实验室检测方法相比较,得出本检测方法的假阴性率和假阳性率分别为5%和10%,符合2017年及2019年颁布的KJ系列食品快速检测方法技术要求(≤10%)。
3 结 论
基于磁珠的互补链反应、识别及显色反应,本实验成功建立一种可用于氟虫腈高灵敏检测的比色分析新方法。本检测方法基于磁珠构建分析平台简化了相关操作,从而进一步缩短温育反应时间;引入适配体可提高识别作用的特异性,为结合互补链反应和纳米标记物的酶致生物矿化作用进行分析信号的放大提供了可能性。基于铜离子的高效富集、方便释放与快速、可视化的颜色反应,进行比色信号转导策略的构建,较好弥补了传统方法中直接利用酶催化显色反应进行比色信号的检出限偏低。故本方法有望在食品中小分子污染物分析领域发挥较好的实用价值。

