抗副溶血弧菌OMPK单克隆抗体的制备及其ELISA双抗体夹心检测方法建立
王晓瑞,邱红玲,王寿利,朱海华,周 莉,平 洋,谭 静,王 永,王 慧,,*
(1.河南省商业科学研究所有限责任公司,河南 郑州 450002;2.上海交通大学医学院公共卫生学院,上海 200025;3.中国科学院上海生命科学研究所,上海 200233)
副溶血弧菌(Vibrio parahaemolyticus)是一种嗜盐革兰氏阴性杆菌,广泛存在于海水及其海产品中,大量弧菌存在于海洋藻类和动物中,如虾、鱼、双壳类、血蛤和鲑鱼等[1]。人体被弧菌感染之后会导致严重的肠胃炎,目前发现的弧菌大概有46 种,其中至少有12 种弧菌与人类感染有关,包括副溶血弧菌、创伤弧菌、霍乱弧菌、流感弧菌、溶藻弧菌等[2-8]。在弧菌科中,副溶血弧菌是许多国家引起肠胃炎的主要食源性致病菌[9-12],当人们摄入被副溶血弧菌污染的生的或未煮熟的食物时,可能会导致急性肠胃炎等相关的疾病,如腹泻、呕吐、腹部绞痛和低烧[13]。GB 29921ü 2013《食品中致病菌限量》对水产制品、水产调味品中的副溶血弧菌进行限量,具体为n=5、c=1、m=100 MPN/g(mL)、M=1 000 MPN/g(mL)。
目前用于检测副溶血弧菌的方法主要有传统检测法、聚合酶链式反应以及免疫学方法等[14]。传统检测方法对于副溶血弧菌表型鉴定通常需要结合各种生化和血清学检测的显色琼脂培养,该方法增菌时间长并且需要耗费大量人力[15]。聚合酶链式反应(polymerase chain reaction,PCR)技术具有特异性强、灵敏度高的优势,但不能有效用于常规检测[16]。免疫学方法是一种灵敏度高、操作简便的检测副溶血弧菌的方法,并且该方法不需要专门的仪器和设备[17]。夹心酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法是食品安全检测过程中常用的方法之一,该方法由于标记酶放大检测信号的作用,因此具有较高的灵敏度,同时操作过程简单、可用于大批量样品的检测,整个检测过程可以在2 h之内完成[18-19]。
单克隆抗体由于具有特异性高、均质性好及来源稳定并可大批量生产等优点,是目前疾病研究、诊断及治疗的一种常用手段,随着单克隆抗体研究及应用的深入,其在病毒性疾病和水产病原细菌性疾病的预防及诊断过程中发挥着重要作用[20]。外膜蛋白K(outer membrane protein K,OMPK)是一种位于弧菌细胞壁外膜分子质量约为28 kDa的蛋白,该蛋白具有广泛与外界接触的机会,它们之间相似性较高,是弧菌主要的表面抗原之一[21]。何彬斌等[22]通过分离纯化抗副溶血弧菌鸡卵黄免疫球蛋白建立检测副溶血弧菌的间接ELISA方法,该方法副溶血弧菌的检出限为1.0h 105CFU/mL,实验结果具有很强的特异性,能够准确对副溶血弧菌进行检测。Pinto等[23]建立了PCR-ELISA检测副溶血弧菌的检测方法,该方法的检测灵敏度较传统检测方法提高了100 倍,同时又降低与其他菌株的交叉反应,具有很好的应用前景。窦勇等[24]建立的副溶血弧菌耐热直接溶血素(thermostable direct hemolysin,TDH)毒素双抗体夹心检测方法,以TDH+副溶血弧菌菌体及TDH毒素制备免疫抗原,免疫BALB/c小鼠和新西兰大白兔制备多克隆抗体,建立双抗体夹心ELISA检测方法,检测结果在5 h内完成,并且具有很强的特异性。
本研究将副溶血弧菌外膜蛋白全长OMPK和截短OMPK1基因分别克隆到原核表达载体PET-28a中构建重组质粒PET-28a-OMPK/PET-28a-OMPK1,在感受态大肠杆菌BL21中诱导表达并纯化蛋白,免疫BALB/c小鼠制备重组外膜蛋白OMPK和OMPK1的单克隆抗体,进一步研究抗体不同标记方法及抗体片段对检测灵敏度的影响,初步优化建立副溶血弧菌间接夹心ELISA检测方法。
1 材料与方法
1.1 材料与试剂
鲑鱼(三文鱼)购于超市,血蛤购于菜市场;所有菌株均保存于中国工业微生物菌种保藏管理中心;原核表达载体PET-28a 安诺伦(北京)生物科技有限公司;感受态大肠杆菌BL21细胞 美国Promega公司;6~8 周SPF级BALB/c雌性小鼠 上海市第二军医大学。
LB培养基 北京陆桥有限公司;Immunopure®Fab Preparation Kit 美国Pierce公司;细菌基因组DNA提取试剂盒、DNA凝胶回收试剂盒 天根生化科技(北京)有限公司;DMEM高糖细胞培养基 美国Gibco公司;弗氏佐剂、十二烷基硫酸钠-聚丙烯酰氨凝胶电泳低分子质量蛋白标准 美国Sigma公司;T4 DNA连接酶、BamH I、XhoI 宝日医生物技术(北京)有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
1500-823多功能酶标仪 美国Thermo Scientific公司;电热恒温培养箱 天津泰斯特有限公司;PCR基因扩增仪、电泳仪、电泳槽 美国伯乐公司。
1.3 方法
1.3.1 副溶血弧菌OMPK基因克隆及表达载体构建
副溶血弧菌DNA提取按照细菌基因组DNA提取试剂盒(天根)操作说明进行,依据GenBank记录的弧菌OMPK基因序列,利用Primer Premier 5.0软件设计PCR扩增引物,全长OMPK基因引物Nompku:CCCGG ATCCATGCGTAA ATCACTTCTAGCTCT;Nompkd:CCCCTAGTTACAGCTACG。截短OMPK1基因引物 OMPKU:CCCGGATATTACCAATTTGGTATGG;OMPKD:CCCCTCGAGTTAGAACTTGTAAGTTAC。PCR扩增产物纯化后,用BamH I和XhoI双酶切转入PET-28a载体,T4DNA连接酶进行连接,然后分别将转化产物PET-28a-OMPK与PET-28a-OMPK1转入感受态大肠杆菌BL21细胞中,培养过夜,PCR验证及测序分析挑选阳性菌株。
1.3.2 重组蛋白的表达与纯化
阳性菌株在37 ℃培养至OD600nm约为0.6,加入1 mmol/L硫代半乳糖苷诱导重组蛋白表达,8 000hg离心5 min收集菌体,磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)重悬后冰浴超声菌体30 min,10 000hg离心10 min收取上清液。将上清液结合于Ni2+琼脂糖亲和层析柱,然后PBS洗涤10 次,重组蛋白经洗脱缓冲液(20 mmol/L Na3PO4,50 mmol/L NaCl,20 mmol/L咪唑,pH 7.4)从层析柱上洗脱下来,PBS溶液透析3 次。
1.3.3 单克隆抗体的制备与纯化
将纯化的OMPK与OMPK1重组蛋白(免疫剂量为50 µg/只小鼠)分别与等体积的弗氏完全佐剂充分混合、乳化,皮下免疫6~8 周雌性BALB/c小鼠。每隔2 周加强免疫1 次,一共免疫6 次,加强免疫将抗原与弗氏不完全佐剂1∶1混合,第3次与第6次免疫之后经Western-blotting测定血清特异性及ELISA方法测定血清效价,从OMPK与OMPK1重组蛋白中选取最佳重组蛋白进行后续的抗体制备。第6次免疫之后3 d将小鼠脱臼拉颈处死取其脾细胞,骨髓瘤细胞与脾细胞按1∶5比例充分混合,离心去除上清液,50%的聚乙二醇诱导细胞融合[25],加入含10%胎牛血清的DMEM高糖培养基终止融合。采用ELISA方法筛选阳性杂交瘤细胞制备副溶血弧菌单克隆抗体,通过有限稀释法对阳性细胞株进行亚克隆3 次,将杂交瘤细胞(106细胞/mL)注入石蜡(0.3 mL/只)预处理的小鼠腹腔中,10 d左右取小鼠腹水,腹水用饱和硫酸铵沉淀后,再经Protein-G亲和层析柱纯化。间接夹心ELISA法测定单克隆抗体效价,抗体亚型鉴定按照小鼠单克隆抗体亚型分类试剂盒说明书进行,Western-blotting检测抗体的特异性。
1.3.4 单克隆抗体Fab片段的制备及标记
单克隆抗体Fab的制备按照Immunopure®Fab Preparation Kit说明书方法操作,首先向250 µL消化缓冲液中加入250 µL木瓜蛋白酶,静置10 min,然后6 000hg离心3 min,去除上清液并重复上述步骤3 次。将平衡后的木瓜蛋白酶重悬于250 µL消化缓冲液中,然后将单克隆抗体与消化缓冲液各250 µL混合后加入到250 µL木瓜蛋白酶凝胶中,37 ℃放置8 h。用Ultrafree MC分离器从固定的木瓜蛋白酶中分离消化液,结合缓冲液(250 µL)洗涤木瓜蛋白酶凝胶,收集混合液保存于4 ℃。辣根过氧化物酶(horse radish peroxidase,HRP)标记单克隆抗体(VP3、VP4、VP5、VP6、VP16、VP17)操作方法如下:纯化后的单克隆抗体在0.1 mol/L碳酸盐缓冲液(pH 9.5)4 ℃条件下透析3 次并轻轻搅拌。10 mg NaIO4溶于0.1 mol/L碳酸盐缓冲液,0.25 mL HRP(10 mg/mL)中加入0.25 mL现配NaIO4在25 ℃黑暗条件下氧化20 min,加入100 µL乙二醇终止上述反应。将1 mL透析后的抗体与HRP混合反应3 h,然后向混合液中加入80 µL NaBH4,4 ℃条件下培养1 h。HRP标记的单克隆抗体在4 ℃条件下透析3 次并缓慢搅拌,加入等量甘油保存于-20 ℃。生物素(biotin)标记单克隆抗体操作方法如下:biotin标记方法按照EZ-Link®Sulfo-NHS-LCBiotin kit说明书操作,将1 mL 2 mg/mL的单克隆抗体与27 µL 10 mmol/L biotin混合后冰浴放置2 h,抗体中加入等量的甘油保存于-20 ℃。
1.3.5 ELISA法结合单克隆抗体检测副溶血弧菌
不同处理方式的单克隆抗体作系列梯度稀释包被于96 孔板,每个稀释度做3 个平行,每孔加入100 µL,4 ℃放置过夜。加入200 µL封闭液(10 mmol/L PBS+0.05%吐温20+5%牛血清白蛋白)封闭非特异性结合位点,加入100 µL洗涤缓冲液(10 mmol/L PBS+0.05%吐温20)洗3 次,副溶血弧菌培养至108CFU/mL,去除培养基,加入2 mL PBS煮沸15 min暴露抗原,然后每孔加入100 µL,放置37 ℃孵育1 h,加入洗涤缓冲液洗3 次[26]。
1.3.5.1 HRP标记单克隆抗体检测
将HRP标记抗体按1∶1 000比例稀释,然后取100 µL加入抗原抗体包被的96 孔板中,37 ℃孵育1 h,洗涤缓冲液洗3 次,每孔加入100 µL四甲基联苯胺反应10 min,加入1 mol/L HCl溶液终止上述反应,酶标仪测定450 nm波长处的吸光度。
1.3.5.2 biotin标记单克隆抗体检测
将biotin标记的抗体按1∶1 000比例稀释,取100 µL加入抗原抗体包被的96 孔板中,37 ℃孵育1 h,洗涤缓冲液洗6 次,然后加入100 µL磷酸对硝基苯酯反应10 min,0.5 mol/L Na2CO3溶液终止上述反应,酶标仪测定450 nm波长处的吸光度。
1.3.6 ELISA法检测海鲜样品中副溶血弧菌
取鲑鱼可食用部分用灭菌剪刀剪碎,称取25 g鲑鱼加入225 mL LB培养基放入均质器中均质30 s,然后分别接种5~10、10~25、25~100 CFU/25 g副溶血弧菌ATCC33847(平板计数法对菌落进行计数),37 ℃培养12 h。取1 mL增菌液5 000hg离心5 min,菌沉淀用1 mL PBS重悬,将菌液煮沸15 min后,用抗原抗体包被的96 孔板进行检测。血蛤从菜市场购买,称取25 g加入225 mL LB培养基放入均质器中均质30 s,37 ℃培养12 h,间接夹心ELISA方法检测副溶血弧菌。
1.4 数据处理
2 结果与分析
2.1 Western-blotting检测结果

图1 抗血清Western-blotting检测结果Fig.1 Western-blotting of the purified recombinant protein
全长及截短的OMPK/OMPK1重组蛋白用His-tag标签标记,纯化目的蛋白免疫小鼠,取小鼠血清通过Westernblotting方法检测该血清对副溶血弧菌抗原的特异性。如图1所示,全长及截短的OMPK/OMPK1重组蛋白制备的抗血清均能与副溶血弧菌裂解物起特异性反应。
2.2 血清效价测定结果
间接夹心ELISA法测定anti-OMPK(OMPK抗体)和anti-OMPK1(OMPK1抗体)血清效价。将小鼠血清分别按1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000比例稀释,小鼠血清效价结果(图2)表明,血清稀释度为1∶8 000时anti-OMPK/OMPK效价是anti-OMPK1/OMPK1的2.3 倍,对副溶血弧菌抗原(V.parahaemolyticusantigen,VPA)测定比较,anti-OMPK/VPA效价是anti-OMPK1/VPA的11.1 倍,全长OMPK重组蛋白制备的抗血清效价明显优于截短OMPK1重组蛋白制备的血清,全长蛋白分子质量大,包含的抗原位点多,具有较强的免疫原性,但是截短蛋白会失去一部分抗原表位,影响该蛋白的免疫原型,从而降低后续免疫小鼠制备的抗体与VPA的亲和力[27]。故实验选择OMPK重组蛋白免疫小鼠制备单克隆抗体。
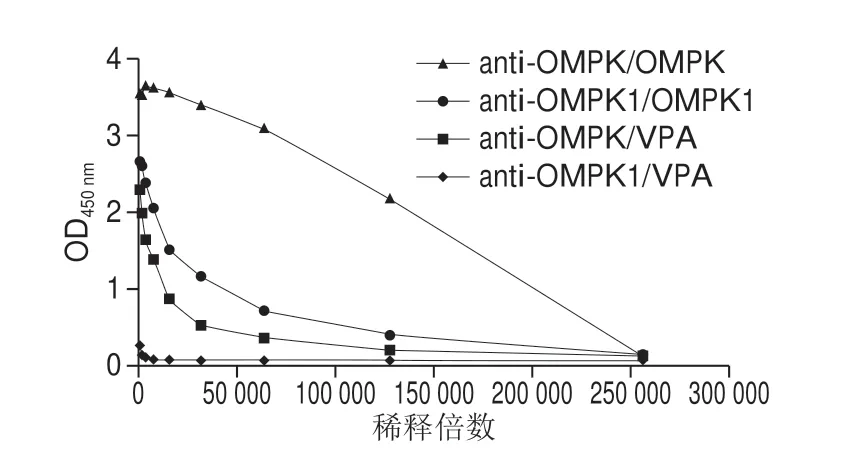
图2 anti-OMPK和anti-OMPK1血清效价ELISA检测结果Fig.2 Measurement of the titer of anti-OMPK serum and anti-OMPK1 serum by indirect ELISA
2.3 抗体特异性
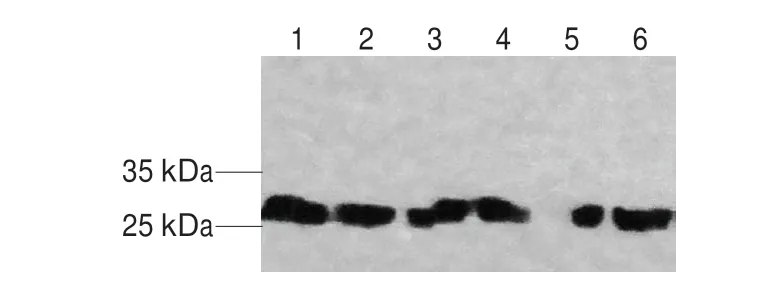
图3 抗体Western-blotting检测结果Fig.3 Western blotting of the antibodies
图3表明,6 株单克隆抗体均能特异性识别副溶血弧菌抗原,后续将6 株单克隆抗体用HRP或biotin标记,两两配对选择最佳的检测抗体对。
2.4 酶标抗体最佳工作浓度
如图4所示,HRP标记的单克隆抗体稀释度在1∶3 200时,只有VP16-HRP OD450nm大于1,biotin标记的抗体稀释度为1∶800时,VP4-biotin测定值大于1,不同抗体标记方法不同其最佳工作浓度也有差别。

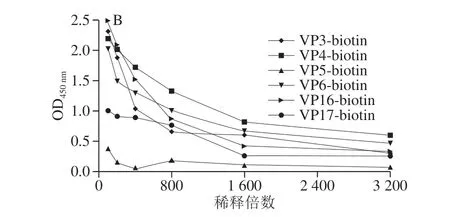
图4 不同酶标抗体的ELISA检测结果Fig.4 ELISA results of HRP or biotin-labeled antibodies
2.5 HRP标记单克隆抗体检测副溶血弧菌
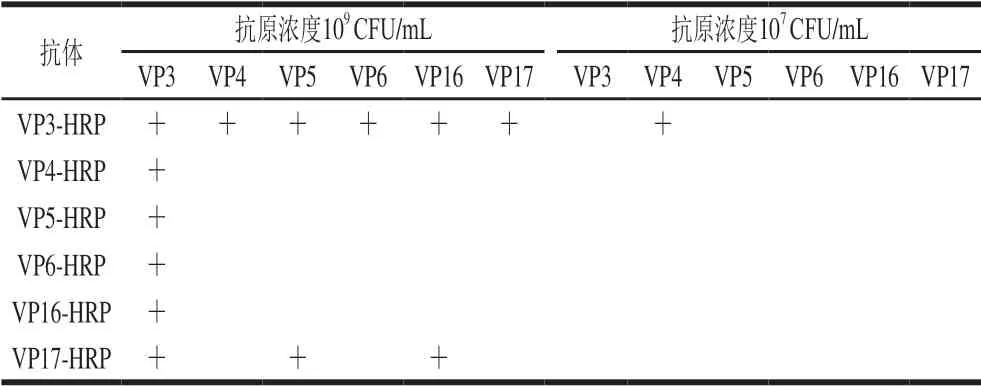
表1 HRP标记mAbs检测副溶血弧菌实验结果Table 1 Results of V.parahaemolyticus detection by mAbs conjugated with HRP
由表1可以看出,将HRP标记的单克隆抗体作为检测抗体用于检测副溶血弧菌,当副溶血弧菌抗原浓度为109CFU/mL时,VP3-HRP与其他抗体配对检测结果为副溶血弧菌阳性,但是检测信号很弱。当副溶血性弧菌抗原浓度为107CFU/mL时,只有VP3-HRP/VP4检测结果为阳性,其余配对抗体ELISA检测结果为阴性。
2.6 biotin标记单克隆抗体检测副溶血弧菌
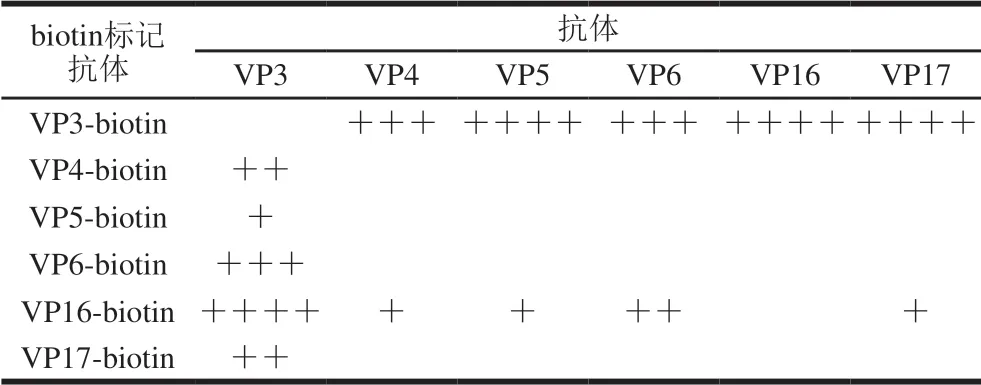
表2 biotin标记mAbs检测副溶血弧菌实验结果Table 2 Results of detection of V.parahaemolyticus detection by mAbs conjugated with biotin
表2结果表明,副溶血弧菌ATCC33847抗原浓度为107CFU/mL时,VP3-biotin与VP4、VP5、VP6、VP16、VP17配对用于夹心ELISA法检测副溶血弧菌,除VP3-biotin/VP4抗体对检测OD450nm值小于2,其余OD450nm值均大于2,VP16-biotin/VP3抗体对也具有很高的检测灵敏度,综上结果可知biotin标记VP3和VP16与特定抗体配对能够放大检测信号,进而ELISA方法用于副溶血弧菌检测具有较高的灵敏度。
2.7 特异性实验

表3 VP3-biotin抗体对ELISA法检测副溶血弧菌的特异性Table 3 Specificity analysis of biotinylated VP3 paired with other purified mAbs to detect V.parahaemolyticus by sandwich ELISA
由表3可知,抗体对用于检测大肠杆菌ATCC35218等1 6 株菌的E L I S A 结果均为阴性,检测河流弧菌CGMCC1.1611等4 株弧菌属结果为阴性,说明上述抗体对与其他菌株无交叉反应,副溶血弧菌 ATCC33847等4 株菌的检测结果均为显著阳性。表3中的抗体对在用于ELISA方法检测副溶血弧菌时具有良好的灵敏度及特异性。
2.8 Fab片段检测灵敏度实验

表4 VP16-biotin/VP3和VP16(Fab)-biotin/VP3抗体对检测副溶血性弧菌灵敏度分析Table 4 Sensitivity analysis of VP16-biotin/VP3 and VP16(Fab)-biotin/VP3 to detect V.parahaemolyticus
VP16 Fab片段与VP16检测副溶血弧菌结果见表4,副溶血弧菌抗原浓度为107CFU/mL两者的检测结果无明显差异,抗原浓度降低至106CFU/mL,VP16-biotin/VP3抗体对检测副溶血弧菌OD450nm结果为0.75,VP16(Fab)-biotin/VP3抗体对检测OD450nm结果为1.87,其检测灵敏度明显高于VP16-biotin/VP3。上述结果与Fab自身特性有关,Fab是分子IgG经木瓜蛋白酶裂解产生的2 个相同片段中的任一个,Fab相对分子质量约为5h 104,相比于完整抗体IgG具有分子质量小、无Fc片段、具有很高的结合能力、不需要介导抗体效应就能够单价结合抗原的特性[28]。两抗体对用于检测高浓度豚鼠气单胞菌抗原时均无交叉反应。
2.9 海鲜样品检测结果

表5 海鲜样品中副溶血弧菌检测结果Table 5 Results of V.parahaemolyticus detection in seafood samples
ELISA方法结合VP16-biotin/VP3抗体对检测血蚶和人工污染鲑鱼中活的副溶血弧菌,由表5可知,5~10、10~25、25~100 CFU/25 g菌污染浓度下,ELISA检测结果均为副溶血弧菌阳性,市场购买的血蚶检测结果也是副溶血弧菌阳性。
3 讨论与结论
免疫学方法检测副溶血弧菌一般是以其毒力因子作为检测对象,传统的免疫学检测方法主要是以相对耐热溶血素、TDH耐热溶血素等制备单克隆抗体,以此检测样品中的副溶血弧菌[17]。但是除副溶血弧菌外,其他弧菌中也存在毒力基因,因此可能造成漏检与误检[29-30]。外膜蛋白是一类细菌表面蛋白,对于菌体自身结构的维持以及物质转运功能具有重要作用,该蛋白还有较强的免疫原性[31]。OMPK是副溶血弧菌表面蛋白成分之一,具有较好的免疫原性,很少与其他菌属发生交叉反应,因此可避免其他菌属的干扰造成检测结果假阳性[32-33]。
本研究结果表明OMPK重组蛋白免疫小鼠血清效价明显高于OMPK1重组蛋白。经OMPK重组蛋白免疫BALB/c小鼠制备出VP3、VP4、VP6、VP7、VP16、VP17共6 株单克隆抗体均能够特异性识别副溶血弧菌抗原。HRP标记的单克隆抗体用于检测副溶血弧菌时检测信号弱、灵敏度低,VP3-biotin与其他5 个抗体配对和VP16-biotin/VP3检测副溶血弧菌灵敏度较高。VP3-biotin与其他5 个抗体配对用于ELISA方法检测对副溶血弧菌同种属具有良好的特异性,该抗体对用于检测其他种属菌并无交叉反应。Fab片段相比于完整抗体用ELISA方法检测副溶血弧菌具有更高的灵敏度,VP16-biotin/VP3抗体对检测海鲜样品中副溶血弧菌的检测限可达5~10 CFU/25 g。该方法的灵敏度高,可成功用于副溶血弧菌快速检测等应用研究。

