基于UPLC-Triple-TOF MS/MS对巴氏杀菌乳中磷脂成分的分析
曹 雪,任皓威,王筱迪,许铵颀,商佳琦,刘 宁
(乳品科学教育部重点实验室,东北农业大学食品学院,黑龙江 哈尔滨 150030)
磷脂是一种含磷酸的极性脂类,兼有亲水的头部和疏水的尾链,能够在水环境中形成稳定的磷脂双分子层,对牛乳的稳定性具有重要作用[1-2]。牛乳中磷脂约占其总脂肪的0.5%~1%[3-5]。位于脂肪球膜上,主要分为磷酸甘油酯和鞘磷脂(sphingomyelin,SM)。常见的磷脂组分有磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)和磷脂酰肌醇(phosphatidylinositol,PI)。脂质组学作为一个新兴学科[6],与蛋白组学、基因组学相比,数据匮乏且认识不足,而复杂的脂质种类和繁琐的检测程序更加限制了其在营养学的应用。磷脂是第一大类脂质,在婴幼儿认知和发育中存在重要联系[7-8]。因此,对牛乳中磷脂的系统分析不仅可以填补脂质组学的空白,为磷脂数据库提供基础数据,还可以与人乳的磷脂种类与含量做对比,为婴幼儿乳粉的开发提供理论基础。
磷脂组成常见的检测技术有核磁共振(nuclear magnetic resonance,NMR)法、直接进样质谱法和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption-ionization time-of-flight mass spectrometry,MALDI-TOF MS)法[9-10]。NMR法能够分离复杂的混合物,31P-NMR较好的线性响应和相对较高的速度使样品有精确的吞吐量和较高的选择性测量[11-12]。与MS相比,NMR技术灵敏度较低同时设备成本高[13]。直接进样是一种高通量方法,可以在较短时间内处理和分析样品,提高样品间的重复性和后续聚类分析的准确性,通常使用电喷雾质谱法进行直接注射分析。直接进样质谱法不能有效地分析同分异构体,适合于有目标性脂质分析。MALDI-TOF MS法由于不同质量的脂质离子经过飞行管到达TOF质量分析器的时间不同,通过测定不同脂质离子到达TOF质量分析器的时间,推算各种脂质离子的m/z[14-15]。本研究基于Triple-TOF系统,可以自动收集所需质量范围内的所有前体离子,以及目标母离子的碎片,并记录所有子离子,具备高质量数、高分辨率、高扫描速率和高灵敏度,能够准确与快速鉴定牛乳中的磷脂组分的特点。
Li Guochen等[16]通过高效液相色谱-MALDI-TOF MS联用,得到了PC和SM的分子亚类脂肪酸组成;Merrill等[17]使用三重四极杆质谱对SM进行了系统的定量和定性分析;Sullars[18]和Bang[19]等采用液相色谱-电喷雾-质谱联用对鞘磷脂亚类进行了详细分析。但是目前国内关于牛乳中磷脂的研究鲜见报道。国外对牛乳中的磷脂有一些研究,Byrdwell等[20]通过液相色谱-质谱方法,虽然可以鉴定出大量的磷脂物种,但由于保留时间和峰面积的差异巨大,无法对磷脂物种进行定量分析。Ali等[21]利用超高效液相色谱检测巴氏杀菌乳中的脂肪酸,与本研究不同的是其在负离子模式下对PE、PI和磷脂酰甘油(glycerophosphoglycerols,PG)实现定性分析,在正离子模式下对PC、PS、SM和溶血磷脂酰胆碱(lysophosphatidycholine,LPC)进行定性分析。Walczak等[22]使用Folch法提取脂肪,固相萃取法实现初步分离,然后使用高效液相色谱-质谱联用,与本研究相同的是在正离子模式下对PC、PE、SM和PS实现定性分析,在负离子模式下对PI实现定性分析。本研究应用超高效液相色谱-串联四极杆飞行时间高分辨质谱(ultrahigh perfomance liquid chromatography-triple quadrupoletime of flight tandem mass spectrometry,UPLC-Triple-TOF MS/MS)分析巴氏杀菌乳中磷脂的组成,旨在为乳与乳制品中真实属性监测的磷脂组学方法建立提供基础,同时通过与人乳中磷脂组成的比较分析,为婴幼儿配方乳粉研制提供基础理论依据[23]。
1 材料与方法
1.1 材料与试剂
市购巴氏杀菌乳,分装之后至于-80 ℃冷冻保存,待检。
氯仿、甲醇、氯化钠(均为分析纯),正己烷、异丙醇、甲醇、乙腈(均为色谱纯) 天津市科密欧化学试剂有限公司;乙酸铵(质谱纯) 上海阿拉丁生化科技股份有限公司;PC 34:2 (≥99%)、PE 36:5(≥98%)、PS-O 38:5(≥97%)、PI 32:0(≥98%)、SM 34:1; 2(≥98%) 美国Sigma公司。
1.2 仪器与设备
A C Q U I T Y U P L C®B E H C18液相色谱柱(2.1 mmh 100 mm,1.7 μm)、ACQUITY超高效液相色谱仪 美国Waters公司;Triple TOFTM5600+质谱分析仪美国SCIEX公司;BYN200-2氮吹仪 天津奥特赛恩斯仪器有限公司。
1.3 方法
1.3.1 脂质提取
参考Folch等[24]的方法。取巴氏杀菌乳1 mL,加入4 mL的氯仿-甲醇(2∶1,V/V)溶液与0.8 mL的0.05 mol/L NaCl溶液,振荡混匀,4 000 r/min离心10 min。用注射器取出下层氯仿。重复上述步骤2~3 次。将合并的氯仿层使用氮吹仪进行浓缩干燥,置于-80 ℃冷冻保藏,等待下一步分析。待进样分析时,用1 mL氯仿-甲醇(2∶1,V/V)混合溶液进行溶解,然后经过0.22 μm尼龙膜过滤器过滤,存放于进样瓶中。
1.3.2 液相色谱条件
样品进样量为5 μ L,流动相A 为水-甲醇-乙腈(1∶1∶1,V/V)混合溶剂(含有2 mmol/L乙酸铵);流动相B为异丙醇-乙腈(1∶1,V/V)混合溶剂(含有2 mmol/L乙酸铵)。流动相流速0.35 mL/min,柱温35 ℃,分流比50∶1,梯度洗脱如表1所示。
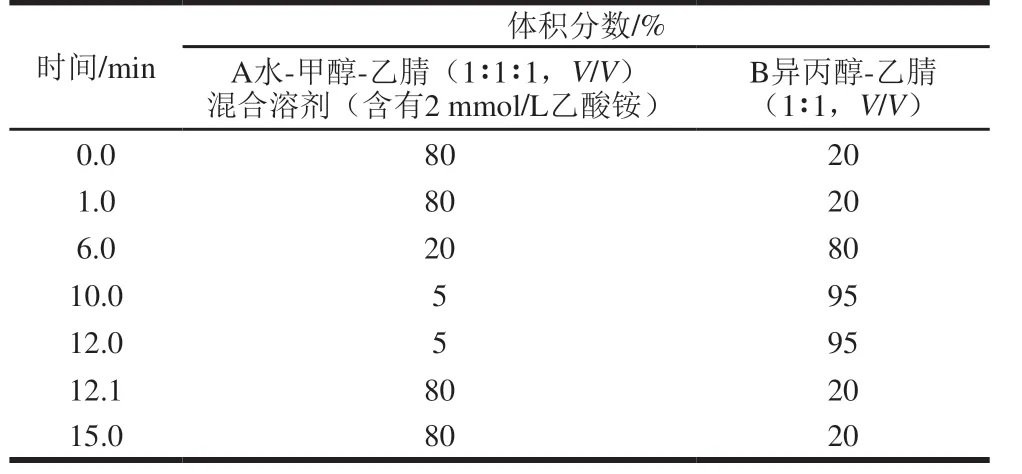
表1 磷脂梯度洗脱程序Table 1 Mobile phase composition for gradient elution
1.3.3 质谱条件
Triple-TOF 5600+质谱分析仪配电喷雾离子源(electron spray ionization,ESI),对样品与标准品的分析采用正负离子模式,质谱条件的设置参考本课题组优化的分析人乳中磷脂组学的方法,具体条件参数见表2。

表2 磷脂分析的质谱条件Table 2 Mass spectrometry conditions for phospholipid analysis
1.4 数据统计与图像处理
本研究数据由AnalystTF1.7.1获取,Lipidview获得磷脂的基本信息,PeakView 2.2和MasterView 1.1对总离子图进行解析。数据库LipidMaps网站可查找标准品的裂解方式解析。Excel对数据预处理,化学结构式采用ChemDraw Professional 16.0软件进行处理。
2 结果与分析
2.1 标准品的试运行
由于巴氏杀菌乳样品中各磷脂分子信息、元素组成和结构类型均未知,运用UPLC-Triple-TOF MS/MS对巴氏杀菌乳样品中的磷脂成分进行定性与定量分析。通过标准品试运行确定最优的前处理条件。试运行之前,对进样参数进行设定。标准品试运行后通过调整设定条件达到最大提取峰强度,各色谱图中的峰均分得开且峰形良好。如图1所示,磷脂标准品SM 34:1; 2、PE 36:5和PC 34:2均在正离子下检测到较高的响应强度,而PI 32:0在负离子下响应值较正离子高。实验采用正负离子同时进样分析。
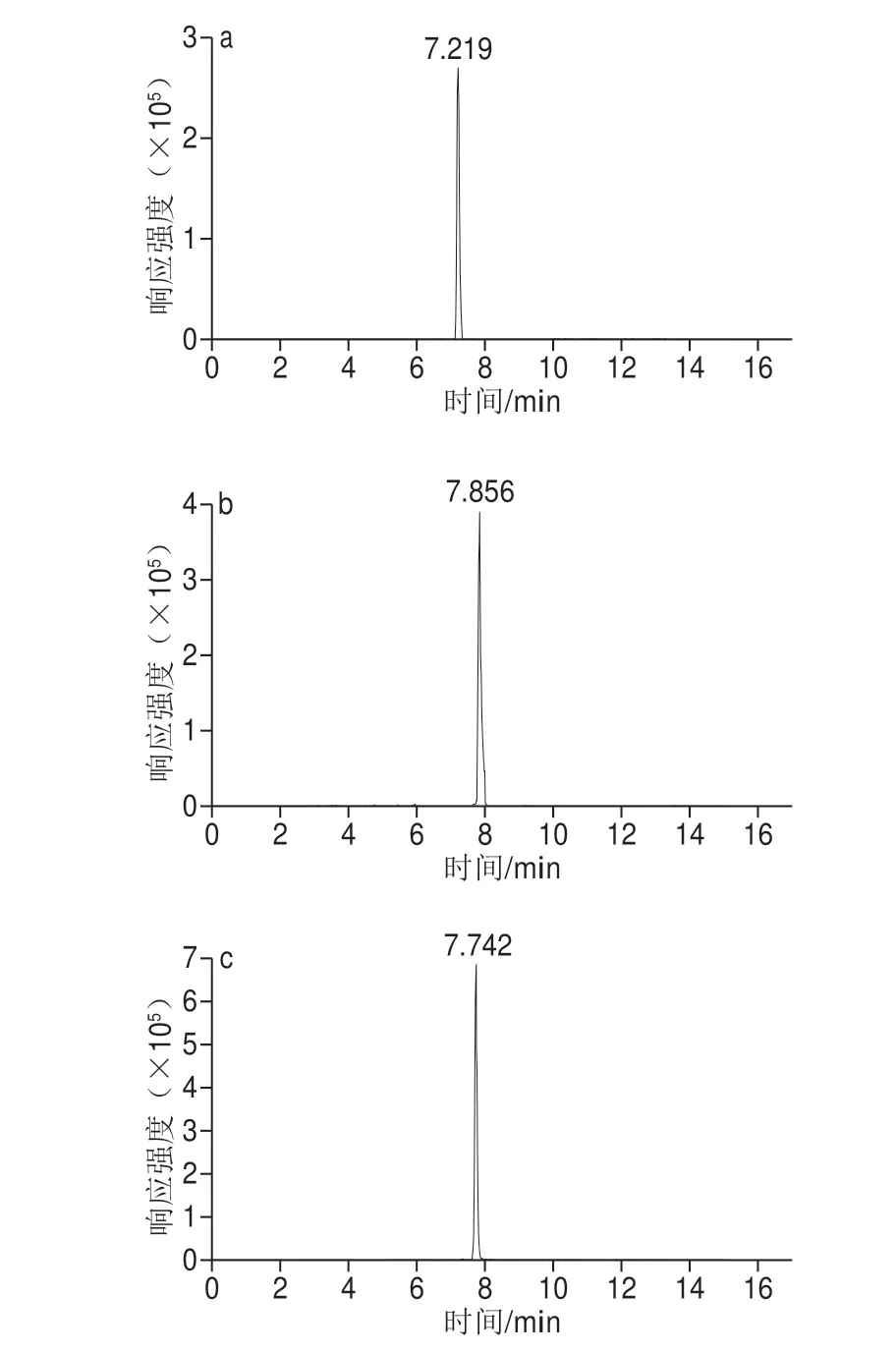
图1 巴氏杀菌乳中的提取离子色谱图Fig.1 Extracted ion chromatograms of pasteurized milk samples
2.2 方法学评价
2.2.1 标准曲线与灵敏度
对本方法的可靠性进行进一步验证,将标准品溶于流动相中制成质量浓度为1 mg/mL的标准储备液。混合各标准储备液,得到每种标准品质量浓度均为10 μg/mL的混合标准溶液,同时各标准储备溶液分别稀释成质量浓度梯度范围为0.1~100 μg/mL(每种标准品的质量浓度分别为0.1、1、10、50 μg/mL和100 μg/mL),得到的标准曲线相关系数R2良好,在0.997 8~0.999 6之间,表明此方法得到的检测值与相应的回归方程吻合度较高。检出限按信噪比3 倍计算,定量限按信噪比10 倍计算。5 种磷脂中检出限与定量限最低的是PC 34:2,而PS-O 38:5的检出限与定量限呈现最高值,5 种磷脂的检出限在0.53~1.14 μg/mL之间,定量限在1.62~3.45 μg/mL之间。结果显示,在所选用的实验条件下,仪器对几种标准品的检测呈现较高的灵敏度,如表3所示。
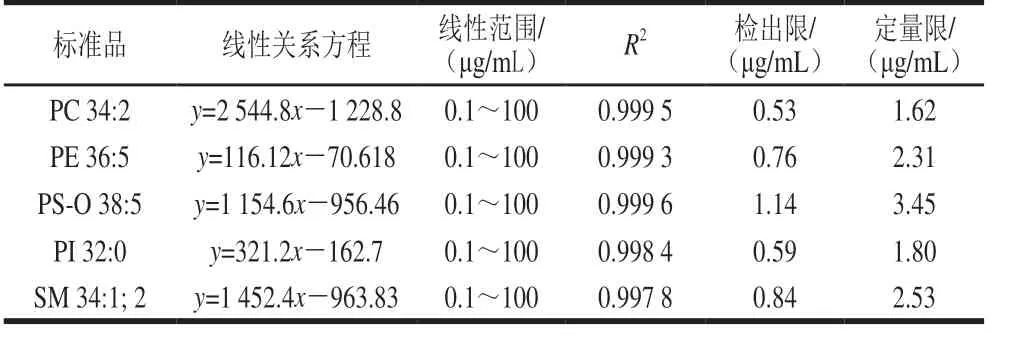
表3 巴氏杀菌乳中磷脂检测的线性关系方程、线性范围、检出限和定量限Table 3 Calibration curve equations, linear ranges, limits of detection,and limits of quantitation of phospholipids in pasteurized milk samples
2.2.2 精密度实验结果
对同1 d内检测加标质量浓度为10 μg/mL的混合标准溶液的样品进行脂质提取,重复进样6 次,计算各标准品的相对标准偏差(relative standard deviation,RSD)。再将样品每天测定1 次,连续测定5 d,计算各标准品的RSD。得到的几种混合标准品提取离子色谱峰面积与样品中被观测物质提取离子色谱峰面积的RSD如表4所示。同1 d的测定中,日内精密度RSD在1.23%~2.44%之间,连续测定6 d得到日间精密度的RSD在11.32%~17.42%之间,均小于18%,表明本研究选用的条件具有较好的精密度。

表4 巴氏杀菌乳中磷脂检测的日内和日间精密度结果(n= 6)Table 4 Intra-day and inter-day precision for determination of phospholipids in pasteurized milk samples (n= 6)
2.2.3 准确度测定结果
取一份稳定样品,向其中加入10 μg/mL的标准混合工作液1 mL,同时测定样品与加标样品,加标样品扣除样品值后与标准物质的误差为该方法的准确度。
如表5所示,该方法相对误差在1.55%~5.32%之间,反映了方法较好的准确性。几种标准品在加标量为10 μg/mL时,加标回收率在89.81%~110.54%之间,此范围处于微量仪器分析的80%~120%之间,RSD在4.47%~8.55%之间,说明该方法的预处理损失低,符合分析实验的要求。

表5 巴氏杀菌乳中磷脂检测的准确度的测定结果Table 5 Accuracy of determination of phospholipids in pasteurized milk samples
2.2.4 加标回收率实验结果
取1 mL巴氏杀菌乳样品,分别设定为实验组和对照组,实验组加入5、10 μg/mL和20 μg/mL不同质量浓度的混合标准品溶液进行脂质提取并分析,每个质量浓度测6 次。对照组为样品,进行脂质提取并进样分析,计算巴氏杀菌乳中磷脂的提取回收率。如表6所示,加标回收率可满足对样品测定的要求。

表6 巴氏杀菌乳中磷脂检测的加标回收率测定结果(n=3)Table 6 Recoveries of phospholipids in spiked pasteurized milk samples (n= 3)
2.2.5 稳定性实验结果
取3 份巴氏杀菌乳样品各1 mL按1.3.1节预处理方法处理,分别在室温下放置1、4 h和8 h后的测定结果见表7,观察到PS-O 38:5和SM 34:1; 2在室温下较为稳定,RSD在6.15%以下,PC 34:2、PI 32:0和PE 36:5稳定性相对较差,RSD在10.54%~17.81%之间。

表7 巴氏杀菌乳中磷脂检测的巴氏杀菌乳样品的稳定性Table 7 Stability for determination of phospholipids in pasteurized milk samples
2.3 巴氏杀菌乳中磷脂成分的质谱分析
如图2所示,同一种类磷脂裂解呈现一定规律性,PC在磷酸胆碱处断裂产生m/z为184中性丢失,m/z184特征碎片是质谱裂解典型特征[25];PE二级质谱上出现m/z141的中性丢失,酯基与质子结合产生[M-140]-可用于PE结构鉴定[26-27];PS虽然在负离子模式下也有较好的响应值,但PS在正离子模式下会产生m/z85的中性丢失[28],有利于定性分析;对于SM而言,常见的中性丢失有[M+H-86]+(“脱氢胆碱”基团)与[M+H-184]+(磷脂胆碱离子),与PC在正离子模式下产生m/z184的中性丢失不同,SM在正离子模式下的母离子峰为奇数,PC在正离子模式下的母离子峰为偶数[22]。PI可以通过m/z241、259、315和333等特征碎片进行定性[29]。

图2 巴氏杀菌乳中磷脂的结构式Fig.2 Structural formula of different types of phospholipids in pasteurized milk
以S M 质谱推导过程为例,S M 类在E S I(±)检测模式下,正离子较负离子下易形成峰度较高的[M+H]+准分子离子,二级质谱裂解具有一定的规律性,生成特征碎片离子C5H15NO4P+(184.073 0 Da),负离子[M+HCOO]-易形成丰度较高的准分子离子,同时丢失脂肪酸长链。但无法确定脂肪酸链位置、构型及双键数目。SM 34:1; 2的保留时间为7.32 min,在正离子模式下,其[M+H]+m/z为675.540 8,根据高分辨MS推测其可能的化学元素组成为C39H80O6N2P+;负离子下其[M+HCOO]-m/z为747.564 9,根据高分辨MS推测其可能的化学元素组成为C40H80O8N2P+。图3为该脂质代谢物ESI(+)的一级质谱与二级质谱图,由二级质谱可以看出代谢物有特征性碎片离子m/z184.073 61;图4为脂质代谢物ESI(-)的一级质谱与二级质谱图,由二级质谱可以看出代谢物生成337.352 7的特征碎片。SM 34:1; 2的化学结构特征均通过MS/MS的子离子得到了充分说明,同时能进一步确定该脂质类物质的总碳数及双键数。如图5所示,该脂质化合物可能的生物标志物为SM 34:1; 2。再以PC为例,如图6所示,m/z812.611 8(PC 38:3)离子在正离子源下的二级碎片,其中,m/z283.268 5和m/z305.522 3分别表示从磷酸甘油酯键sn-1和sn-2位上断裂下的脂肪酸链分别为FA18:0和FA20:3,由此表明PC 38:3分子在sn-1/sn-2位为18:0/20:3。同理依次对其他磷脂进行定性。
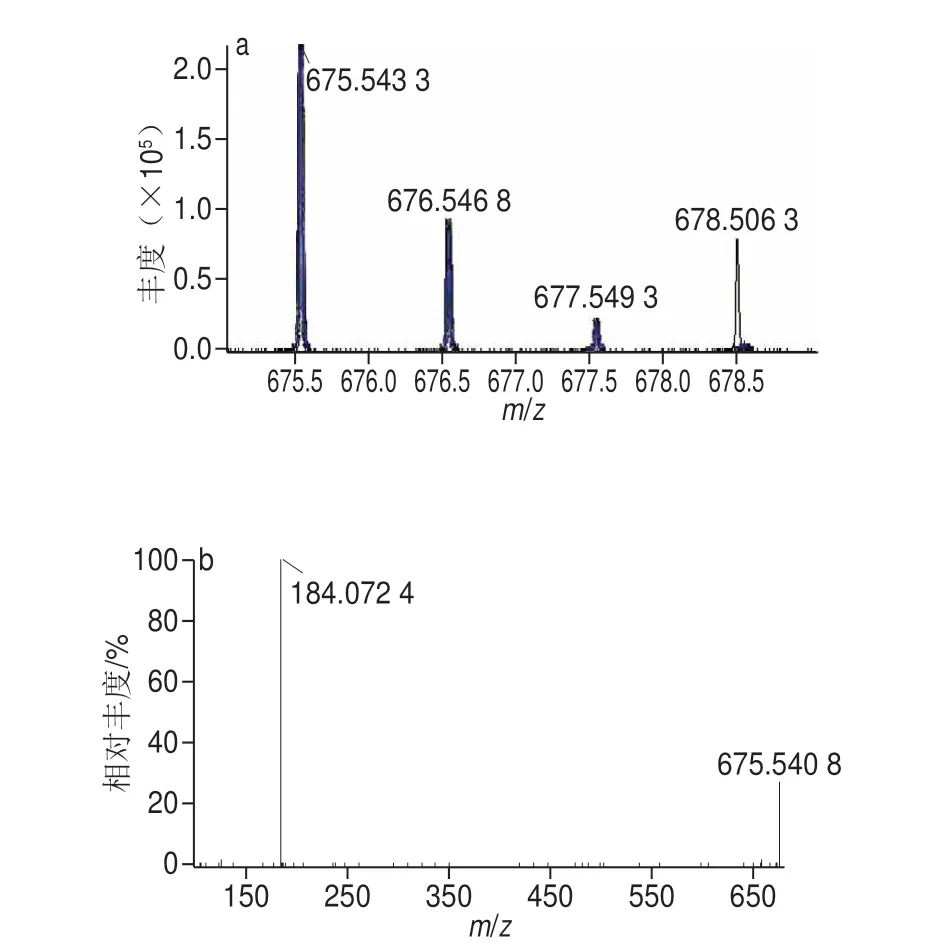
图3 SM在正离子下一级质谱图(a)及其二级质谱图(b)Fig.3 Mass spectrum of SM compound ions in the positive ion mode (a)and MS/MS spectrum of SM compound ions (b)

图4 SM在负离子下一级质谱图(a)及其二级质谱图(b)Fig.4 Mass spectrum of SM compound ions in the negative ion mode (a) and MS/MS spectrum of SM compound ions (b)
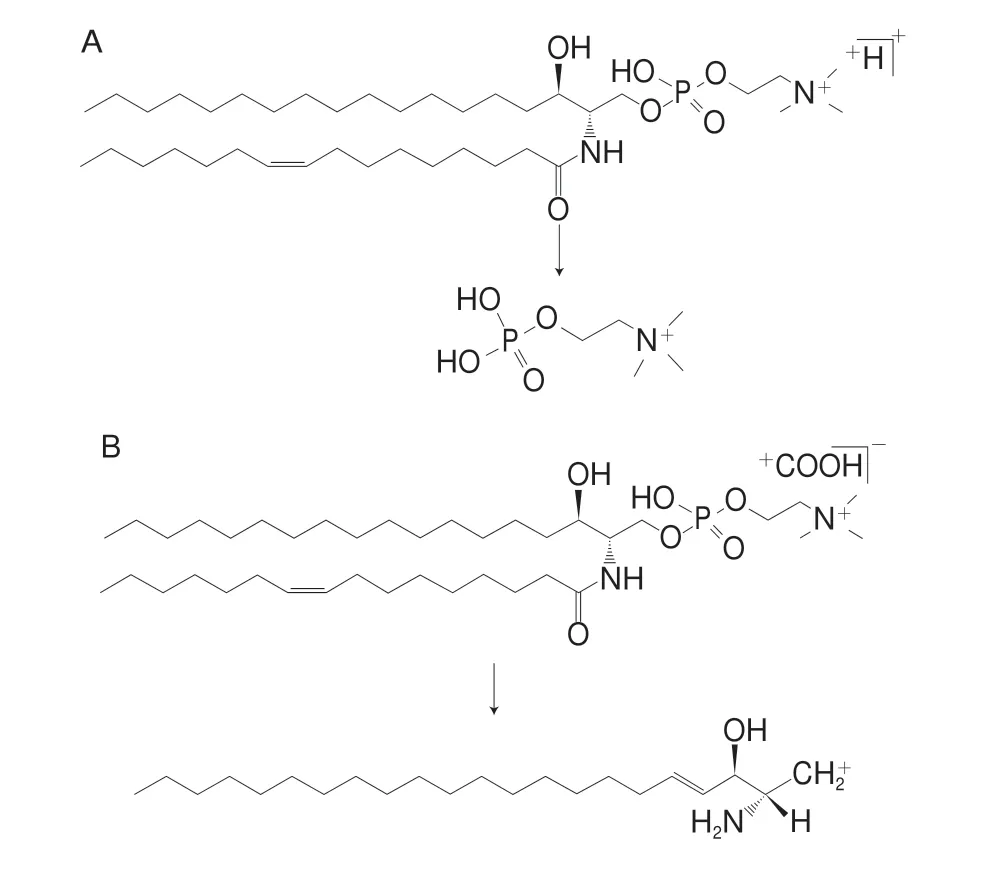
图5 正离子模式(A)及负离子模式(B)下使用UPLC-Triple-TOF MS/MS在相应m/z的碎裂途径Fig.5 Fragmentation pathways of phospholipids at corresponding m/z in UPLC-Triple-TOF MS/MS spectra in the positive ion mode (A) and the negative ion mode (B)
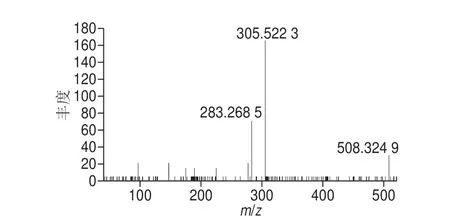
图6 PC 38:3(18:0/20:3)二级质谱图(m/z 812.611 8)Fig.6 The MS/MS spectrum of PC 38:3 (18:0/20:3) compound ions showed m/z 812.611 8
2.4 巴氏杀菌乳中磷脂结构鉴定
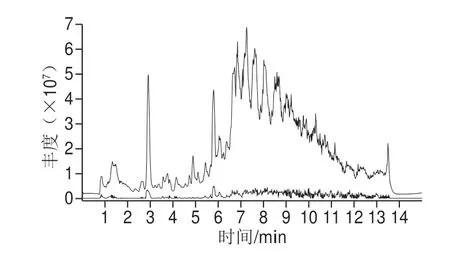
图7 巴氏杀菌乳在UPLC-Triple-TOF-MS/MS扫描下的总离子流图Fig.7 Total ion chromatogram of pasteurized milk by UPLC-Triple-TOF MS/MS
按照1.3.1节条件对巴氏杀菌乳中磷脂进行分离与分析,巴氏杀菌乳中磷脂在ESI(±)离子模式下的总离子色谱图7。通过巴氏杀菌乳样品的保留时间、母离子及碎片离子的质谱信息与标准品对比,同时参考LipidMaps数据库标准品的裂解规律及相关的参考文献,结合二级质谱推测检测出的化合物,共检测出68 种磷脂分子,磷脂分子名称、化学式、m/z、保留时间及峰面积如表8所示。
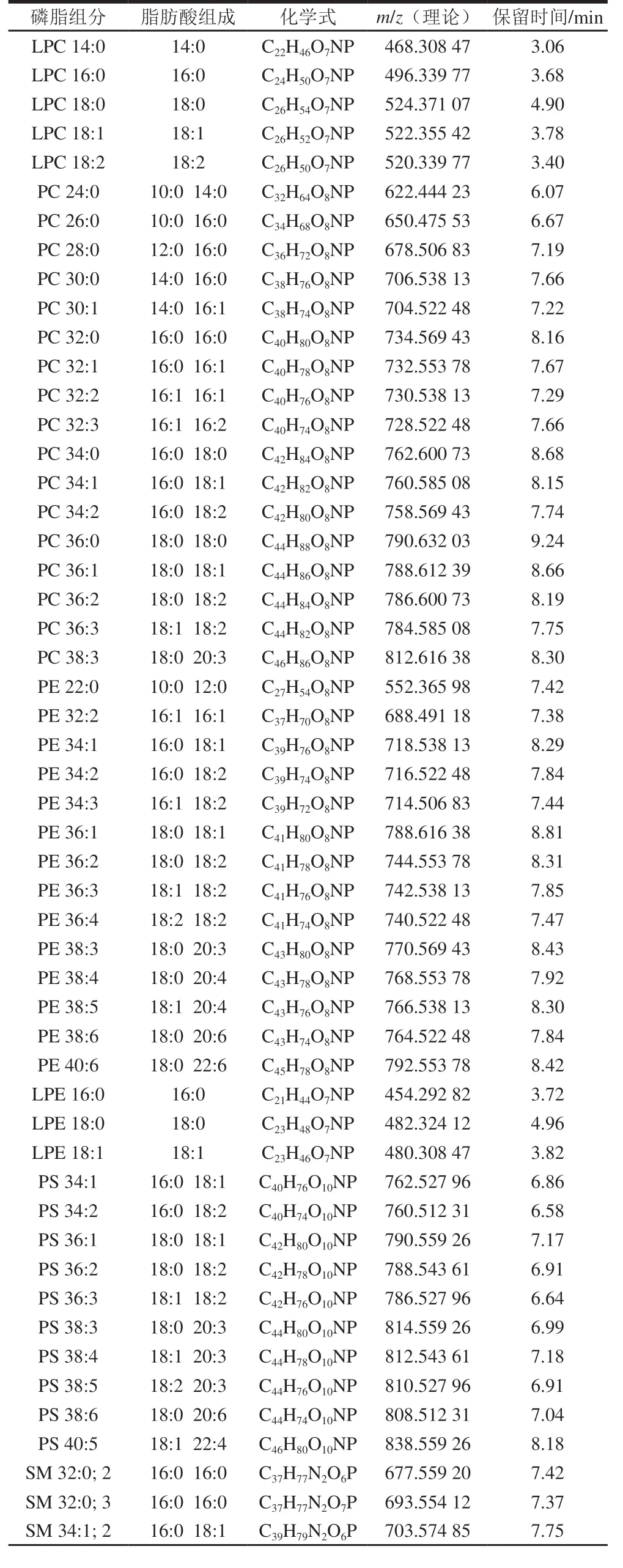
表8 巴氏杀菌乳中磷脂类别Table 8 List of phospholipids identified in pasteurized milk
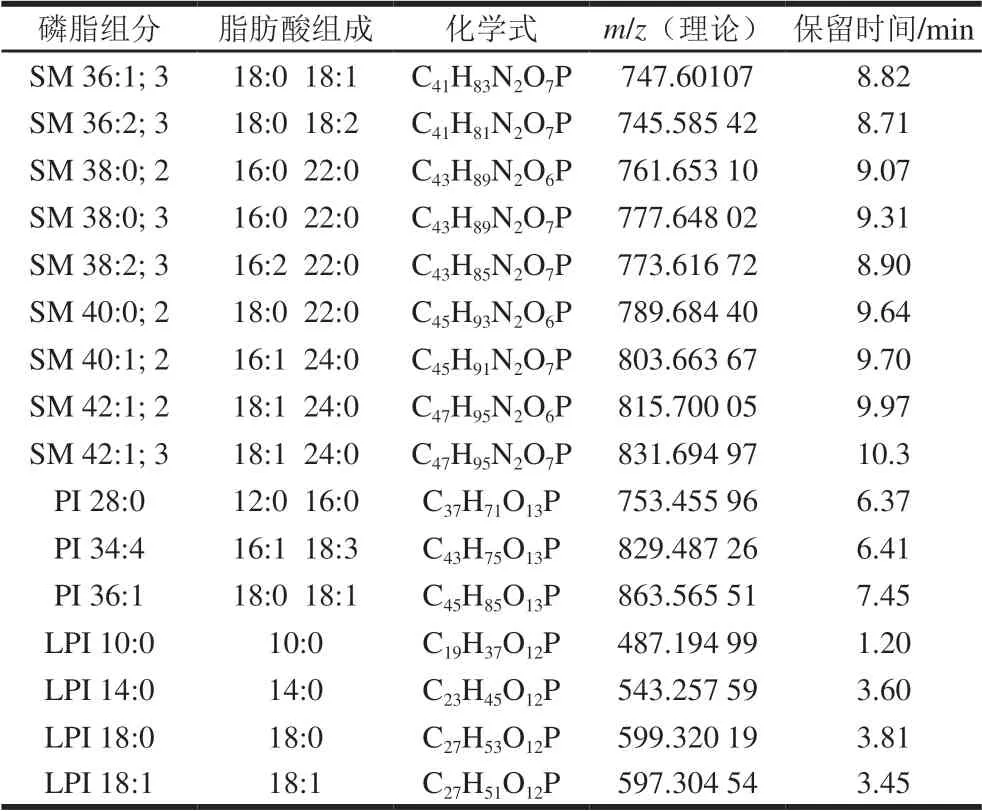
续表8
2.5 巴氏杀菌乳中磷脂含量的分析
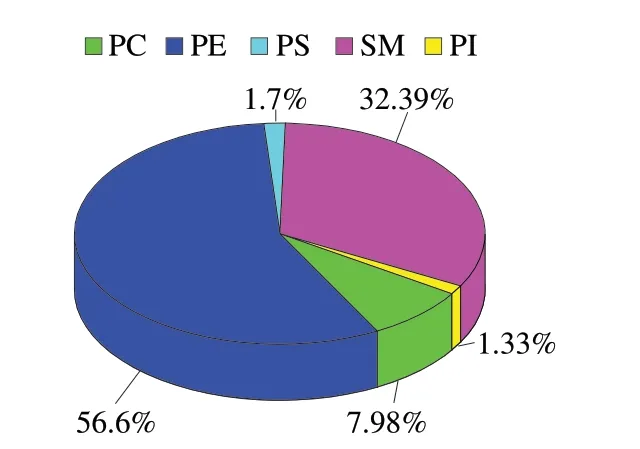
图8 各磷脂组分在巴氏杀菌乳中的相对含量Fig.8 Relative content of each phospholipid fraction in pasteurized milk
由PeakView 2.2和MasterView 1.1进行定性分析后,利用Multiquant对巴氏杀菌乳中磷脂实现半定量分析,结果见图8,巴氏杀菌乳中各种磷脂的相对含量分别为PI 1.33%、SM 32.39%、PS 1.70%、PE 56.60%和PC 7.98%。虽然脂质组成随奶牛品种、饮食习惯、哺乳期和季节而变化,但有研究表明[3]该5 个磷脂的比例始终保持相对恒定。牛乳和其他哺乳动物的磷脂组成与人乳磷脂存在差异[30],但PE含量均为最高,其平均水平远高于人乳PE含量;牛乳中PC含量与人乳中的含量接近,但SM含量却有很大区别,虽含量列为第2却远低于人乳磷脂的SM含量。PI、PS与人乳脂肪磷脂规律相同,含量较低。在PC中含量最高的为PC 34:1,为9.10 mg/g(图9A)。PE含量最高的为PE 36:2,为90.10 mg/g(图9B)。PS含量最高为PS 36:2,为3.10 mg/g(图9C)。SM中含量最高的为SM 40:1; 2,为802.34 mg/g(图9D);PI为巴氏杀菌乳磷脂中检测到的含量最低的物质,其中PI 36:1含量最高,为7.90 mg/g,其他几种物质PI 28:0、PI 34:4、LPI 18:0、LPI 18:1、LPI 10:0和LPI 14:0呈极少分布(图9E)。
研究发现,磷脂种类不同,其脂肪酸的组成也略有差异。如PE、PS中含有较多的长链多不饱和脂肪酸如C20:3、C20:4、C22:3、C22:4等,在PC、SM中含有大量的长链饱和脂肪酸如C14:0、C16:0、C18:0。各种磷脂不管在人乳还是牛乳中,C14:0、C16:0、C18:0、C18:1和C18:2都是相对频繁的与其他脂肪酸相互结合。其中SM含有最多的饱和脂肪酸,除了C16:0,还有更长的饱和的酰基链C22:0、C24:0,而PE占据了最多的不饱和脂肪酸[31]。
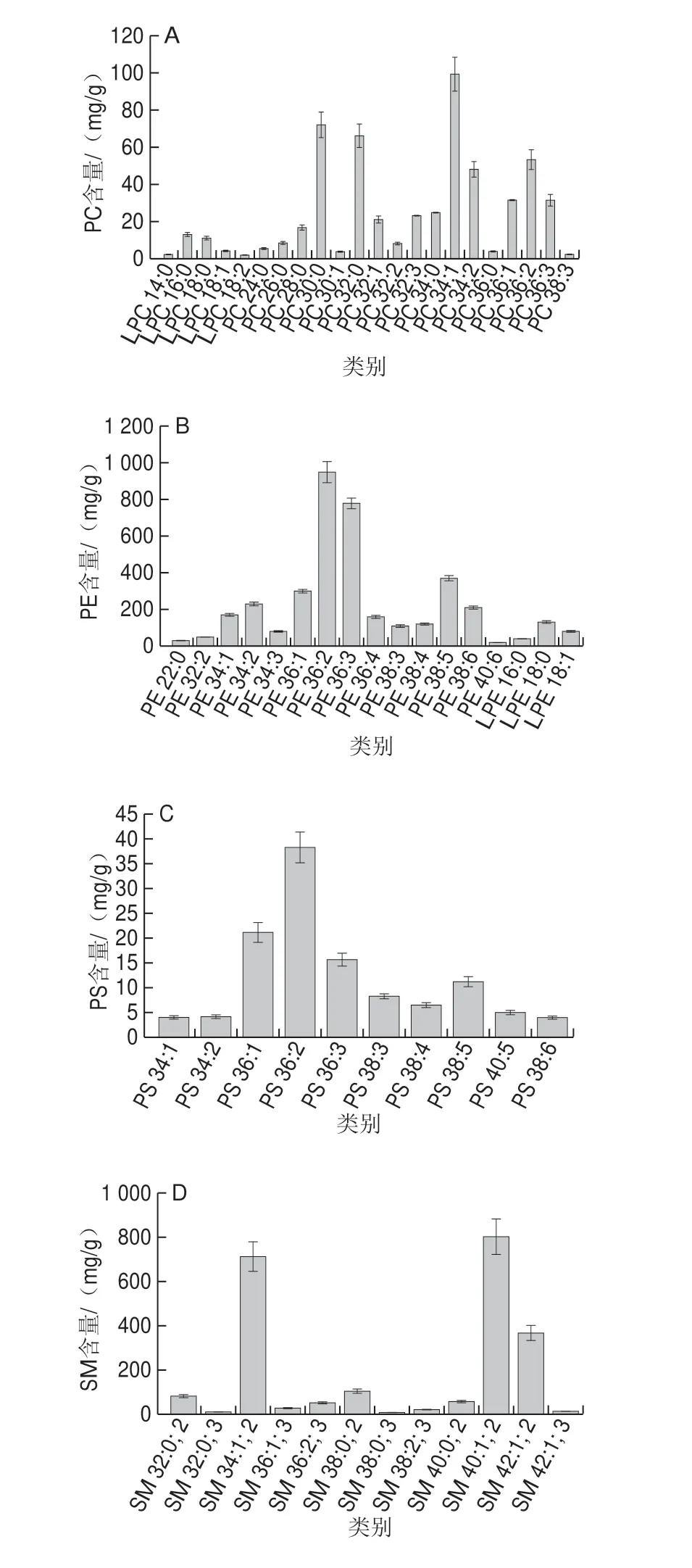

图9 巴氏杀菌乳中各种PC(A)、PE(B)、PS(C)、SM(D)、PI(E)组成Fig.9 Composition of PC (A), PE (B), PS (C), SM (D) and PI (E) in pasteurized milk
3 结 论
本研究以巴氏杀菌乳为研究对象,运用UPLCTriple-TOF MS/MS鉴定巴氏杀菌乳中的磷脂组分,通过自动收集所需质量范围内的所有前体离子,目标母离子碎片与子离子,共发现68 种磷脂分子,其比例分别为PI 1.33%、SM 32.39%、PS 1.70%、PE 56.60%和PC 7.98%,结果与Donato等[32]检测的各物质大小趋势一致,但数量远高于运用MS-ESI-IT-TOF方法检测到的22 种牛乳磷脂。Liu Zhiqian等[9]应用亲水作用色谱耦合LTQ Orbitrap质谱仪方法检测到牛乳中的主要磷脂56 种。Sokol等[23]用气相色谱和MS/MSALL对富含磷脂的牛乳中的脂类进行全面定量的分析,发现磷脂含量为PC>PE>PS>PI,与本研究含量趋势一致。磷脂常规色谱分离方法不仅前处理复杂,而且分离过程中的样品损失使磷脂分析无法满足高通量的快速分离。UPLC-Triple-TOF MS/MS既结合了UPLC强大的分离能力,又有Triple-TOF MS/MS可在生物分子无碎片断裂的情况下离子化及高灵敏度的优势,满足了脂质组学对高通量、快速分析的要求,可在单次分析中迅速筛选数百种不同化合物,更实现了对不同磷脂种类甚至于亚种的快速鉴定。以上方法未检测出LPC 14:0、PC 31:0、PC 24:0、PC 26:0、PE 38:3、PE 38:4、PS 38:6、SM 36:1; 2、SM 36:2和PI 28:0,与磷脂提取方法、奶牛基因及地域因素等有关。本研究表明UPLC-Triple-TOF MS/MS法可快速、准确鉴定牛乳中磷脂组分,为婴幼儿乳粉的研发提供一定理论依据。

