miR-155在转化生长因子β2诱导的人视网膜色素上皮细胞上皮-间质转化中的促进作用
王艳婷 金学民 李晓华 赵朝霞
1河南省人民医院眼科 河南省立眼科医院 河南省眼科研究所,郑州 450003;2郑州大学第一附属医院眼科 450052
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是一种以视网膜表面和玻璃体腔内形成致密纤维膜,继而引起视网膜脱落的严重疾病[1-2]。研究表明,视网膜色素上皮(retinal pigment epithelium,RPE)细胞的上皮-间质转化(epithelial -mesenchymal transition,EMT)是PVR发生的重要因素[3-4]。转化生长因子β2(transforming growth factor-β2,TGF-β2)可通过Smad、磷酸肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)等多种信号通路诱导RPE细胞发生EMT[5-6]。微小RNA(microRNA,miRNA)是一类广泛存在于人体组织中的非编码RNA,可以靶向调控下游靶基因的转录和翻译,从而发挥生物学功能[7]。微小RNA-155(microRNA-155,miR-155)属于miRNA家族成员,研究证实其在干眼、葡萄膜炎等多种眼科疾病中发挥重要作用[8]。同时有研究证实,miR-155在PVR患者RPE细胞中呈高表达[9]。目前miR-155在TGF-β2诱导RPE细胞EMT过程中发挥的作用尚不明确。本研究探讨miR-155在TGF-β2诱导RPE细胞EMT过程中的作用,为PVR发生的分子机制提供实验基础。
1 材料与方法
1.1 材料
人源性RPE细胞系ARPE-19(中国科学院上海细胞库);含与不含青链霉素混合液的DMEM培养基、胎牛血清(fetal bovine serum,FBS)、Transwell小室(上海碧云天生物技术有限公司);TGF-β2(美国Humanzyme公司);miR-155抑制剂和miR-155阴性对照序列由上海吉玛基因公司合成;Trizol试剂、Lipofectamine 2000、实时荧光定量PCR试剂盒(美国Sigma公司);兔抗人磷酸酶及张力蛋白同源物(phosphate and tension homology deleted on chromosome ten gene,PTEN)一抗(51-2400)、兔抗人PI3K一抗(PA5-83748)、兔抗人Akt一抗(44-609G)、兔抗人p-Akt一抗(44-621G)、鼠抗人钙黏蛋白E(E-cadherin,E-cad)一抗(33-4000)、鼠抗人平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)一抗(MA1-80729)、鼠抗人波形蛋白(vimentin)一抗(MA5-11883)(美国Invitrogen公司);兔抗人纤连蛋白1(fibronectin 1,FN-1)一抗(ab2413)、兔抗人闭锁小带蛋白1(zonula occludens protein 1,ZO-1)一抗(ab96587)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(ab8245)(英国Abcam公司);鼠抗人F-肌动蛋白(F-actin)一抗(14395-1-AP,美国Proteintech公司);生物素标记羊抗小鼠二抗(BAl001)、生物素标记羊抗兔二抗(BAl003)(武汉博士德生物工程公司);荧光素酶检测试剂盒(美国Gene Copoeia公司)。激光扫描共焦显微镜(日本Olympus公司);酶标仪、电泳仪(美国Bio-Rad公司);实时荧光定量PCR仪(美国Applied Biosystems公司);化学发光凝胶成像仪(美国Invitrogen公司)。
1.2 方法
1.2.1细胞培养 将ARPE-19细胞复苏,重悬于含青链霉素混合液和体积分数10% FBS的DMEM培养基中,置于37 ℃、体积分数5% CO2细胞培养箱中培养,隔日换液,待细胞融合至80%以上时弃培养液,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次后胰蛋白酶消化,用含0.5% FBS的DMEM培养液重悬细胞,调整细胞密度为5×105/ml,转移至6孔板中,每孔加2 ml,饥饿处理16 h后用于后续实验。
1.2.2TGF-β2诱导细胞EMT 将饥饿处理16 h的细胞分为对照组和TGF-β2诱导组,其中对照组细胞用不含血清和青链霉素混合液的DMEM培养基培养,TGF-β2组细胞在不含血清和青链霉素混合液的DMEM培养基中与10 ng/ml TGF-β2共培养,培养48 h后用于后续实验。
1.2.3细胞转染 将细胞分为miR-155抑制剂组和miR-155阴性对照组。转染前24 h将待转染ARPE-19细胞转移至6孔板中,调整细胞密度约为5×105/ml,待细胞融合至80%以上时,按照Lipofectamine 2000说明书中所示步骤,分别将miR-155 抑制剂、miR-155 阴性对照和Lipofectamine 2000用DMEM培养液稀释,室温孵育5 min,将miR-155抑制剂和miR-155阴性对照稀释液分别与Lipofectamine 2000稀释液混合,室温孵育15 min后,将上述混合液分别加入miR-155抑制剂组和miR-155阴性对照组细胞培养液内,用终质量浓度10 ng/ml TGF-β2的DMEM培养基共培养48 h后用于后续实验。
1.2.4逆转录PCR检测细胞内miR-155表达 将对照组和TGF-β2组细胞用Trizol法提取细胞总RNA,行逆转录反应。miR-155引物序列:正向引物为5’-CGTTGCTAGGCTAGGCTAGC-3’,反向引物为 5’-GCTATGCTAGGCTAGCTTGC-3’;β-actin引物序列:正向引物为5’-TAGGCTTAGGCTAGCCATCA-3’;反向引物为5’-CGTTCGTTAGCTAGGCTACA-3’。反应体系:模板1.0 μl、引物各1.0 μl、Master 12.5 μl,加双蒸水补充至25.0 μl。反应程序:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。取5 μl PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,Image Pro Plus 6.0分析目的基因和参比基因的条带灰度值比值。
1.2.5细胞划痕实验检测细胞迁移能力 将细胞接种于6孔板中,细胞密度为5×105/ml,每孔2 ml,板底预先做好横向标记线,继续培养,待细胞融合至80%以上时,用含2% FBS的DMEM培养液饥饿培养8 h,再用20 μl移液器枪头在培养板中央均匀划“一”字形划痕,用PBS轻柔洗去脱落细胞,然后按1.2.2和1.2.3方法进行分组处理,每组设3个复孔,取平均值,实验独立重复操作3次。分别在划痕后0 h和48 h于倒置显微镜下测量划痕宽度并拍照记录。细胞迁移能力用迁移率表示,细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.6Transwell小室实验检测细胞侵袭能力 将各组处理培养48 h后的细胞重悬于含1% FBS的DMEM培养基中,添加至Transwell小室上室,上室中细胞数目约1×105个,下室中添加含10% FBS的DMEM培养基,培养后48 h将Transwell小室取出,于质量分数4%多聚甲醛中固定15 min,PBS洗涤1次后,结晶紫染色5 min,于普通光学显微镜下任意选取5个视野观察透过小室膜的细胞数,取平均值。每组实验独立重复3次。
1.2.7Western bolt法检测细胞内PTEN、PI3K、Akt、p-Akt、E-cad、ZO-1、F-actin、α-SMA、vimentin、FN-l蛋白表达 miR-155抑制剂组和miR-155阴性对照组细胞转染48 h后,胰蛋白酶消化细胞后收集细胞,RIPA裂解液提取总蛋白,将蛋白样品加入SDS-PAGE凝胶加样孔进行电泳,使蛋白条带转移至PVDF膜,质量分数5%脱脂奶粉室温封闭2 h,TBST温和洗膜3 min后分别加入PTEN(1∶ 500)、PI3K(1∶ 500)、Akt(1∶ 1 000)、p-Akt(1∶ 1 000)、E-cad(1∶ 500)、ZO-1(1∶ 500)、F-actin(1∶ 500)、α-SMA(1∶ 500)、vimentin(1∶ 500)和FN-1(1∶ 500)一抗,4 ℃孵育过夜,TBST洗涤3次,每次10 min,加入相应二抗(1∶ 4 000),室温下孵育1 h,TBST洗涤3次,每次10 min,加入配制好的ECL发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息。图片用ImagePro Plus 6.0软件进行灰度分析,以GAPDH为内参,分析目的蛋白条带灰度。每个实验独立重复3次。
1.2.8miR-155靶基因预测及双荧光素酶报告基因分析 采用靶基因数据库TargetScan、miRanda预测miR-155下游靶基因为PTEN,将PTEN与miR-155结合互补区突变并构建荧光素酶报告载体,将未突变PTEN记为野生型(PTEN-3’-UTR-WT),将突变的PTEN记为突变型(PTEN-3’-UTR-MT),将二者分别与miR-155 抑制剂/阴性对照共转染至ARPE-19细胞中,培养后48 h依据荧光素酶检测试剂盒检测PTEN荧光素酶活性变化。每组实验独立重复3次,取平均值。
1.3 统计学分析
采用SPSS 20.0统计学软件进行统计分析。本研究中计量资料经Shapiro-Wilk检验证实符合正态分布,以mean±SD表示。对照组和TGF-β2组、miR-155抑制剂组和miR-155 阴性对照组间各计量数据比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞形态变化
培养后48 h,对照组细胞状态良好,细胞间连接紧密,形状规则。TGF-β2组细胞呈较明显的梭形或纺锤体形状,多数细胞表现为纤维状,细胞排列松散(图1)。

图1 倒置显微镜下观察对照组与TGF-β2组细胞形态(×200,标尺=50 μm) A:对照组细胞状态良好,细胞间连接紧密,形状规则B:TGF-β2组细胞呈较明显的梭形或纺锤体形状,多数细胞表现为纤维状,细胞排列松散Figure 1 The cell morphology of the control group and TGF-β2 group under an inverted microscope (×200,scale bar=50 μm) A:The cells of the control group were in good condition with tight adherence and regular shape B:The cells in the TGF-β2 group showed more obvious spindle shape with loose arrangement,and most of the cells were fibrous
2.2 各组细胞miR-155表达变化
TGF-β2组细胞miR-155相对表达量为0.92±0.14,明显高于对照组的0.35±0.06,差异有统计学意义(t=7.242,P=0.003)。miR-155抑制剂组细胞miR-155相对表达量为0.21±0.03,明显低于miR-155阴性对照组的0.98±0.09,差异有统计学意义(t=12.421,P<0.01)。
2.3 各组细胞迁移和侵袭能力变化
细胞划痕实验结果显示,划痕后48 h,TGF-β2组细胞向划痕区域迁移较对照组明显,miR-155阴性对照组细胞向划痕区域迁移较miR-155抑制剂组明显(图2);TGF-β2组细胞迁移率明显高于对照组,差异有统计学意义(t=15.225,P<0.01),miR-155阴性对照组细胞迁移率明显高于miR-155抑制剂组,差异有统计学意义(t=16.211,P<0.01)(表1)。
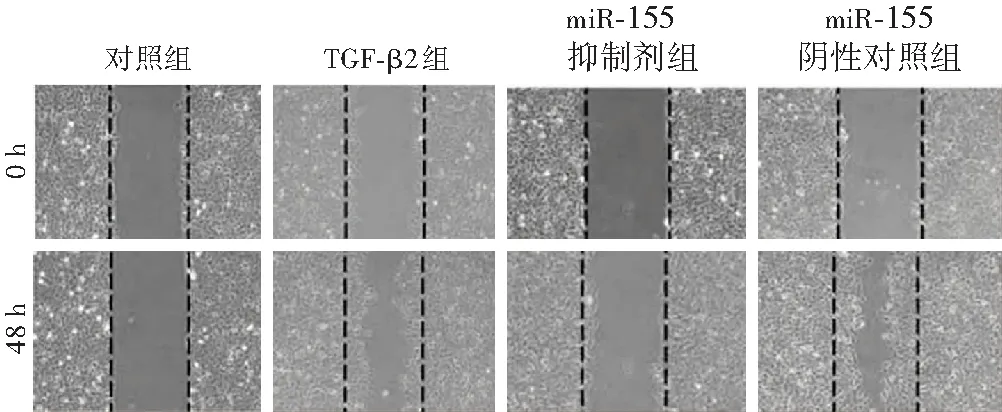
图2 划痕实验观察各组细胞迁移情况(×200,标尺=100 μm) 划痕后48 h,对照组和miR-155抑制剂组几乎无细胞向划痕区迁移,而TGF-β2组和miR-155阴性对照组细胞向划痕区迁移明显 TGF-β2:转化生长因子-β2;miR-155:微小RNA-155Figure 2 The cell migration of different groups observed by scratch test(×200,scale bar=100 μm) At 48 hours after the scratch,almost no cell migrated to the scratch area in the control group and miR-155 inhibitor group,while a large number of cells in the TGF-β2 group and the miR-155 negative control group migrated to the scratch area TGF-β2:transforming growth factor-β2;miR-155:microRNA-155
Transwell小室实验结果显示,培养后48 h,TGF-β2组穿过基底膜细胞数明显多于对照组,差异有统计学意义(t=9.931,P<0.01);miR-155阴性对照组穿过基底膜细胞数明显多于miR-155抑制剂组,差异有统计学意义(t=10.285,P<0.01)(表1)。
2.4 各组细胞PTEN、PI3K、Akt和p-Akt蛋白表达变化
与对照组比较,TGF-β2组细胞PTEN蛋白相对表达量降低,PI3K蛋白相对表达量升高,p-Akt/Akt比值升高,差异均有统计学意义(t=7.644,P=0.002;t=5.026,P=0.005;t=10.027,P<0.01)。与miR-155阴性对照组比较,miR-155抑制剂组细胞PTEN蛋白相对表达量增加,PI3K蛋白相对表达量下降,p-Akt/Akt比值下降,差异均有统计学意义(t=15.854,P<0.01;t=6.395,P=0.01;t=12.028,P<0.01)(图3,表2)。
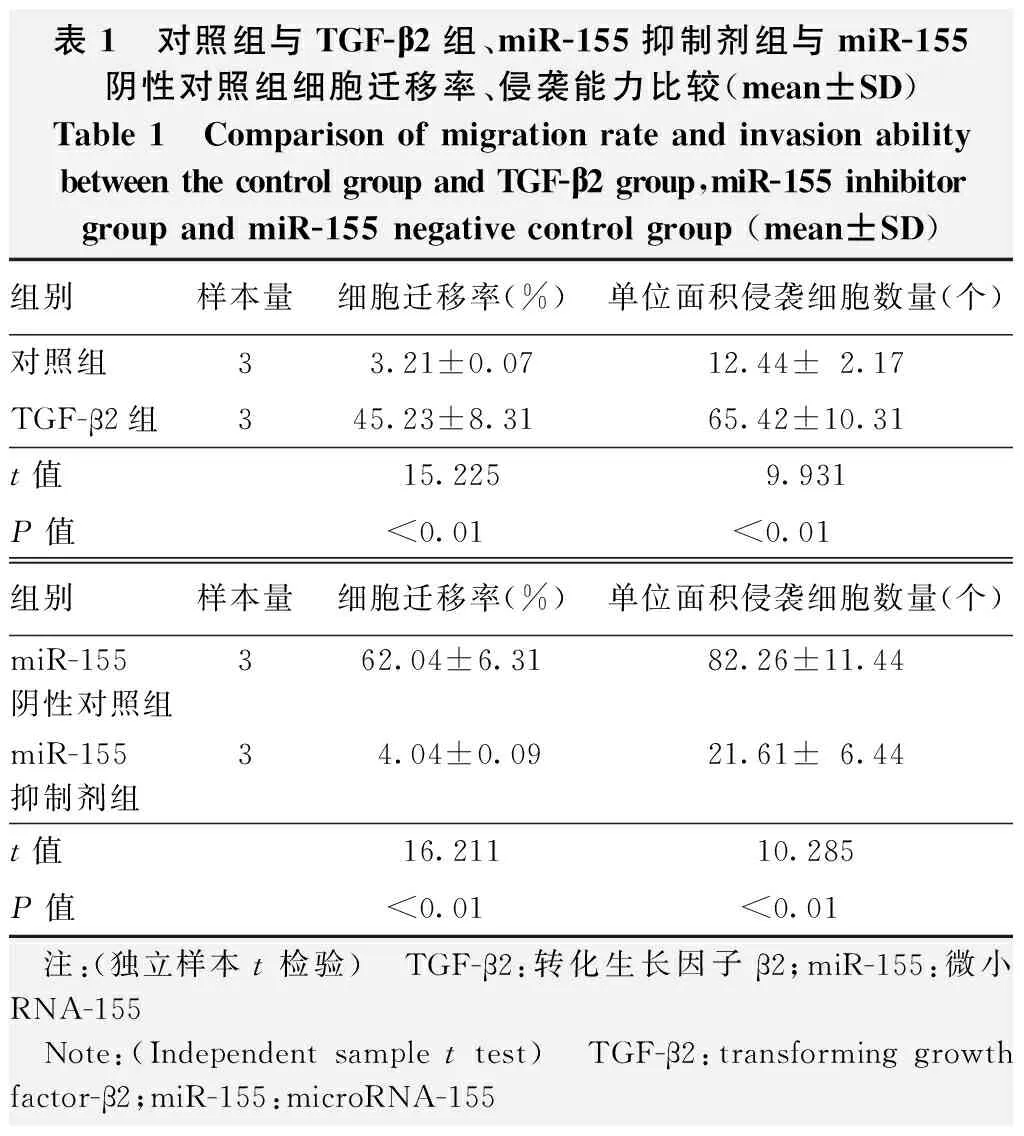
表1 对照组与TGF-β2组、miR-155抑制剂组与miR-155阴性对照组细胞迁移率、侵袭能力比较(mean±SD)Table 1 Comparison of migration rate and invasion ability between the control group and TGF-β2 group,miR-155 inhibitorgroup and miR-155 negative control group (mean±SD)组别样本量细胞迁移率(%)单位面积侵袭细胞数量(个)对照组33.21±0.0712.44±2.17TGF-β2组345.23±8.3165.42±10.31t值15.2259.931P值<0.01<0.01组别样本量细胞迁移率(%)单位面积侵袭细胞数量(个)miR-155阴性对照组3 62.04±6.31 82.26±11.44 miR-155抑制剂组3 4.04±0.09 21.61±6.44 t值16.21110.285P值<0.01<0.01 注:(独立样本t检验) TGF-β2:转化生长因子β2;miR-155:微小RNA-155 Note:(Independent sample t test) TGF-β2:transforming growth factor-β2;miR-155:microRNA-155
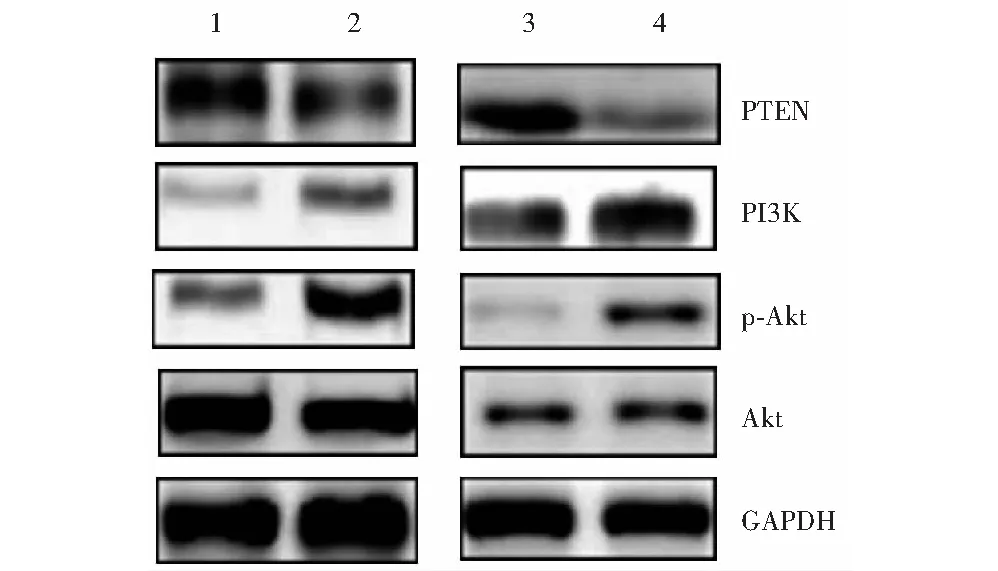
图3 各组细胞PTEN、PI3K、Akt和p-Akt蛋白表达电泳图 1:对照组;2:TGF-β2组;3:miR-155抑制剂组;4:miR-155阴性对照组 PTEN:磷酸酶及张力蛋白同源物;PI3K:磷酸肌醇-3-激酶;Akt:蛋白激酶B;GAPDH:甘油醛-3-磷酸脱氢酶;TGF-β2:转化生长因子β2Figure 3 Electrophoretogram of PTEN,PI3K,Akt,p-Akt protein in each group 1:control group;2:TGF-β2 group;3:miR-155 inhibitor group;4:miR-155 negative control group PTEN:phosphate and tension homology deleted on chromosome ten gene;PI3K:phosphatidylinositol 3-kinase;Akt:protein kinase B;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;TGF-β2:transforming growth factor-β2
2.5 各组细胞EMT标志蛋白表达变化
与对照组相比较,TGF-β2组细胞E-cad、ZO-1、F-actin蛋白相对表达量明显降低,α-SMA、FN-l、vimentin相对表达量明显升高,差异均有统计学意义(t=6.855,P<0.01;t=8.648,P<0.01;t=13.685,P<0.01;t=9.036,P=0.01;t=6.578,P<0.01;t=10.021,P=0.002);与miR-155阴性对照组相比较,miR-155 抑制剂组细胞E-cad、ZO-1、F-actin蛋白相对表达量升高,α-SMA、FN-l、vimentin蛋白相对表达量明显降低,差异均有统计学意义(t=8.043,P=0.002;t=4.957,P=0.005;t=5.885,P=0.000;t=10.855,P=0.002;t=8.033,P=0.002;t=10.196,P=0.002)(图4,表3)。
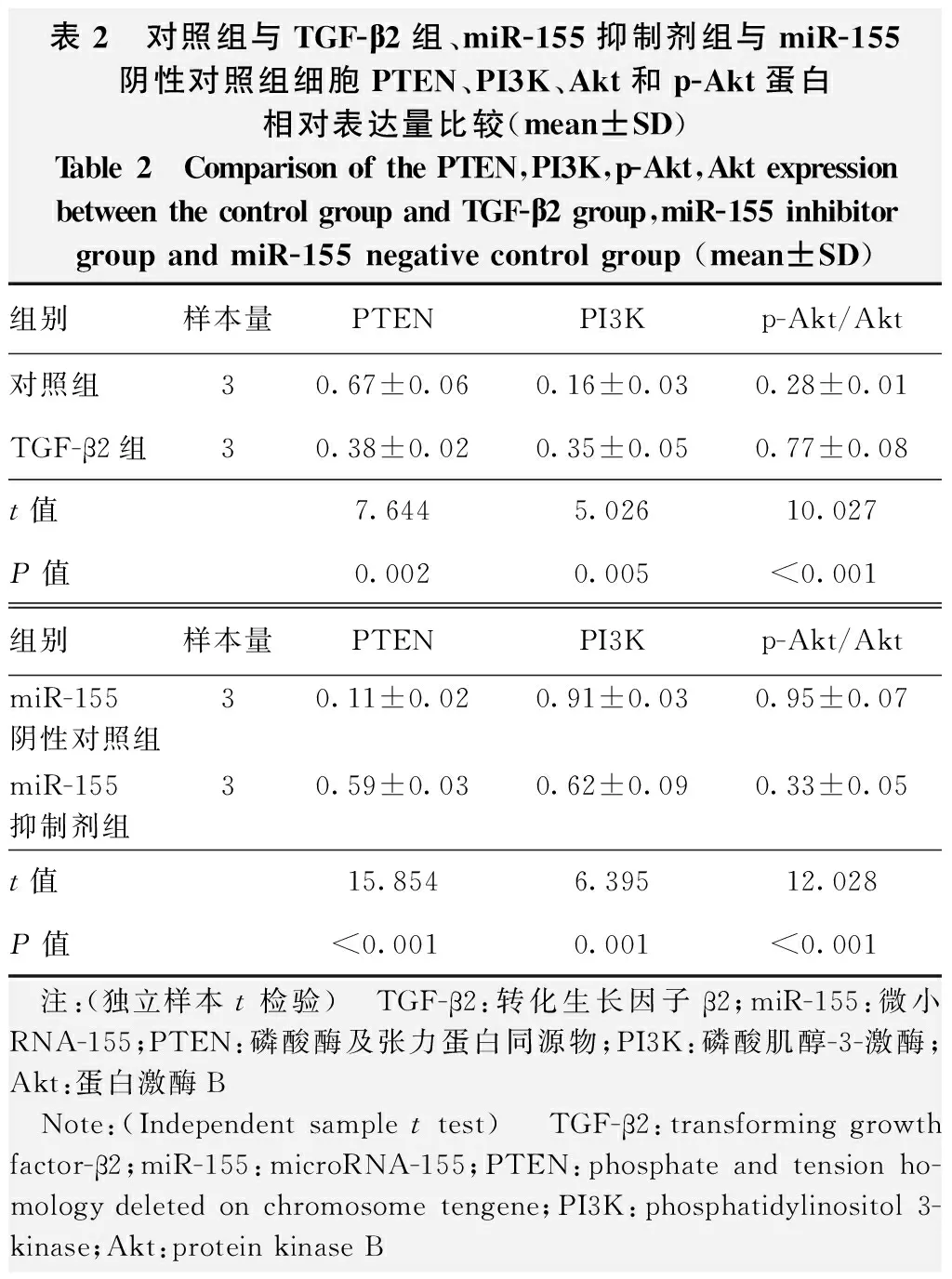
表2 对照组与TGF-β2组、miR-155抑制剂组与miR-155阴性对照组细胞PTEN、PI3K、Akt和p-Akt蛋白相对表达量比较(mean±SD)Table 2 Comparison of the PTEN,PI3K,p-Akt,Akt expression between the control group and TGF-β2 group,miR-155 inhibitorgroup and miR-155 negative control group (mean±SD)组别样本量PTENPI3Kp-Akt/Akt对照组30.67±0.060.16±0.030.28±0.01TGF-β2组30.38±0.020.35±0.050.77±0.08t值7.6445.02610.027P值0.0020.005<0.001组别样本量PTENPI3Kp-Akt/AktmiR-155阴性对照组3 0.11±0.02 0.91±0.03 0.95±0.07 miR-155抑制剂组3 0.59±0.03 0.62±0.09 0.33±0.05 t值15.8546.39512.028P值<0.0010.001<0.001 注:(独立样本t检验) TGF-β2:转化生长因子β2;miR-155:微小RNA-155;PTEN:磷酸酶及张力蛋白同源物;PI3K:磷酸肌醇-3-激酶;Akt:蛋白激酶B Note:(Independent sample t test) TGF-β2:transforming growth factor-β2;miR-155:microRNA-155;PTEN:phosphate and tension ho-mology deleted on chromosome tengene;PI3K:phosphatidylinositol 3-kinase;Akt:protein kinase B
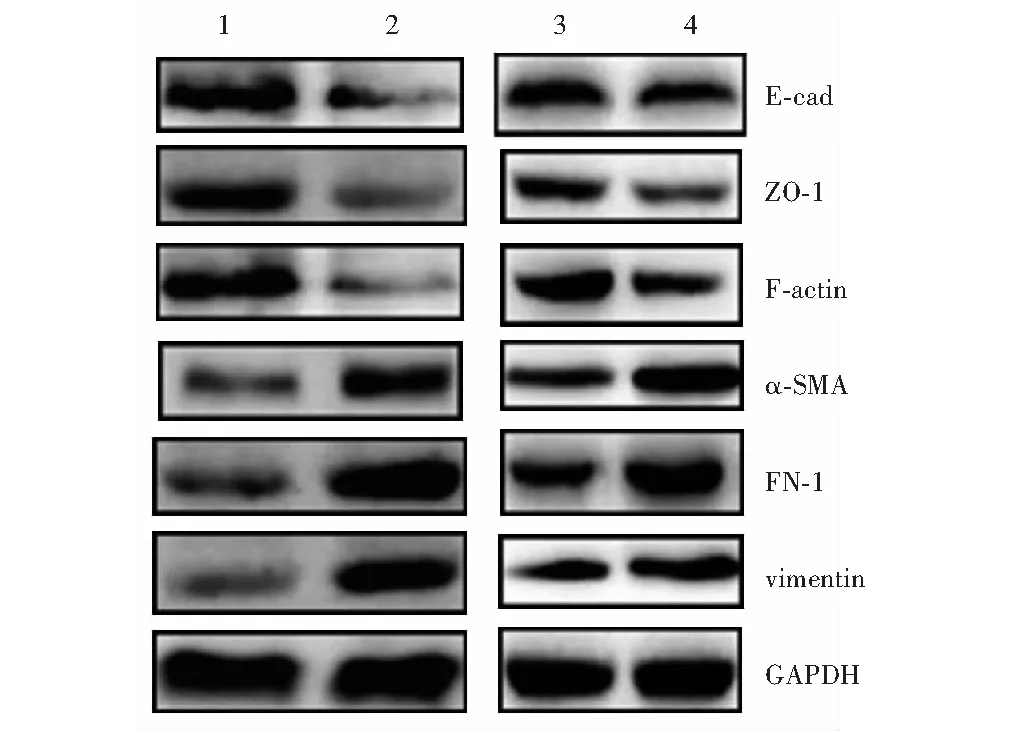
图4 各组细胞EMT标志蛋白表达电泳图 1:对照组;2:TGF-β2组;3:miR-155抑制剂组;4:miR-155阴性对照组;E-cad:钙黏蛋白E;ZO-1:闭锁小带蛋白1;F-actin:F-肌动蛋白;α-SMA:α-平滑肌肌动蛋白;FN-l:纤连蛋白1;vimentin:波形蛋白;TGF-β2:转化生长因子β2Figure 4 Electrophoretogram of EMT related protein in each group 1:control group;2:TGF-β2 group;3:miR-155 inhibitor group;4:miR-155 negative control group;E-cad:E-cadherin;ZO-1:Zonula occludens protein 1;α-SMA:α-smooth muscle actin;FN-l:fibronectin 1;TGF-β2:transforming growth factor-β2
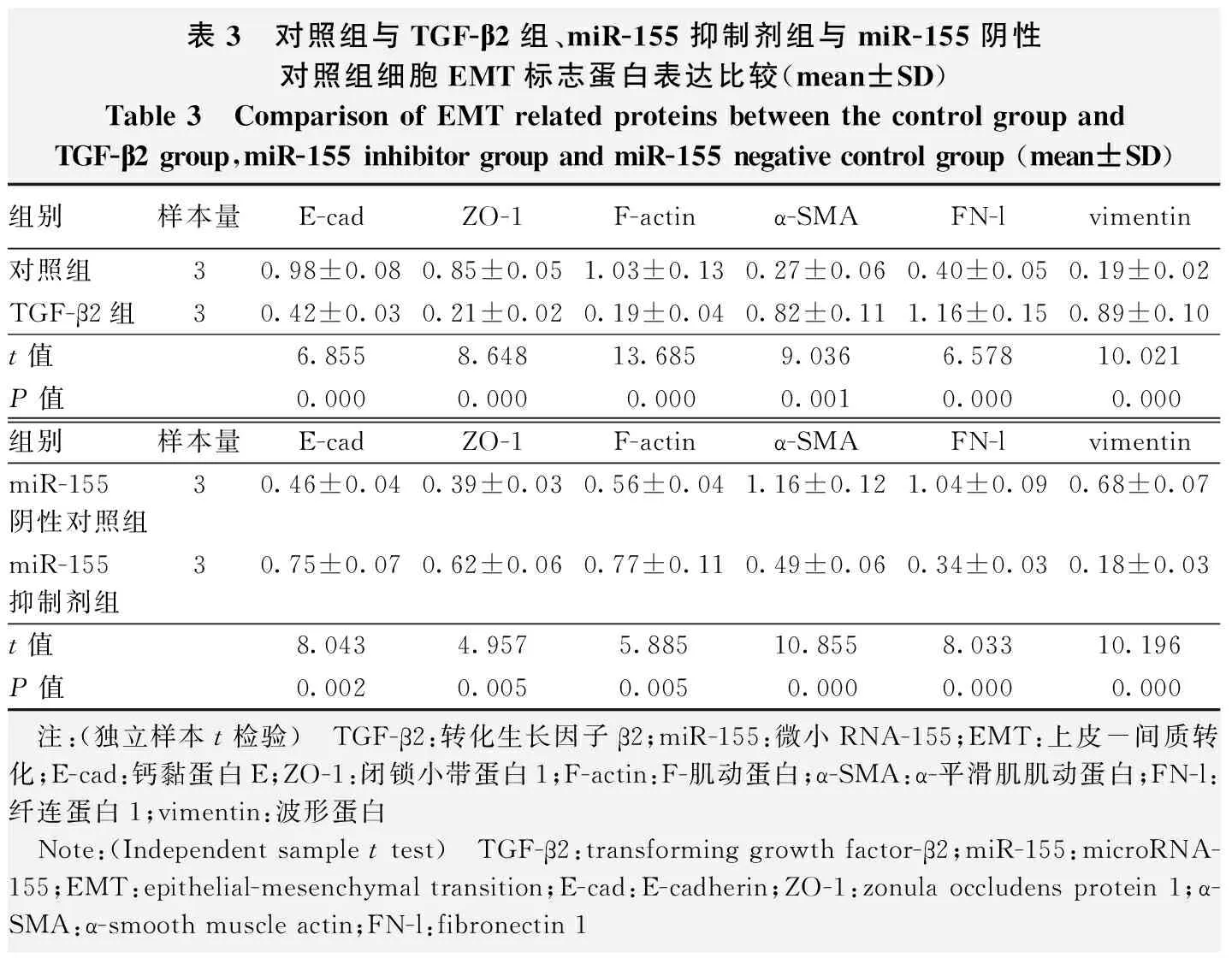
表3 对照组与TGF-β2组、miR-155抑制剂组与miR-155阴性对照组细胞EMT标志蛋白表达比较(mean±SD)Table 3 Comparison of EMT related proteins between the control group and TGF-β2 group,miR-155 inhibitor group and miR-155 negative control group (mean±SD)组别样本量E-cadZO-1F-actinα-SMAFN-lvimentin对照组30.98±0.080.85±0.051.03±0.130.27±0.060.40±0.050.19±0.02TGF-β2组30.42±0.030.21±0.020.19±0.040.82±0.111.16±0.150.89±0.10t值6.8558.64813.6859.0366.57810.021P值0.0000.0000.0000.0010.0000.000组别样本量E-cadZO-1F-actinα-SMAFN-lvimentinmiR-155阴性对照组3 0.46±0.04 0.39±0.03 0.56±0.04 1.16±0.12 1.04±0.09 0.68±0.07 miR-155抑制剂组3 0.75±0.07 0.62±0.06 0.77±0.11 0.49±0.06 0.34±0.03 0.18±0.03 t值8.0434.9575.88510.8558.03310.196P值0.0020.0050.0050.0000.0000.000 注:(独立样本t检验) TGF-β2:转化生长因子β2;miR-155:微小RNA-155;EMT:上皮-间质转化;E-cad:钙黏蛋白E;ZO-1:闭锁小带蛋白1;F-actin:F-肌动蛋白;α-SMA:α-平滑肌肌动蛋白;FN-l:纤连蛋白1;vimentin:波形蛋白 Note:(Independent sample t test) TGF-β2:transforming growth factor-β2;miR-155:microRNA-155;EMT:epithelial-mesenchymal transition;E-cad:E-cadherin;ZO-1:zonula occludens protein 1;α-SMA:α-smooth muscle actin;FN-l:fibronectin 1
2.6 miR-155靶基因预测
miR-155通过靶向识别3’-UTR抑制PTEN的表达(图5)。双荧光素酶报告系统结果显示,miR-155抑制剂组野生型PTEN细胞中荧光素酶活性较miR-155阴性对照组增强,差异有统计学意义(t=6.331,P=0.001),2个组转染突变载体的细胞内未观察到明显的荧光素酶活性改变,2个组细胞中荧光素酶活性比较,差异无统计学意义(t=0.192,P=0.810)(表4)。

图5 miR-155靶基因预测结果 miR-155:微小RNA-155;PTEN:磷酸酶及张力蛋白同源物Figure 5 Prediction results of miR-155 target gene miR-155:micro RNA-155;PTEN:phosphate and tension homology deleted on chromosome ten gene
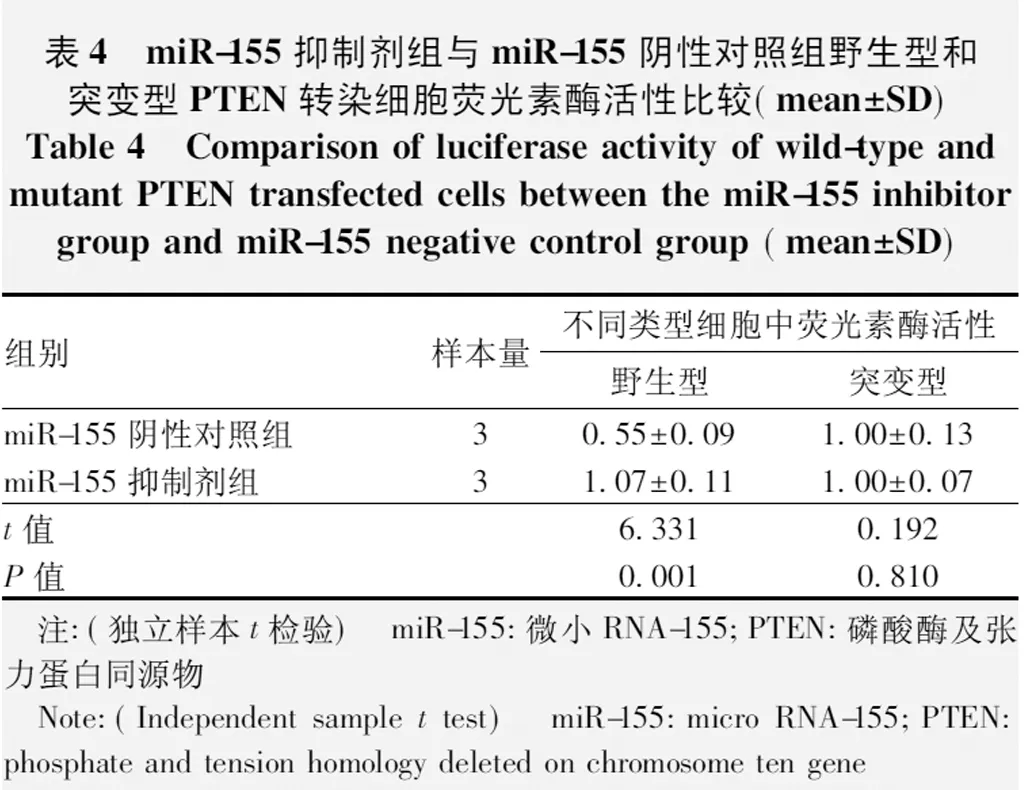
表4 miR-155抑制剂组与miR-155阴性对照组野生型和突变型PTEN转染细胞荧光素酶活性比较(mean±SD)Table 4 Comparison of luciferase activity of wild-type and mutant PTEN transfected cells between the miR-155 inhibitor group and miR-155 negative control group (mean±SD)组别样本量不同类型细胞中荧光素酶活性野生型突变型miR-155阴性对照组30.55±0.091.00±0.13miR-155抑制剂组31.07±0.111.00±0.07t值6.3310.192P值0.0010.810 注:(独立样本t检验) miR-155:微小RNA-155;PTEN:磷酸酶及张力蛋白同源物 Note:(Independent sample t test) miR-155:micro RNA-155;PTEN:phosphate and tension homology deleted on chromosome ten gene
3 讨论
EMT是由完全极化的细胞锚定基底膜的基底表面而发生形态和功能的改变,从而获得间质表型。EMT是胚胎发育、肿瘤转移和器官组织纤维化的标志[10]。TGF-β2可以诱导多种细胞的EMT进程进而引起组织的纤维化[11-12]。近年来研究发现,在PVR病程中,人玻璃体腔内TGF-β2水平显著上升,激活RPE细胞发生EMT,这种激活的RPE细胞进而转移、扩散,并转化成为纤维细胞,最终导致PVR的发生[5-6]。本研究中,经TGF-β2刺激的ARPE-19细胞迁移、侵袭活力较正常培养基培养的细胞均显著提升,同时,上皮细胞标志物E-cad、ZO-1、F-actin的表达下调,而间质细胞标志物α-SMA、FN-l、vimentin表达增加,进一步验证了TGF-β2能诱导RPE细胞发生EMT。miR-155被证实与多种眼科疾病的发生有关,Kutty等[9]研究发现,miR-155在炎性暴露的RPE细胞中表达增加11倍。另有研究发现,miR-155高表达能加速糖尿病视网膜微血管病变的形成[13]。miR-155转染ARPE-19细胞后,具有一定的抗缺氧活性[14]。同时,miR-155对多种细胞的EMT过程有调控作用,miR-155在肝脏肿瘤细胞中的过表达显著增加细胞的运动性和侵袭性,以及EMT过程[15];Kong等[16]研究证实,miR-155通过激活PI3K/ SGK3 /β-catenin信号通路促进肝癌细胞发生EMT。本研究发现,TGF-β2能诱导ARPE-19细胞表达miR-155,转染miR-155抑制剂后,细胞的迁移、侵袭能力下调,同时上皮细胞标志蛋白增加,而间质细胞标志蛋白表达减少,提示miR-155能诱导ARPE-19细胞发生EMT。
TGF-β2诱导EMT发生的通路包括Smad经典通路和非经典通路,PI3K/Akt是非经典通路之一[15]。PI3K/Akt信号转导通路是细胞内重要的通路之一,其通过对下游多种效应因子的影响,诱导细胞增生,发生EMT,抑制细胞凋亡,同时促进血管生成[17]。研究表明,胰岛素和TGF-β2能诱导RPE细胞PI3K/Akt信号通路的活化,从而加速RPE细胞的EMT进程[17-18]。本研究发现,经TGF-β2刺激的ARPE-19细胞中PI3K表达及Akt的活化程度均上调,该结果与文献报道一致。PTEN是一种重要的抑癌基因,能负向调控PI3K/Akt信号通路活性,在PVR的发病过程中有重要作用[19],Lin等[20]报道miR-29能靶向PTEN调控高糖引起的人RPE细胞凋亡。本研究采用靶基因数据库TargetScan、miRanda预测及荧光素酶报告载体鉴定证实PTEN为miR-155下游靶基因,miR-155抑制剂能上调ARPE-19细胞中PTEN的表达,同时下调PI3K蛋白水平及Akt的活化。提示miR-155可能通过靶向抑制PTEN的表达而激活下游PI3K/Akt信号通路,从而诱导RPE细胞的EMT过程。
综上所述,本研究结果表明miR-155能正向调控TGF-β2诱导的人RPE细胞EMT过程,其作用机制可能与抑制靶基因PTEN的表达,进而刺激PI3K/Akt信号通路活化有关。
利益冲突所有作者均声明不存在利益冲突

