兔眼玻璃体腔注射重组人血管内皮抑制素的安全性研究
夏颖 陈放 杜伟 朱俊 贾舒雅 马海莹 解正高
扬州大学附属苏北人民医院眼科 225001 夏颖现在南京医科大学附属无锡第二医院眼科 214000 解正高现在南京大学医学院附属鼓楼医院眼科 210008
增生性糖尿病视网膜病变、湿性年龄相关性黄斑变性、视网膜静脉阻塞、早产儿视网膜病变等是常见的新生血管性眼病[1]。抑制血管生成是治疗新生血管性眼病的主要方法之一,其中抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物临床疗效显著[2-4]。然而,价格昂贵限制了其在临床的普及应用[5]。血管内皮抑制素是胶原蛋白XVIII分子C端的水解片段,是迄今发现的最有效的内源性血管生成抑制因子之一[6]。研究表明,重组人血管内皮抑制素(recombinant human endostatin,rh-endostatin)可以抑制实验动物的脉络膜新生血管(choroidal neovascularization,CNV)形成,并且可以有效抑制人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)的增生、迁移、侵袭以及管腔样结构形成[7-8]。目前,rh-endostatin眼内应用的安全性研究尚未见报道,本研究探讨正常兔眼玻璃体腔注射不同剂量rh-endostatin后眼内结构和功能变化,探讨其眼内注射的安全性。
1 材料与方法
1.1 材料
1.1.1实验动物 选取健康雄性成年新西兰白兔30只(由扬州大学医学院动物中心提供),质量2.0~2.5 kg。实验严格按照国家和扬州大学医学院动物中心动物使用管理条例进行。
1.1.2主要试剂及仪器 rh-endostatin注射液(山东先声麦得津生物制药有限公司,批号:S20050088,规格:15 mg/3 ml);复方托吡卡胺滴眼液(日本参天制药株式会社);盐酸丙美卡因滴眼液(瑞士诺华公司)。iCARE手持眼压计(TA 01,芬兰TiolatOy公司);光相干断层扫描仪(optical coherence tomography,OCT)(Cirrus HD-OCT 4000,德国Zeiss公司);视觉电生理检查仪(APS-2000AER,重庆康华瑞明科技股份有限公司);光学显微镜(日本Nikon公司);透射电子显微镜(HT7700,日本日立公司)。
1.2 方法
1.2.1实验分组及处理 取实验兔常规行裂隙灯显微镜、直接检眼镜检查,排除眼部疾患,均取右眼为实验眼。按照计算机数字随机分配法将实验兔随机平均分为0.125 mg rh-endostatin组、0.250 mg rh-endostatin组、0.500 mg rh-endostatin组、生理盐水组和正常对照组,每组6只眼。取rh-endostatin注射液用生理盐水分别稀释成0.125 mg/100 μl、0.250 mg/100 μl和0.500 mg/100 μl。各药物注射组玻璃体腔分别注入100 μl相应质量浓度的rh-endostatin;生理盐水组玻璃体腔注射100 μl生理盐水;正常对照组不予任何处理。玻璃体腔注药方法[9-10]如下:应用质量分数3%戊巴比妥钠按1 ml/kg耳缘静脉注射行全身麻醉,于注射前30 min复方托吡卡胺滴眼液点眼扩瞳,盐酸丙美卡因滴眼液点眼行表面麻醉,开睑器开睑,质量分数5%聚维酮碘冲洗结膜囊;以1 ml注射器连接30 G针头,在手术显微镜下,于颞上象限距角膜缘约2.5 mm处进针约8 mm,期间避免误伤晶状体,将rh-endostatin或生理盐水注入玻璃体腔中央,推注完毕后拨出注射器,同时用显微镊夹持穿刺口3 s,取1 ml注射器针头行前房穿刺,抽出约0.1 ml的房水;注射给药后常规氧氟沙星眼膏涂术眼1周,每日2次。
图1 各组兔眼玻璃体腔注射前后不同时间点眼底OCT图像 各组不同时间点眼底均未见异常 rh-endostatin:重组人血管内皮抑制素Figure 1 Fundus OCT images of rabbits eyes among different groups at different time points before and after intravitreal injection No abnormal fundus was observed at different time points in any group rh-endostatin:recombinant human endostatin
1.2.2兔眼前后节结构检查及眼压测量 注射给药后观察实验兔的休息状态、进食、大小便等全身情况变化。分别于注射前,注射后1、3、7、14、30和60 d在裂隙灯显微镜下检查各组术眼眼前节,间接检眼镜下观察玻璃体和视网膜,应用iCARE手持眼压计测量眼压,每个时间点眼压测量3次,取平均值。分别于注射前,注射后7、30和60 d行OCT检查,选择兔眼视盘鼻侧下方约1个视盘直径处进行扫描检查。
1.2.3闪光视网膜电图检查 分别于注射前,注射后14和60 d行闪光视网膜电图检查各组实验眼功能变化。应用复方托吡卡胺滴眼液扩瞳并暗适应至少30 min,于全身麻醉下进行视觉电生理检查仪检查。使用动物实验专用电极,将角膜电极置于角膜表面,参考电极和接地电极分别置于面颊和额部正中皮下。采用全视野刺激球白色闪光刺激,背景无色,通频带低频为300 Hz,高频为0.1 Hz,刺激模式为单刺激,频率为0.05 Hz,闪光强度为6.325×10-1cd·s/m2,刺激次数为5次,放大倍数为10万倍,每次采样时间250 ms。兔头部置于刺激球中央,记录暗适应下最大混合反应,每只动物记录稳定波形3次。
1.2.4组织病理学检查 于注射给药后60 d检查各组实验眼视网膜结构变化,耳缘静脉注射过量戊巴比妥钠处死实验兔,迅速摘取术眼眼球。各组取3只眼球,剪开角膜并浸入体积分数10%的酸性甲醛溶液中固定48 h,梯度乙醇脱水,石蜡包埋,沿眼球矢状位行4 μm厚连续切片,常规行苏木精-伊红染色,光学显微镜下观察视网膜结构变化。
1.2.5透射电子显微镜下观察各组视网膜超微结构变化 于注射给药后60 d,各组另取3只眼球,4 ℃条件下于体积分数2.5%戊二醛电子显微镜固定液中分离出后极部视网膜,所有操作在1 min内完成。取后极部视网膜于4 ℃条件下2.5%戊二醛溶液中固定24 h,磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗3次,4 ℃条件下于体积分数1%锇酸固定液中固定3 h,用PBS漂洗3次。梯度乙醇脱水,环氧树脂包埋。应用超薄切片机切片,切片厚度为60~80 nm,切片行枸橼酸铅和醋酸双氧铀染色。透射电子显微镜下观察视网膜超微结构。
1.3 统计学方法
采用SPSS 22.0统计学软件进行统计分析。本研究中计量资料经W检验证实呈正态分布,以mean±SD表示,并经方差齐性检验证实方差齐,各实验组注药前后不同时间点眼压值及a、b波振幅值的总体差异比较均采用重复测量两因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组兔眼玻璃体腔注射前后不同时间点兔眼前后节结构改变
不同质量浓度rh-endostatin玻璃体腔注射后实验兔均精神良好,饮水、进食正常。注射过程中,0.500 mg rh-endostatin组有1只眼发生结膜下出血,并于14 d时出血全部吸收。注射后1 d,0.125 mg组、0.500 mg组各有1只眼前房出现絮状渗出物,分别在注射后7 d和14 d吸收。在观察期间,未发生感染性眼内炎、角膜损伤、白内障、玻璃体积血及视网膜脱离等并发症。OCT检查结果显示,各组注射前后不同时间点眼底均未见明显改变(图1)。
2.2 各组玻璃体腔注射前后不同时间点眼压变化
各组玻璃体腔注射前后不同时间点眼压值比较,差异均无统计学意义(F分组=0.134,P=0.969;F时间=1.709,P=0.157);不同时间和分组之间不存在明显交互作用(F交互作用=1.097,P=0.369)(表1)。
2.3 各组玻璃体腔注射前后不同时间点实验眼功能变化
闪光视网膜电图检查结果显示,各组间a、b波振幅值总体比较,差异均无统计学意义(a波:F分组=0.101,P=0.981;b波:F分组=0.476,P=0.753);玻璃体腔注射前后各时间点间a、b波振幅值比较,差异均无统计学意义(a波:F时间=2.479,P=0.095;b波:F时间=1.706,P=0.201);不同时间和分组之间不存在明显交互作用(a波:F交互作用=0.875,P=0.545;b波:F交互作用=0.245,P=0.960)(表2)。
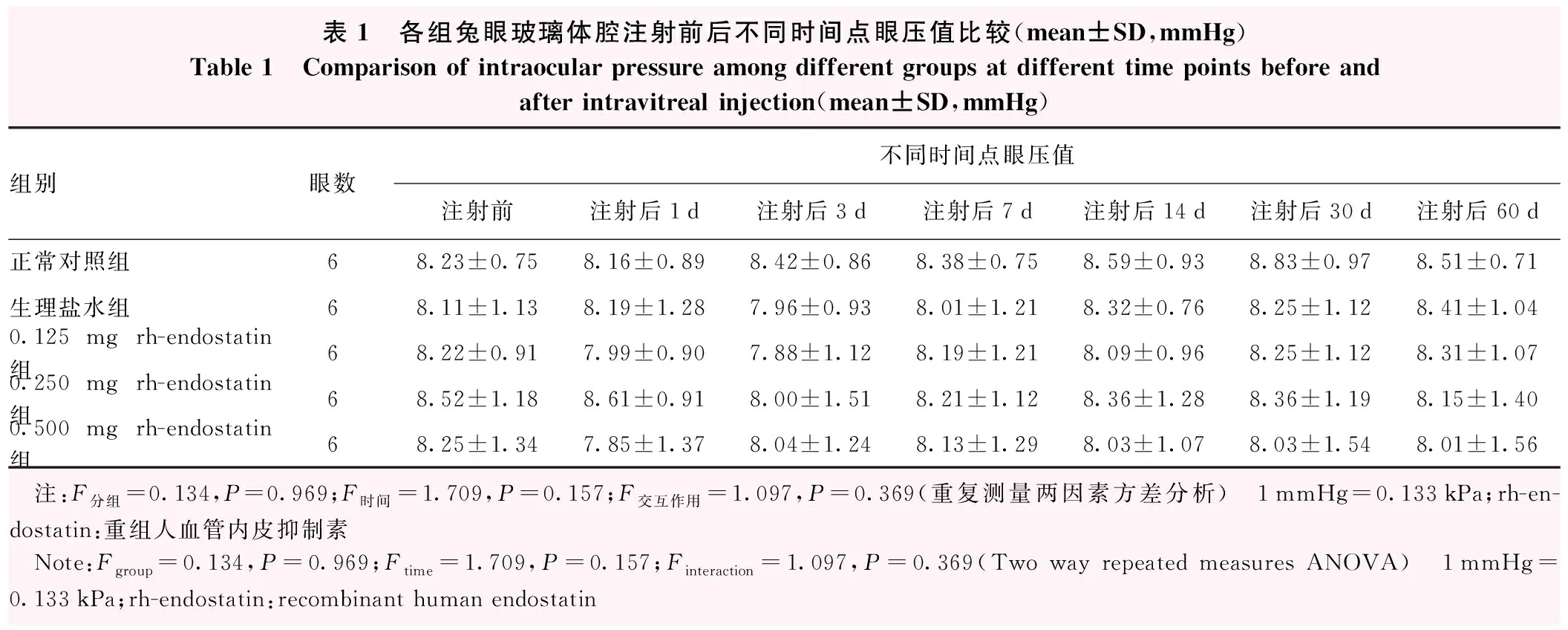
表1 各组兔眼玻璃体腔注射前后不同时间点眼压值比较(mean±SD,mmHg)Table 1 Comparison of intraocular pressure among different groups at different time points before and after intravitreal injection(mean±SD,mmHg)组别眼数不同时间点眼压值注射前注射后1d注射后3d注射后7d注射后14d注射后30d注射后60d正常对照组68.23±0.758.16±0.898.42±0.868.38±0.758.59±0.938.83±0.978.51±0.71生理盐水组68.11±1.138.19±1.287.96±0.938.01±1.218.32±0.768.25±1.128.41±1.040.125mg rh-endostatin组68.22±0.917.99±0.907.88±1.128.19±1.218.09±0.968.25±1.128.31±1.070.250mg rh-endostatin组68.52±1.188.61±0.918.00±1.518.21±1.128.36±1.288.36±1.198.15±1.400.500mg rh-endostatin组68.25±1.347.85±1.378.04±1.248.13±1.298.03±1.078.03±1.548.01±1.56 注:F分组=0.134,P=0.969;F时间=1.709,P=0.157;F交互作用=1.097,P=0.369(重复测量两因素方差分析) 1mmHg=0.133kPa;rh-en-dostatin:重组人血管内皮抑制素 Note:Fgroup=0.134,P=0.969;Ftime=1.709,P=0.157;Finteraction=1.097,P=0.369(Two way repeated measures ANOVA) 1mmHg=0.133kPa;rh-endostatin:recombinant human endostatin
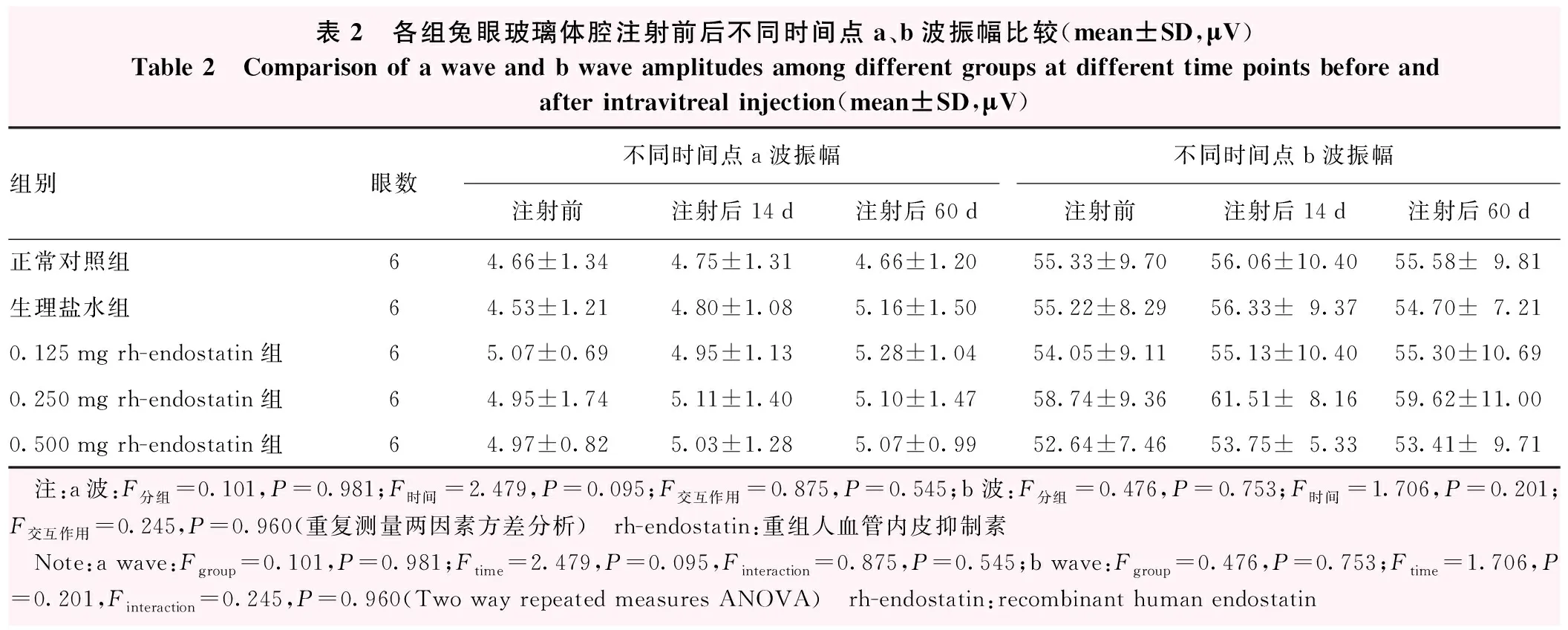
表2 各组兔眼玻璃体腔注射前后不同时间点a、b波振幅比较(mean±SD,μV)Table 2 Comparison of a wave and b wave amplitudes among different groups at different time points before and after intravitreal injection(mean±SD,μV)组别眼数不同时间点a波振幅不同时间点b波振幅注射前注射后14d注射后60d注射前注射后14d注射后60d正常对照组64.66±1.344.75±1.314.66±1.2055.33±9.7056.06±10.4055.58±9.81生理盐水组64.53±1.214.80±1.085.16±1.5055.22±8.2956.33±9.3754.70±7.210.125mg rh-endostatin组65.07±0.694.95±1.135.28±1.0454.05±9.1155.13±10.4055.30±10.690.250mg rh-endostatin组64.95±1.745.11±1.405.10±1.4758.74±9.3661.51±8.1659.62±11.000.500mg rh-endostatin组64.97±0.825.03±1.285.07±0.9952.64±7.4653.75±5.3353.41±9.71 注:a波:F分组=0.101,P=0.981;F时间=2.479,P=0.095;F交互作用=0.875,P=0.545;b波:F分组=0.476,P=0.753;F时间=1.706,P=0.201;F交互作用=0.245,P=0.960(重复测量两因素方差分析) rh-endostatin:重组人血管内皮抑制素 Note:a wave:Fgroup=0.101,P=0.981;Ftime=2.479,P=0.095,Finteraction=0.875,P=0.545;b wave:Fgroup=0.476,P=0.753;Ftime=1.706,P=0.201,Finteraction=0.245,P=0.960(Two way repeated measures ANOVA) rh-endostatin:recombinant human endostatin
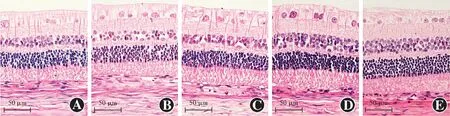
图2 各组玻璃体腔注射后60 d眼球组织病理学观察(HE ×400,标尺=50 μm) 各组视网膜各层组织清晰可见,未见明显结构异常 A:正常对照组 B:生理盐水组 C:0.125 mg rh-endostatin组 D:0.250 mg rh-endostatin组 E:0.500 mg rh-endostatin组Figure 2 Histopathological observation of eyeballs at 60 days after intravitreal injection in each group(HE ×400,scale bar=50 μm) All layers of retina in each group were clearly visible without obvious structural abnormality A:normal control group B:normal saline group C:0.125 mg rh-endostatin group D:0.250 mg rh-endostatin group E:0.500 mg rh-endostatin group
2.4 各组玻璃体腔注射后60 d组织病理学变化
玻璃体腔注射后60 d,各组眼球组织病理学检查均未见明显结构异常,视网膜各层组织清晰可见(图2)。
2.5 各组玻璃体腔注射后60 d视网膜超微结构变化
透射电子显微镜检查结果显示,各组视网膜内核层、外核层细胞核完整,染色质弥散分布,无空泡样改变,光感受器内、外节结构未见异常,外节膜盘排列整齐,结构清晰(图3)。
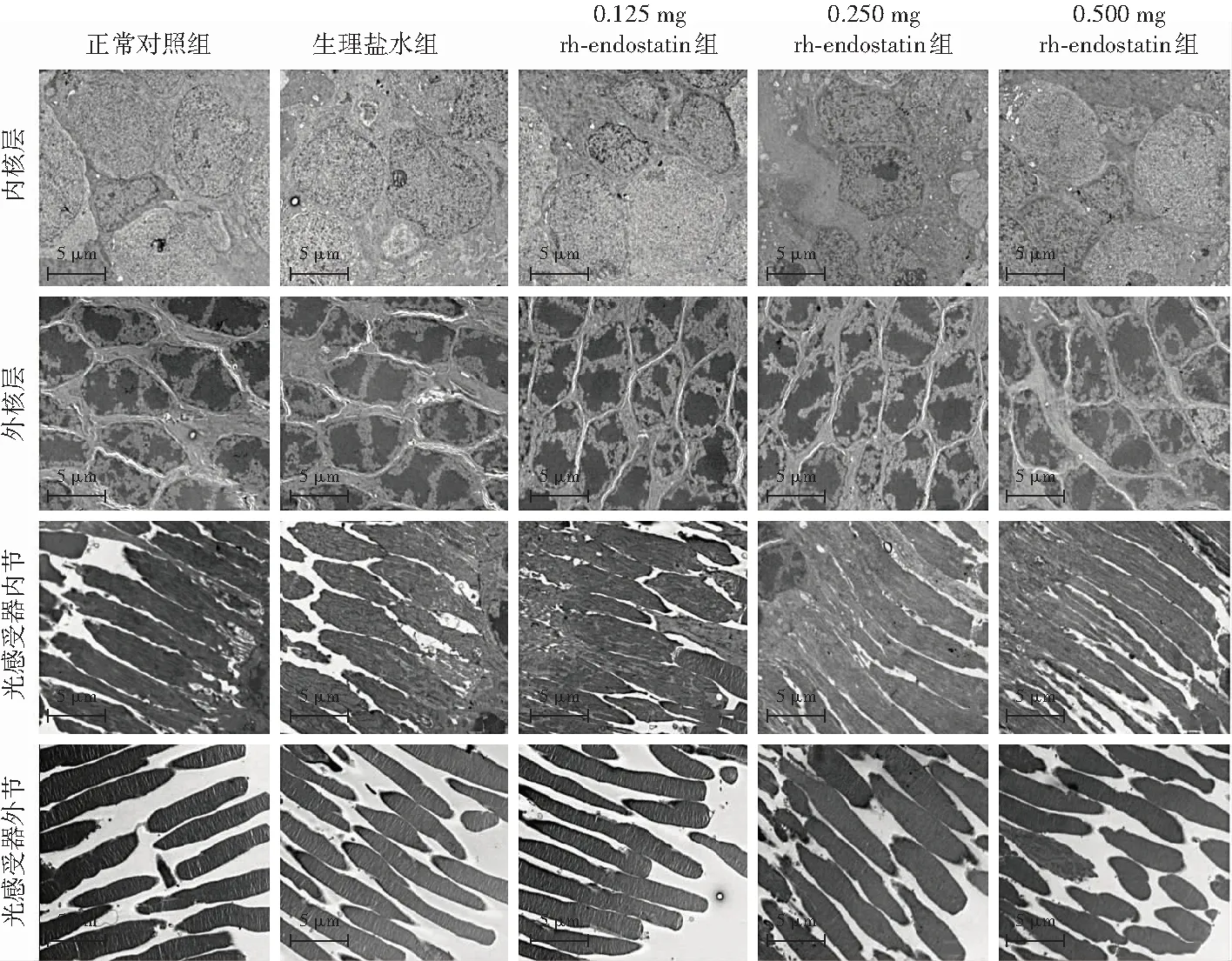
图3 各组玻璃体腔注射后60 d视网膜透射电子显微镜检查(×1 200,标尺=5 μm) 各组视网膜内核层、外核层,光感受器内节、外节细胞结构均正常 rh-endostation:重组人血管内皮抑制素Figure 3 Transmission electron microscopy detection of retina at 60 days after intravitreal injection in each group(×1 200,scale bar=5 μm) The cells in the inner and outer nuclear layers,the inner and outer segments of photoreceptors of retina were normal rh-endostation:recombinant human endostation
3 讨论
新生血管生成受多种因子的调控,其中VEGF是重要的细胞因子[9-11],抗VEGF治疗是抗新生血管生成的主要方法。然而,部分患者对抗VEGF药物无反应,给药后视力不提高,甚至再次出现眼内新生血管[12];另有研究显示,病理性新生血管形成过程涉及除VEGF之外的其他细胞因子[13]。因此,有必要研究其他作用机制的药物。rh-endostatin作为一种内源性血管生成抑制剂,目前主要用于临床非小细胞肺癌的治疗,其主要作用机制是抑制肿瘤新生血管的生成。rh-endostatin可以直接作用于肿瘤周边的毛细血管内皮细胞,而对正常细胞无影响;同时也参与调控VEGF的表达和多种蛋白水解酶的活动,间接抑制病理性新生血管形成[14]。此外,rh-endostatin在中国已实现大批量生产,具有极大的价格优势。
目前已有研究将rh-endostatin用于新生血管性眼病的治疗。有研究发现玻璃体腔注射血管内皮抑制素可以有效抑制高氧诱导的小鼠视网膜新生血管形成和HUVEC的增生[15-16]。静脉注射腺病毒载体提高血液中内皮抑制素浓度同样可以抑制激光诱导的CNV,并且血管内皮抑制素浓度与CNV面积呈负相关[17]。Bai等[18]发现内皮抑制素可以抑制体外培养的HUVEC增生、迁移、管腔形成及VEGF的分泌,并可诱导细胞凋亡;低氧诱导视网膜病变模型鼠玻璃体腔注射内皮抑制素可以使视网膜无灌注区面积由30%降至23%,同时VEGF水平下调。Campochiaro等[19]将表达内皮抑制素和血管抑制素的病毒载体注射至年龄相关黄斑变性患者的视网膜下,发现注射后病灶荧光素渗漏减轻。以上结果提示内皮抑制素对新生血管性眼病具有一定的治疗作用。
目前,临床上rh-endostatin通过静脉给药,在rh-endostatin联合一些标准化疗方案治疗恶性肿瘤的研究中,联合用药并没有增加治疗相关的严重不良反应,主要不良反应为血液和胃肠道毒性,而患者的总缓解率、无进展生存率等指标均有不同程度提高[20-21]。此外,Huang等[22]向小鼠腹腔内注射或者持续泵入rh-endostatin后1周,小鼠心脏、肺脏、肾脏组织及组织中微血管密度均未出现明显异常,但持续泵入rh-endostatin有损伤内皮细胞的可能。新生血管性眼病的治疗主要是玻璃体腔局部给药,因此出现全身并发症的风险极低。目前,玻璃体腔注射内皮抑制素的安全性尚未见报道。本实验通过对玻璃体腔注射0.125~0.500 mg rh-endostatin实验兔进行60 d的观察,并未发现眼压升高或视网膜结构与功能的明显损伤,提示兔眼玻璃体腔注射0.125~0.500 mg rh-endostatin是安全的。此外,本研究与文献[23-24]均使用相同的眼压计测量眼压值,测量结果均低于实验兔的实际眼压,推测其可能与研究中所使用的眼压计原理相关。
本研究结果表明兔眼玻璃体腔注射0.125~0.500 mg rh-endostatin是安全的,为其在抗新生血管性疾病治疗方面的应用提供了实验依据。未来仍需对其在眼内的半衰期及代谢动力学进行研究。
利益冲突所有作者均声明不存在利益冲突

