妊娠期牙周临床指标和龈沟液生物标记物与早产相关性的巢式病例对照研究
叶婵娟 吴敏 陈少武 杨秀巧 李蕙君 朱素君 周方明 郝颖
1.南方医科大学附属深圳妇幼保健院口腔病防治中心,深圳518048;2.南方医科大学附属深圳妇幼保健院妇产科,深圳518048;3.南方医科大学附属深圳妇幼保健院检验科,深圳518048
牙周病是以牙菌斑为始动因素的牙周组织慢性炎症性疾病,局部免疫反应产生大量的炎症介质是主要的致病机制[1]。近20 年来,牙周炎症作为早产(preterm birth,PTB)的一种可能的危险因素受到学者的关注[2]。早产指妊娠满28 周至不足37 周的分娩,占分娩总数的5%~18%,是新生儿死亡和发病的首要原因[3],其机制可能是胎儿胎盘系统炎症介质升高,提前达到子宫激活的阈值,从而触发过早分娩。但目前预测方法不确定。
体内氧压力升高与牙周疾病以及早产等妊娠不良结局相关。8-羟基-2-脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)是一种新型的氧压力生物标志物[4]。
本研究采用巢式病例对照研究(nested casecontrol study,NCCS),检测妊娠妇女的牙周临床指标和龈沟液(gingival crevicular fliud,GCF)生物标记物,包括白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)、前列腺素E2(prostaglandin E2,PGE2)和8-OHdG,并随访妊娠结局,探讨妊娠各期牙周临床指标和GCF生物标记物水平与早产的相关性,评价何种指标有预测早产的可能。
1 材料和方法
1.1 研究对象
选取2017 年1 月—2018 年5 月期间于深圳市妇幼保健院产检的405例孕妇为研究对象。纳入标准:年龄20~40 岁,妊娠36 周以内,无系统性疾病史。排除标准:1)早产史、家族史、多胎妊娠、病理妊娠、妊娠合并症或妊娠并发症;2)精神压力和工作压力过大等[5];3)吸烟、酗酒等不良嗜好;4)3 个月内服用过抗菌素;5)6 个月内做过牙周治疗;6)拒绝随访者。参加本研究的妇女签署书面知情同意书。
1.2 分组
1.2.1 孕周分期 根据纳入时孕周分成4 期,分别为孕早期(9~12周)、孕中早期(13~23周)、孕中后期(24~28周)、孕后期(29~36周)。
1.2.2 分娩结局分组 早产组:分娩周数满28周至不足37 周;足月(full term birth,FTB)组:分娩周数超过37周。
1.2.3 巢式对照组 为了控制混杂因素的影响,使早产组和足月组的年龄、身体质量指数(body mass index,BMI)、职业状况等基线资料均衡可比,每组中按1∶4 匹配选择足月产者组成巢式对照组。
1.3 研究方法
1.3.1 问卷调查 包括人口学构成特征(年龄、文化程度、职业等)、口腔卫生习惯(每天刷牙次数、刷牙方式、牙线使用)及自评牙周炎症症状,并进行口腔卫生指导。
1.3.2 牙周检查 每个牙检查颊(唇)和舌面远中、中央、近中6 个位点。记录牙龈指数(gingival index,GI)、牙周探诊深度(probing depth,PD)和出血指数(bleeding index,BI)。
1.3.3 GCF 的采集和洗提 采用袋内法在牙周检查前采集。采集前嘱孕妇漱口,每位孕妇取口内双侧上颌第一和第二前磨牙的近颊位点[6]。收集前先用无菌棉球拭干牙面和牙龈,隔湿,将消毒纸尖插入龈缘下直至有轻微阻力,留置30 s 后取出,有血则弃之,重新选牙。将4个纸尖集中放在一个EP 管中密封,置于-80 ℃低温冰箱中冻存待查[6]。然后从冰箱中取出装有纸尖的EP管,加入1%PBS,静置1 h后,4 ℃下10 000 r·min-1离心10 min,取上清液待测[6]。采用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测,使用人PGE2、IL-1β、IL-6、TNF-α 和8-OHDG 试 剂盒,严格按照说明书的步骤进行操作,在酶标仪上读取450 nm 波长下的光密度(optical density,OD)值,绘制标准曲线,得出相应浓度。
1.3.4 随访并记录妊娠结局 满28 周至不足37 周为早产,满37周以后为足月。
1.4 统计学处理
采用SPSS 20.0 统计软件进行分析,计量资料以均数±标准差表示,计数资料以频数(百分比)表示。连续变量2 组间比较采用t检验;分类变量组间比较采用卡方检验;对于单因素分析P<0.05的指标采取Logistic 回归分析早产的危险因素;绘制接受者操作特性曲线(receiver operating characteristic curve,ROC),计算ROC 曲线下面积评估指标的诊断准确性;Pearson 相关分析评估牙周指标与GCF 生物标记物水平的相关性;P<0.05 表示差异有统计学意义。
2 结果
2.1 一般情况
本研究初始纳入405例孕妇,排除早产史、精神紧张、妊娠并发症等已知的早产危险因素,最终纳入300 例孕妇。其中足月组281 人,早产组19人,早产占6.3%。2组间分娩周数有显著差异(P<0.01)。在2 组研究人群的人口学特征、口腔卫生习惯及自评牙周炎症状比较中,早产组无业者偏多(P<0.01),其他项目均未见明显差异(P>0.05)(表1)。
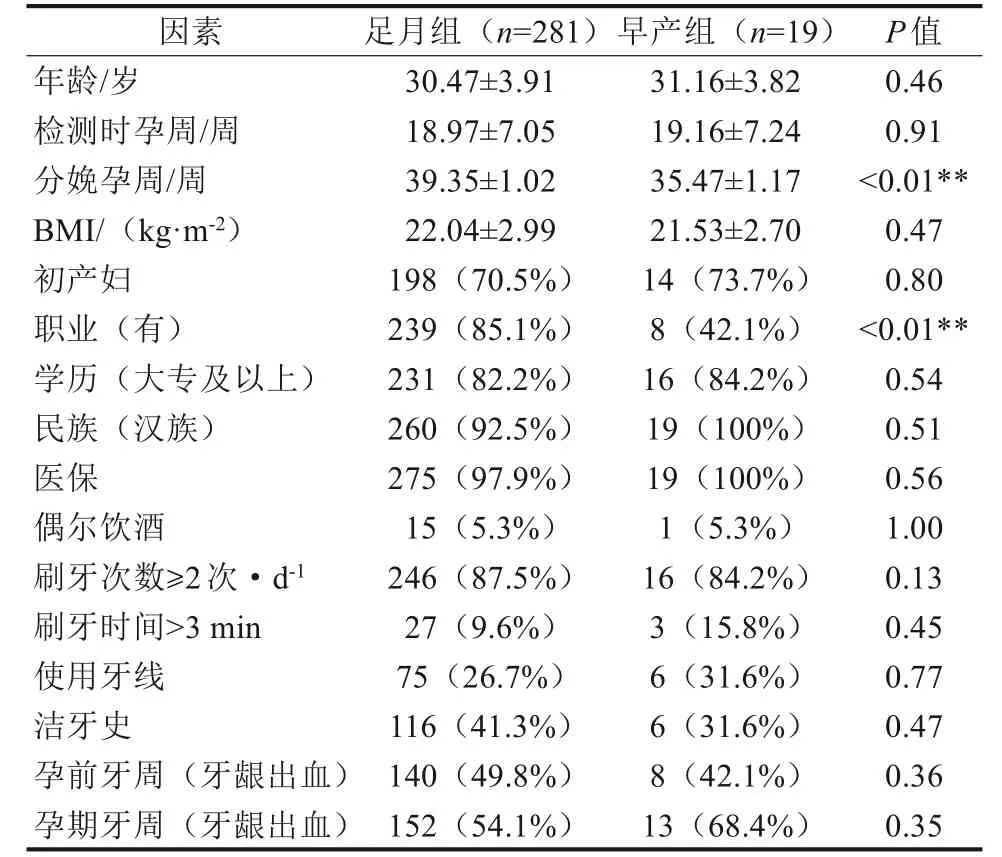
表1 早产组与足月组一般情况的比较Tab 1 Comparison of general conditions of PTB and FTB
2.2 不同孕期妇女牙周指标和GCF 生物标记物水平的比较
孕9~12 周(77 人,早产5 人,足月产72 人)、13~23周(128人,早产6人,足月产122人)、24~28 周(64 人,早产7 人,足月产57 人)、29~36 周(31 人,早产1 人,足月产30 人)。按年龄、BMI、职业状况等基线资料,每组早产人数按1∶4 匹配巢式对照组。仅在孕24~28 周中,早产组的GI、BI 和8-OHdG 显著高于巢式对照组(P<0.05)(表2~4)。
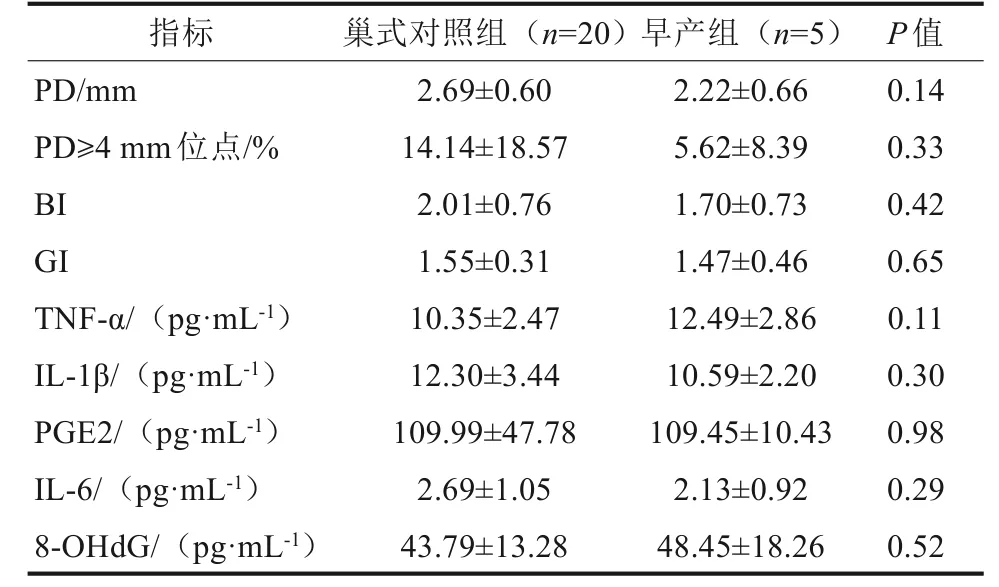
表2 孕9~12 周早产组与足月组牙周指标和GCF 生物标记物水平的比较Tab 2 Comparison of periodontal indexes and biomarkers in GCF of PTB and FTB at 9-12 gestational weeks

表3 孕13~23 周早产组和足月组牙周指标和GCF 生物标记物水平的比较Tab 3 Comparison of periodontal indexes and biomarkers in GCF of PTB and FTB at 13-23 gestational weeks
2.3 早产的危险因素Logistic回归分析
将妊娠24~28 周GI、BI、8-OHdG(单因素分析P<0.05的指标)纳入逐步Logistic回归模型,以妊娠结局为因变量,BI和8-OHdG是早产的危险因素(OR=5.90,P=0.034,95%可信区间:1.139~30.554;OR=1.18,P=0.045,95%可信区间:1.003~1.384)。
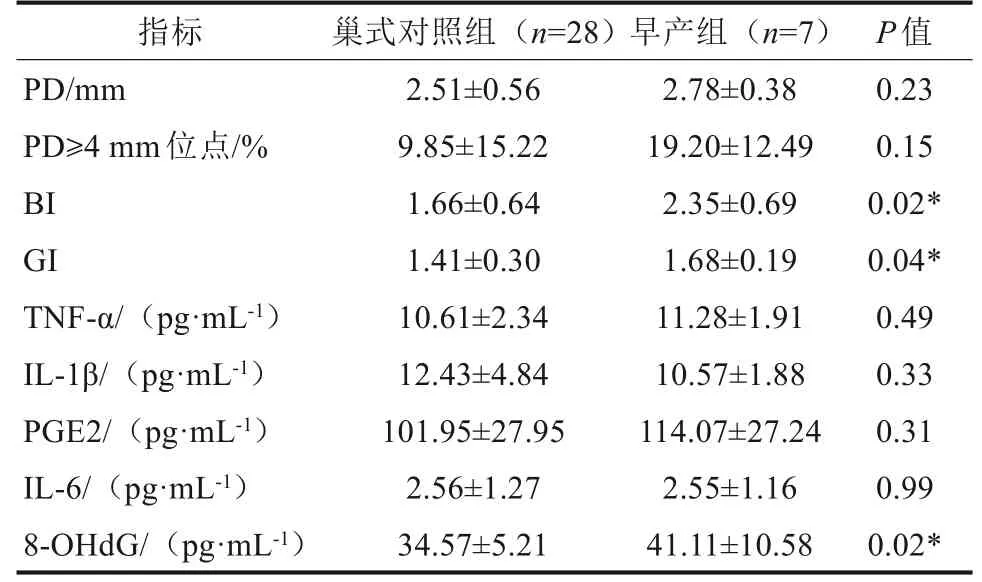
表4 孕24~28 周早产组和足月组牙周指标和GCF 生物标记物水平的比较Tab 4 Comparison of periodontal indexes and biomarkers in GCF of PTB and FTB at 24-28 gestational weeks
2.4 孕9~36 周牙周指标与GCF 生物标记物水平的相关性分析
PD与PD≥4 mm 位点、BI、GI 呈正相关(r>0.6,P<0.05);在牙周指标与GCF 生物标记物水平之间,未见明显相关性(P>0.05)(表5)。

表5 孕9~36 周牙周指标与GCF 生物标记物的相关性分析Tab 5 Correlation analysis of periodontal indexes and biomarkers in GCF on pregnant women at 9-36 gestational weeks
2.5 BI 和8-OHdG 水平联合检测的ROC 曲线分析结果
以妊娠结局为金标准,将妊娠24~28周早产组7 例及巢式对照组28 例BI、8-OHdG 水平的结果,绘制成ROC 曲线。BI 在ROC 曲线下面积为0.80,95%可信区间为0.435~0.948,8-OHdG水平在ROC曲线下面积为0.69,95%可信区间为0.647~0.950。以BI、8-OHdG 水平为自变量,建立Logistic 回归模型,通过模型中的概率值来拟合联合检测的ROC 曲线。联合检测的ROC 曲线下面积为0.82,95%可信区间为0.592~1.000,联合检测的ROC 曲线下面积均大于BI、8-OHdG单项检测,但差异无统计学意义(P>0.05)。联合检测BI 阈值为1.86,8-OHdG 的阈值为33.87 pg·mL-1。根据临界值得出联合预测时的敏感度、特异性、准确度分别为85.7%、64.3%、68.6%(表6、图1)。
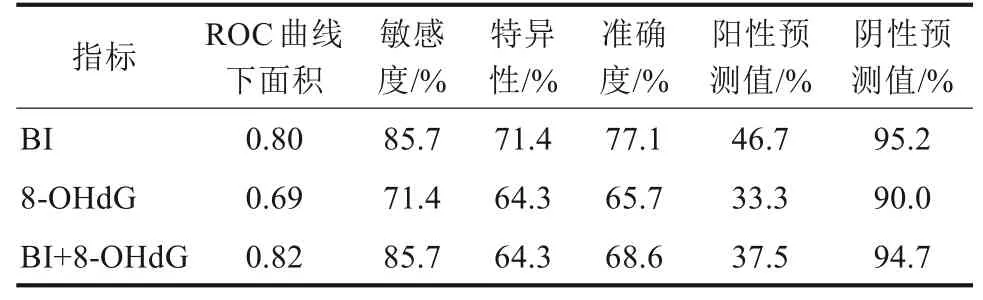
表6 BI 和8-OHdG 水平联合检测的ROC 曲线分析结果Tab 6 ROC curve of combined detection of BI and 8-OHdG levels
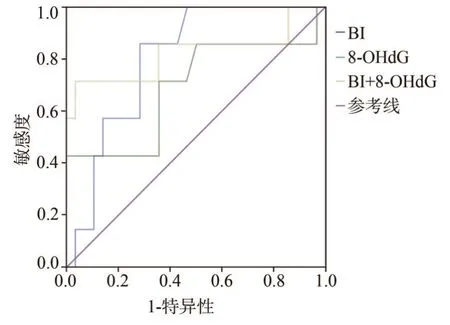
图1 BI和8-OHdG水平单独和联合检测的ROC曲线Fig 1 ROC curve of alone and combined detection of BI and 8-OHdG levels
3 讨论
NCCS是指收集某一队列成员的基线资料和生物学标本后,随访一定时间,把发生疾病的全部人群作为病例组,按一定匹配条件和比例随机抽取该队列中未发病人群组成巢式对照组,按照病例—对照研究方法进行统计分析[7]。
考虑孕期性激素水平可能对牙周临床指标和炎症介质的影响,将纳入的300名孕妇根据孕周进行分组并比较。结果显示,仅在孕24~28周时,早产组的GI、BI和8-OHdG显著高于巢式对照组(P<0.05),同时BI和8-OHdG升高是早产的危险因素。根据NCCS 的特点,牙周炎症和GCF 生物标记物水平升高在早产发生之前,提示与早产的发生相关。通过ROC 曲线,发现BI 和8-OHdG 联合检测的ROC 曲线下面积大于单项检测,尽管差异无显著性,但提示二者联合检测可能对早产的预测有一定价值。联合检测时BI的阈值为1.86,8-OHdG的阈值为33.87 pg·mL-1,其阳性预测值和准确度都比单独检测8-OHdG 水平高,但低于单独检测BI。因此8-OHdG对早产的预测作用,今后将扩大样本量或增加其他指标来探讨。
BI 能比较客观地反映牙龈和牙周袋内壁的炎症情况,有较高的特异性,是牙周炎症处于活动期的敏感标志[8]。Bieri等[9]的纵向研究中也发现在未得到任何牙周治疗的情况下,即使PD、GCF炎症因子水平无显著性改变,探诊出血(bleeding on probing,BOP)在产后4~6周显著下降。
Tarannum等[10]在队列研究中,纳入了22 名妊娠28~32 周患有中度牙周炎的孕妇,发现早产组GCF-PGE2 比足月组略高,但差异无统计学意义,因此并未得出GCF-PGE2 是早产预测因子的结论。与本研究结果不同,可能和纳入对象牙周炎症状况和纳入时间不同有关。
评估妊娠期牙周炎症状况的困难主要是缺乏X线片的依据[9],本研究采用GI、BI 和PD 来判断牙周炎症状况。而没有记录菌斑指数(plaque index,PLI) 和临床附着丧失(clinical attachment loss,CAL)。未记录PLI 的原因为:早在20 世纪60 年代,有学者提出妊娠期牙龈炎的严重程度会增加,但和菌斑聚集量不成比例[11],后来大部分研究也支持这个观点[12];笔者[13]前期研究也发现即使PLI 控制在较低水平时,GI、BI 仍随着孕期发展显著升高。而未记录CAL 的原因是:孕妇检查时未洁治可能影响CAL 的检测[14]。CAL 反映既往牙周破坏程度,不代表当前的牙周炎症程度[15]。研究[16]表明在缺少CAL 时,PD 的增加是牙周炎的早期体征。另外,本研究样本量大,调查对象为孕妇,为了研究的顺利进行,缩短检查时间也是必要的[17]。
本研究没有发现9~12 周、13~23 周就诊孕妇在早产与足月组之间检测指标的明显差异,可能与孕期的激素水平有关。Abuelghar等[18]发现24~28周唾液孕酮水平对早产有一定的预测意义,认为16~20周唾液中孕激素水平并不能代表生产发生前的变化,因为后期在早产发生前激素水平的变化会更大。有研究[19]发现与孕早期(8~12 周)和产后6~8 周相比,孕中期(24~28 周)炎症因子与孕早期持平,可较好维持胎儿的生长,该时期的炎症感染和任何持续的促炎信号将引起流产或早产。提示孕中期(24~28 周)炎症因子处于稳定状态,对炎症反应的增加更敏感。因此,24~28周可能是生物标记物变化的敏感时期。
在整个孕期牙周指标与GCF 生物标记物的相关性分析中,没有发现明显的相关性。Bieri等[9]也发现孕期BOP 与GCF 中IL-1β、TNF-α 等细胞因子没有相关性,妊娠时期的GCF 炎症介质水平,除了受细菌引起的局部炎症和宿主免疫反应影响外[10],妊娠时期的激素水平和免疫抑制也起了作用[20]。此外,还与研究中纳入对象的牙周炎症状况较好有关[9-10],本研究早产组与足月组孕妇PD平均值均小于3 mm。
综上所述,本研究探讨了不同妊娠阶段牙周指标和GCF 中炎症介质水平与早产的关系。妊娠24~28 周BI 和8-OHdG 水平升高是早产的危险因素,二者联合检测可能对早产的预测有一定的价值,但需要进一步扩大样本的研究来探讨,从而建立牙周病患者早产预警体系。
利益冲突声明:作者声明本文无利益冲突。

