遂宁地区表观健康成年人群外周血SII,NLR,PLR和LMR参考区间的建立
魏容,肖光军,刘艳婷,黄欣雨,邓琴,李理,赵思涵
(遂宁市中心医院,四川 遂宁 629000)
全身免疫炎症指数(SII)、中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)是通过机体外周血全血细胞计数结果计算得到的新型炎症指标,因其检测方便、成本低廉,现被大量运用于感染性疾病、肿瘤、心脑血管疾病等多种疾病的诊断及预后评估中[1-4]。目前,有关SII,NLR,PLR,LMR参考区间的研究较少[5],为指导这些指标在遂宁地区的临床应用,建立其适宜的参考区间具有重要意义。
1 资料与方法
1.1 一般资料
选取2018年1月—2018年12月遂宁市中心医院体检科进行健康体检的4 532 例20~79 岁的表观健康汉族成人作为研究对象。所有研究对象均知情同意,并通过问卷调查、体格检查、心电图、胸部X线、B超及相关实验室检查结果来综合评估[5-8]。
1.2 纳入和排除标准
纳入标准[5-8]:汉族,年龄20~79 岁,自觉健康;问卷调查表信息填写完善;无急慢性感染、呼吸系统疾病、血液系统疾病、肿瘤等急、慢性疾病;血压和体质量指数正常;6个月内未进行手术;4个月内未献血、输血或大量失血;2周内未服用药物;女性未处于妊娠或哺乳期;心电图、胸部X线、B超检查均未见异常;肝功、肾功、血脂、空腹血糖、尿酸检测结果正常;乙肝表面抗原(HBsAg)检测阴性。排除标准[5-8]:白细胞计数(WBC)<3.5×109/L或>9.5×109/L;血红蛋白(Hb)男性<130 g/L,女性<115 g/L。
1.3 仪器与试剂
全血细胞计数使用Sysmex XN9000全自动血细胞分析仪配套检测系统(仪器配套试剂、校准品和质控品)检测;EDTA-K2抗凝真空采血管由成都瑞琦提供。检测系统运行良好,定期校准,样本检测前对检测系统常规维护保养,配套质控品均在控。
1.4 方法
1.4.1 样本采集与检测
使用EDTA-K2抗凝真空采血管采集参考个体空腹外周静脉血2 mL,充分混匀后及时送检,确保采样后1 h内完成检测。收集数据,并导入至Excel 2007中。
1.4.2 SII,NLR,PLR,LMR计算
根据全血细胞计数检测结果计算参考个体SII,NLR,PLR,LMR的浓度水平,其公式为:SII=血小板数×中性粒细胞数/淋巴细胞数;NLR=中性粒细胞数/淋巴细胞数;PLR=血小板数/淋巴细胞数;LMR=淋巴细胞数/单核细胞数。
1.5 统计学方法

2 结 果
2.1 外周血SII,NLR,PLR和LMR的浓度水平及其分布
Dixon检验显示,检测结果均无离群值,参考人群的性别及年龄分布见表1。Kolmogorov-Smirnov正态性检验显示,外周血SII,NLR,PLR和LMR的浓度水平均呈偏态分布(P<0.05),但经对数转换后,则均呈正态分布(P>0.05),结果见表2。
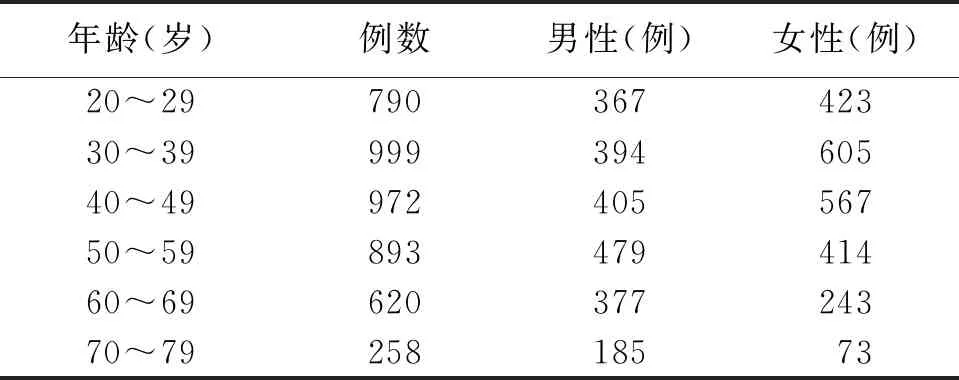
表1 参考人群性别和年龄分布
2.2 不同性别间浓度水平的比较
按性别分组后,各组Lg(SII),Lg(NLR),Lg(PLR),Lg(LMR)的浓度水平均呈正态分布(P>0.05),男女间比较,各项目浓度水平的差异均具有统计学意义(P<0.05),但Z检验结果显示,各项目的Z值均小于Z※值,提示各项目在性别间的差异可能无临床实际意义(见表3)。分别将男性和女性按年龄段分组,各组Lg(SII),Lg(NLR),Lg(PLR)和Lg(LMR)的浓度水平均呈正态分布(P>0.05)(见表4)。同一年龄段男女间比较,各项目仅有部分年龄段浓度水平的差异无统计学意义(P>0.05),但Z检验结果显示,Lg(SII)和Lg(NLR)在各年龄段的Z值均小于Z※值,各年龄段男女间浓度水平的差异无临床实际意义;而Lg(PLR)和Lg(LMR)则部分年龄段的Z值大于Z※值,说明部分年龄段男女间浓度水平的差异有临床实际意义。故参考区间建立时,Lg(SII)和Lg(NLR)可不考虑性别因素的影响,而Lg(PLR)和Lg(LMR)则需考虑性别因素的影响。
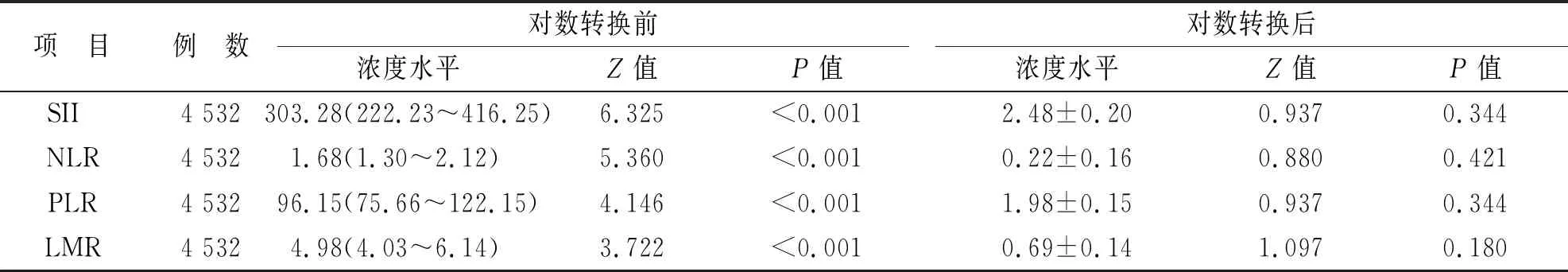
表2 参考人群外周血SII,NLR,PLR和LMR的浓度水平及其分布特点
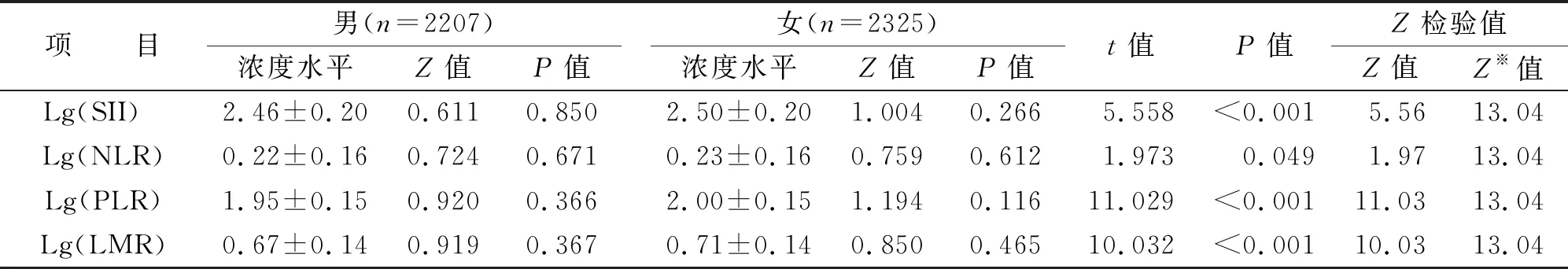
表3 男女间外周血Lg(SII),Lg(NLR),Lg(PLR)和Lg(LMR)浓度水平比较
2.3 不同年龄段间浓度水平的比较
将参考人群Lg(SII),Lg(NLR)的数据按年龄段分组,而Lg(PLR),Lg(LMR)的数据同时按性别和年龄段分组后,各年龄段间或同一性别各年龄段间比较,其较大的标准差均小于较小标准差的1.5 倍。经单因素方差分析,6个年龄段间Lg(SII)和Lg(NLR)浓度水平的总体差异均具有统计学意义(F值分别为11.510,4.560,P值均<0.001);Lg(PLR)和Lg(LMR)在男性6个年龄段间浓度水平的总体差异均具有统计学意义(F值分别为3.018,29.613,P值分别为0.01,<0.001),而在女性6个年龄段间浓度水平的总体差异也具有统计学意义(F值分别为8.200,6.879,P值均<0.001)。采用Bonferroni校正法进行两两比较显示,Lg(SII)和Lg(NLR)在部分年龄段间浓度水平的差异具有统计学意义(P<0.005),而男性和女性部分年龄段间Lg(PLR),Lg(LMR)浓度水平的差异均具有统计学意义(P<0.003)。但经Z检验进一步分析,结果显示,Lg(SII),Lg(NLR)及Lg(PLR)在各年龄段间的Z值均小于Z※值;Lg(LMR)在男性部分年龄段间的Z值大于Z※值,而Lg(LMR)在女性6个年龄段间的Z值均小于Z※值。故各年龄段间Lg(SII),Lg(NLR)的浓度差异无临床实际意义,女性Lg(LMR)浓度水平的差异在6个年龄段间无临床实际意义,其参考区间均可不考虑年龄因素的影响;而男性Lg(LMR)浓度水平的差异在部分年龄段间有临床实际意义,建立其参考区间时需考虑年龄因素的影响,结合最小显著差法(LSD)两两比较的结果,可将男性分为20~49 岁和50~79 岁两个年龄段来建立LMR的参考区间。

表4 同一年龄段男女间外周血Lg(SII),Lg(NLR),Lg(PLR)和Lg(LMR)浓度水平比较
2.4 外周血SII,NLR,PLR和LMR的参考区间
用非参数法建立参考区间,结果见表5。
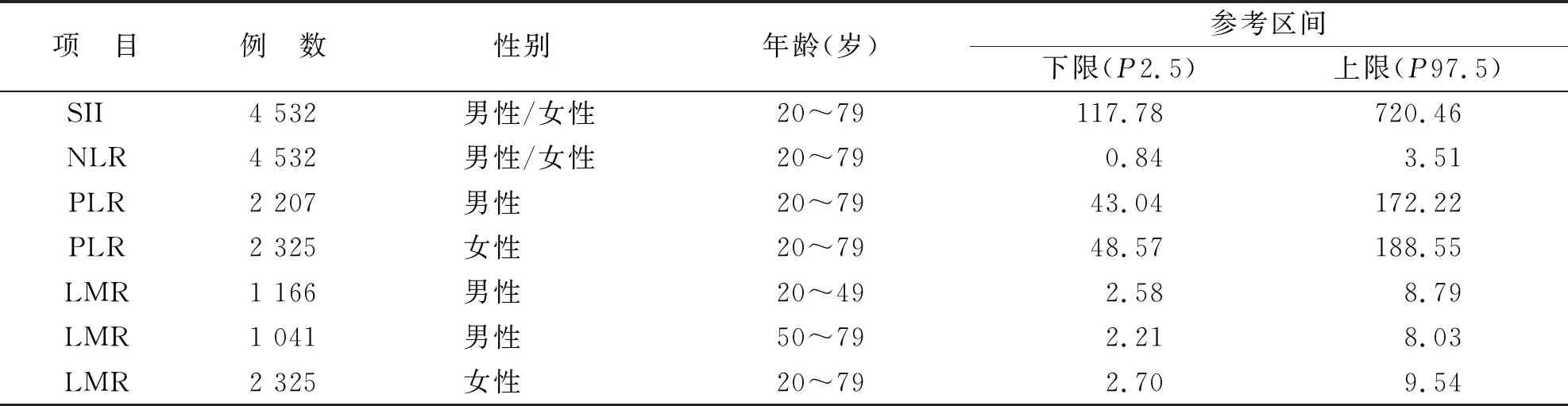
表5 遂宁地区表观健康成年人群外周血SII,NLR,PLR和LMR的参考区间
3 讨 论
临床实验室发布的检验报告均应对每一个检验项目提供参考区间,以帮助临床对患者进行健康评估、疾病诊断、疗效监测及预后评估,故检验项目参考区间的适用性在临床诊疗工作中显得尤其重要,否则可能会导致误诊或漏诊,甚至错误的治疗[5-10]。但因我国对健康人群参考区间的研究工作起步较晚,导致目前临床检验项目的参考区间主要引用欧美健康人群资料建立的参考区间或试剂厂家提供的参考区间。而相关研究显示[5-10],参考区间受实验室检测系统、参考个体的样本特征(种族、性别、年龄、生长发育、职业、生活习惯、饮食结构等)及参考个体所处的地域、环境等诸多因素的影响,从而导致同一检验项目的参考区间在不同地区、不同人群间存在一定的差异[5-10]。我国地域辽阔,民族及人口众多,各地区居民的居住环境、生活习惯、饮食结构等差异较大,因此,各临床实验室在引用参考区间时须评估其适宜性,必要时,应根据其使用的检测系统建立所服务人群的参考区间[5-10]。SII,NLR,PLR,LMR为近年来提出的新型炎症指标,其浓度水平通过外周血中血小板、中性粒细胞、淋巴细胞和单核细胞的浓度水平计算所得[5],故本研究对遂宁地区4 532 例20~79 岁表观健康汉族成人外周血SII,NLR,PLR,LMR的浓度水平进行了统计分析,初步建立了该地区该人群外周血SII,NLR,PLR及LMR的参考区间。
本研究结果显示,遂宁地区表观健康汉族成人外周血SII,NLR,PLR,LMR的浓度水平均呈偏态分布(P<0.05),经对数转换后均呈正态分布(P>0.05)。按性别和年龄段分组后,各组数据对数转换后均呈正态分布(P>0.05)。同一年龄段男女间外周血SII,NLR,PLR,LMR浓度水平比较,仅部分年龄段男女间浓度水平的差异无统计学意义(P>0.05);同一性别不同年龄段间比较,男性和女性各年龄段间外周血SII,NLR,PLR,LMR浓度水平的差异均具有统计学意义(P<0.05),说明遂宁地区表观健康汉族成人外周血SII,NLR,PLR,LMR的浓度水平与性别、年龄有关,与余建洪和刘钰[5]的研究结果存在一定差异。建立参考区间时,为避免过多分组给临床的诊疗工作带来不必要的干扰,Ichihara[10]建议将各组数据正态化后,采用Nested ANOVA方法进行分组分析,其标准差比值(SD)≤0.3时则提示不需要按该因素进行分组,而本研究则采用CLSI C28-A3c推荐的Harris and Boyd方法比较其Z值和Z※值,判断是否需要按性别及年龄段对参考区间进行分组[9]。研究结果显示,SII和NLR不需要按性别和年龄段来分组建立参考区间,PLR和LMR则需要按性别分组建立参考区间,且男性LMR的参考区间需要同时按年龄段来分组建立参考区间,其分组方法和所建立的参考区间与余建洪和刘钰[5]的研究结果存在一定差异,可能与检测系统、参考人群居住环境与气候、参考个体纳入标准与排除标准存在一定差异等因素有关[5-10],这也进一步体现了参考区间适宜性验证的重要性。
综上所述,本研究初步建立了遂宁地区表观健康成年人群外周血SII,NLR,PLR,LMR的参考区间,有助于这些新的炎症指标在该地区的推广及应用。同时,外周血SII,NLR,PLR,LMR的参考区间可能受检测系统、参考人群的性别及年龄等多因素的影响,各临床实验室宜对拟引用的参考区间进行充分的评估、验证,必要时可根据其检测系统及其所服务人群自建参考区间。

