人间充质干细胞抑制同种异体人外周血Th17淋巴细胞增殖活性的质量标准体系的建立
吴婷婷,韩晓燕,李欣,纳涛,袁宝珠
中国食品药品检定研究院细胞资源保藏及研究中心,北京 100050
人间充质干细胞(human mesenchymal stem cells,hMSCs)是一类具有有限自我更新和多向分化潜能,广泛存在于胎儿和成人各组织中的成体干细胞[1]。由于hMSCs来源广泛且具有独特的免疫调控功能和组织再生功能[2-3],已成为干细胞治疗中研究最为广泛的干细胞类型。但有关hMSCs的治疗研究仍存在巨大挑战[4],主要是缺乏hMSCs生物学有效性这一质量属性的标准研究[5-6],以致目前仍缺乏对临床研究用hMSCs进行有效评价的质量标准,更无法对临床研究结果进行客观预测。hMSCs生物学有效性质量属性中的重要组成部分为hMSCs的免疫调控功能[7-8],其中研究最为广泛和深入的是hMSCs对CD4+T淋巴细胞各亚群的功能及亚群之间平衡的调控功能[9],如hMSCs可抑制促炎性的Th1/Th17淋巴细胞亚群分化以及增殖[10],同时促进调节性T细胞(Tregs)的分化[11]。Th17细胞是一类以分泌IL-17A为主的与自身免疫性疾病[12]和/或慢性炎症疾病[13]发生发展密切相关的促炎性CD4+T淋巴细胞亚群[14],hMSCs对Th17的抑制能力是其体内治疗相关疾病的重要机制[15-18],也是hMSCs免疫调控功能中的关键质量属性。
我们利用前期建立的hMSCs标准细胞CCRCMSC-S1(以下简称为 CCRC1)[19]作为评价用标准细胞(即参比细胞),建立了以细胞共培养方法为基础的hMSCs抑制Th17细胞增殖的标准评价体系。在此基础上,对50个不同个体和组织来源的hMSCs逐一进行相关质量属性评价,并用参比细胞的参比值对每一独立评价的hMSCs数据进行校正,进而获得hMSCs抑制Th17细胞增殖质量属性的初级标准值(即51.98%)。本研究在前期研究的基础上,对hMSCs特定质量属性标准进行进一步探索。该研究填补了目前国内外相关空白,对不同组织来源、不同生产工艺、不同传代阶段的hMSCs质量属性的客观评价具有重要指导意义。
1 材料与方法
1.1 细胞 CCRC1(hMSCs生物学有效性质量评价用标准细胞株[10])为本中心前期构建;其他hMSCs共50株,分别为脐带来源30株(UC-1~UC-30)、胎盘来源4株(PL-1~PL-4)、羊膜来源3株(AM-1~AM-3)、骨髓来源 3株(BM-1 ~ BM-3)、脂肪组织来源 5株(AT-1~ AT-5)、齿龈来源1株(G-1)、牙髓来源4株(DP-1~DP-5),均经本中心综合的hMSCs生物学属性鉴别和微生物学安全性检测,所有hMSCs均使用含10%胎牛血清的α-MEM进行常规培养;PBMCs由人浓缩白细胞(由北京红十字血液中心提供),经Ficoll密度梯度离心分离制备。
1.2 主要试剂及仪器 人淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司(LTS1077);α-MEM培养基购自美国Gibco公司;佛波酯(phorbol esters,PMA)和离子霉素(ionomycin)购自美国Sigma-Aldrich®公司;布雷杆菌素(Brefeldin A,BFA)购自美国Cell Signaling Technologies公司;固定和破膜液Fix & Perm购自美国Invitrogen公司;流式细胞染色抗体CD8-FITC(BD555366)、IL-17A-PE(BD560486)、PE iostype control(BD559320)、CD3-PerCP-Cy5.5(BD560835)和BD FACSCalibur流式细胞仪均购自美国BD公司。
1.3 PBMCs的制备 取抗凝外周血或白细胞成分血15 mL,加入15 mL室温PBS稀释;取20 mL室温淋巴细胞分离液加入50 mL离心管中,将稀释后的血细胞缓慢加至淋巴细胞分离液上,并保持两者界面清晰,室温下800×g离心20 min,离心时将加速和减速均调至0档;用移液管小心吸弃上层血浆,再用移液管轻轻吸出单个核细胞层,移入干净的50 mL离心管中,加入30 mL PBS充分混匀,800×g离心10 min,离心时将减速档调至最大值;弃上清,轻弹细胞沉淀使其散开,加入30 mL PBS充分混匀,200×g离心10 min;弃上清,轻弹细胞沉淀使其散开,加入30 mL PBS并充分混匀,150×g离心10 min;弃上清,轻弹细胞沉淀使其散开,用5 mL含10%FBS的RPMI1640重悬单个核细胞,用台盼兰染色法计数活细胞数,并计算细胞存活率。调整细胞浓度为5×106个/mL。
1.4 hMSCs的培养和制备 从液氮中复苏待测hMSCs和CCRC1,用含10%FBS的α-MEM培养基(完全培养基)培养1代,待细胞融合达80%时经0.25%胰酶消化,200×g离心5 min,吹散细胞沉淀,制成密度为1×106个/mL的细胞悬液。
1.5 不同培养体系培养hMSCs不同组成成分的体外培养条件(如培养基)对hMSCs的免疫调控能力影响很大。目前常用的hMSCs培养基主要分为三类:含胎牛血清(FBS)的培养基,不含动物血清但使用人血小板裂解物的血清替代培养基以及化学成分确定的无血清培养基。将两株脐带间充质干细胞hUC-MSCs-1和hUC-MSCs-2分别用M1(含10%FBS的α-MEM培养基)、M2(含5%人血小板裂解物不含血清的培养基)和M3培养基(化学成分限定培养基)于37℃,5% CO2条件下培养2代后,检测其抑制Th17能力的差异。其中hUC-MSCs-1原始培养基为M1,hUC-MSCs-2原始培养基为M2。待细胞融合达80%时,按1∶4传代。
1.6 PBMCs中Th17细胞的检测 采用流式细胞术,按照文献[20]方法。在12孔培养板中每孔加入1 mL含1×106个PBMCs的悬液,再加入淋巴细胞激活剂PIB(PMA 50 ng/mL+ionomycin 1μg/mL+BFA 10μg/mL)刺激活化PBMCs6~8h;吸出悬浮的PBMCs,置入1.5 mL新鲜离心管中,350×g室温离心5 min,弃上清,各管加入100 μL PBS悬浮细胞,并加入antihu-CD8-FITC和 anti-hu-CD3-PerCP-Cy5.5抗体染色,4℃避光孵育 20 min;加入50 μL Fix & Perm 中的 Reagent A,室温避光孵育20 min;加入1 mL PBS悬浮细胞,500×g室温离心5 min,弃上清,加入50 μL Fix & Perm的Reagent B悬浮细胞,加入10 μL PE isotype control(Ms IgG1,κ)或anti-hu-IL-17A-PE,室温下避光孵育30 min,期间轻轻振荡1次;每管中加入1 mL PBS(含 5%FBS),500×g离心 5 min,弃上清,用0.3 mL PBS重悬细胞,上流式细胞仪检测,用FCS Express V3软件进行分析。分析时用R1(CD3+SSC)区域选定CD3+T细胞。设门于R1,CD8-IL-17A+的细胞为Th17,并计算Th17在CD3+T细胞中的比例。
1.7 hMSCs对Th17增殖抑制能力的标准化检测 将CCRC1作为标准对照细胞,对不同个体、不同组织来源的待测hMSCs进行Th17增殖抑制能力的标准化检测。将CCRC1或其他hMSCs按2×105个/孔接种于12孔板中,补充含10%FBS的RPMI1640至1 mL/孔,各组设3个平行孔,培养24 h后,每孔加入1×106个PBMCs(PBMCs与hMSCs的比例为5︰1),过夜孵育18 h;加入PIB作用6 h,进行Th17的流式检测。试验分为4组:不含PIB的PBMCs对照组A、加入PIB的PBMCs对照组B以及与CCRC1共培养组、与待测hMSCs共培养组。按下式计算CCRC1和hMSCs对Th17的增殖抑制率。为排除各种检测因素(特别是PMSCs质量不均一的因素)所致的不同试验间的差异,确保不同来源hMSCs所获得数据的客观性和可比性,利用每次检测中CCRC1组的Th17增殖抑制率以及CCRC1对Th17增殖抑制率的初级标准值(52.83%),对同次试验中待测hMSCs组的Th17增殖抑制率进行校正(或标准化处理),得出每一待测hMSCs对Th17的相对增殖抑制率。
增殖抑制率(%)=[1-(待测细胞组Th17%-对照组A Th17%)/(对照组B Th17%-对照组A Th17%)]×100%;
相对增殖抑制率(%)=待测hMSCs对Th17的增殖抑制率/CCRC1对Th17增殖抑制率×52.83%
2 结果
2.1 hMSCs调控Th17淋巴细胞检测方法的建立 30个不同个体来源新鲜或冻存1个月以内的PBMCs中Th17的检测结果显示,PBMCs中Th17所占比例在PIB激活前为(0.04±0.01)%,而经PIB激活后为(0.86±0.17)%,见图1。对4个不同个体来源的PBMCs经冻存不同时间后复苏进行Th17检测,结果显示,冻存1年的PBMCs中Th17所占比例可降低约50%,见表1,因此后续只使用新鲜制备或冻存半年以内的PBMCs进行相关试验。
表1 冻存时间对PBMCs中Th17百分数的影响(%,±s,n=4)Tab.1 Effect of freezing time on percentage of Th17 in PBMCs(%,±s,n=4)
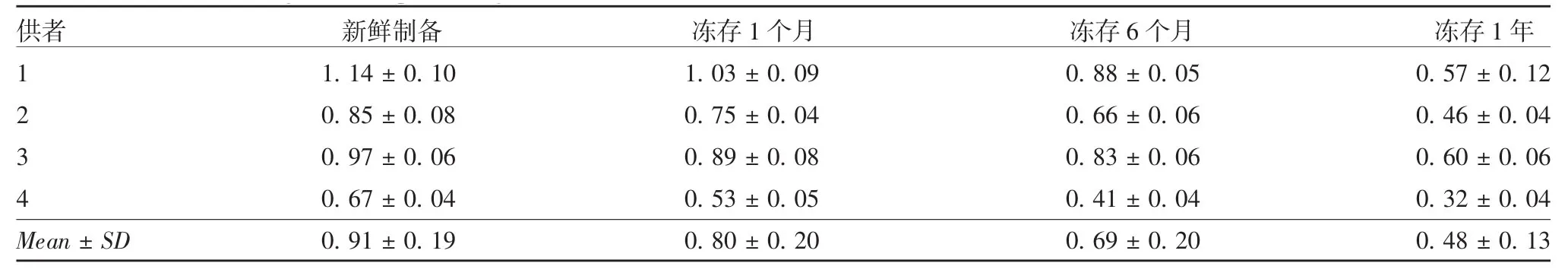
表1 冻存时间对PBMCs中Th17百分数的影响(%,±s,n=4)Tab.1 Effect of freezing time on percentage of Th17 in PBMCs(%,±s,n=4)
供者 新鲜制备 冻存1个月 冻存6个月 冻存1年1 1.14±0.10 1.03±0.09 0.88±0.05 0.57±0.12 2 0.85±0.08 0.75±0.04 0.66±0.06 0.46±0.04 3 0.97±0.06 0.89±0.08 0.83±0.06 0.60±0.06 4 0.67±0.04 0.53±0.05 0.41±0.04 0.32±0.04 Mean±SD 0.91±0.19 0.80±0.20 0.69±0.20 0.48±0.13

图1 PBMCs中Th17检测方法的建立(±s,n=4)Fig.1 Establishment of detection method for Th17 in PBMCs(±s,n=4)
2.2 hMSCs抑制人PBMCs中Th17标准评价方法的确立 将CCRC1与PBMCs按不同比例(1∶20~1∶2.5)混合共培养后检测PBMCs中Th17百分数变化的结果显示,CCRC1抑制经PIB激活的PBMCs中Th17存在剂量依赖效应,当CCRC1与PBMCs的比例为1∶20时,CCRC1即可表现出对Th17的抑制效应,而比例为1∶5时,抑制效应基本达到平台期,CCRC1 与 PBMCs的比例为 1∶20、1∶10、1∶5、1∶2.5时CCRC1对Th17的增殖抑制率分别为(31.68±5.5)%、(38.68 ± 2.5)%、(46.86 ± 3.1)%和(48.50 ±1.8%)。见图2。后续共培养试验中,均使用1∶5作为hMSCs和PBMCs共培养细胞比例。

图2 hMSCs抑制人PBMCs中Th17标准评价方法的确立Fig.2 Establishment of a standard assay for evaluation of suppressive potency of hMSCs to Th17 in PBMCs
2.3 CCRC1对Th17增殖抑制率的初级标准值确定 将CCRC1与符合上述选择标准的独立供者来源的不同PBMCs分别进行Th17增殖抑制试验,对Th17增殖抑制数据的有效性进行分析发现,当供者PBMCs经PIB处理后Th17含量过低[比例小于(0.3±0.1)%]时,CCRC1失去对Th17的增殖抑制作用(P=0.57,n=5),见图 3A,因此将 PBMC 加入PIB后Th17的比例低于0.3%的处理视为无效处理,相应的共培养试验视为无效试验。排除无效试验后,从50次有效试验中统计出CCRC1对Th17增殖抑制率分布区间为(52.83±6.17)%,见图3B(n=50),随后以52.83%作为CCRC1对Th17增殖抑制率的初级标准值,并将其应用于对后续其他来源hMSCs抑制Th17增殖试验数据的矫正和质量标准研究中。

图3 CCRC1对Th17增殖抑制率的初级标准值计算Fig.3 Calculation of primary standard value for inhibitory rate of proliferation of Th17 in PBMCs by CCRC1
2.4 利用CCRC1和标准评价方法对其他hMSCs的Th17增殖抑制能力进行的标准化检测 检测结果显示,不同组织来源的hMSCs对Th17均有不同程度的抑制作用,见图4和图5。30株脐带来源hMSCs对Th17的增殖抑制率以及相对增殖抑制率见表2。20株其他组织来源hMSCs对Th17的增殖抑制率以及校正后的相对增殖抑制率见表3。30株脐带来源hMSCs对Th17的相对增殖抑制率均值为(49.59±13.13)%。30株脐带以及20株其他组织来源的共50株hMSCs对Th17的相对增殖抑制率均值为(51.98±12.99)%。由此得出hMSCs对Th17相对增殖抑制率的初级标准值为51.98%。

图4 不同组织来源hMSCs与PBMSCs共培养后对Th17百分数的影响Fig.4 Effect of co-culture of hMSCs and PBMSCs from various tissue origins on percentage of Th17

图5 不同组织来源hMSCs对Th17增殖抑制率的统计分析Fig.5 Statistical analysis of inhibitory rates of Th17 proliferation by hMSCs for various tissue origins

表2 30株脐带来源hMSCs对Th17增殖抑制率(%)以及校正后的Th17相对增殖抑制率(%)Tab.2 Inhibitory rate(%)and relative inhibitory rate(%)of Th17 proliferation by hMSCs from umbilical cord

表3 20株非脐带组织来源hMSCs对Th17的增殖抑制率(%)以及校正后的Th17相对增殖抑制率(%)Tab.3 Inhibitory rate(%)and relative inhibitory rate(%)of Th17 proliferation by non-umbilical cord-derived hMSCs
2.5 标准评价方法及初级质量标准值的应用
2.5.1 同一个体来源不同代次hMSCs对Th17增殖抑制能力的评价 应用标准评价方法评估同一个体来源不同代次hMSCs对Th17增殖抑制能力的差异,结果显示,3株脐带组织来源的hMSCs(UC-1、UC-2和 UC-3)在第 5和第 10代次(P5和 P10)对Th17的增殖抑制能力存在差异,UC-1的P5和P10与UC-3的P5和P10之间差异无统计学意义(P分别为0.09和0.30);而UC-2的P10能力低于P5(P=0.012)。两株胎盘 hMSCs(PL-1 和 PL-2)的 P5 和P10之间差异无统计学意义(P分别为0.19和0.51)。羊膜 hMSCs(AM-1)的 P10 能力高于 P5(P=0.022)。骨髓 hMSCs(BM-1)的 P10 能力低于 P5(P=0.015)。脂肪 hMSC(AD-1)的 P10 能力低于 P5(P=0.011)。见图6。

图6 不同组织、不同个体、不同代次的hMSCs对Th17增殖抑制效应的影响Fig.6 Inhibitory rates of hMSCs of various passages from various tissues and individuals on Th17 proliferation
2.5.2 不同培养条件对hUC-MSCs抑制Th17增殖能力影响的评估 两株不同的hUC-MSCs在3种不同培养体系(M1、M2、M3培养基)下培养后检测其抑制Th17能力的差异,结果显示,hUC-MSCs-1在M3中培养后其抑制Th17的功能显著降低,与其原始培养基M1相比,差异有统计学意义(P=0.000 6);而在M2中培养后无显著变化,与其原始培养基M1相比,差异无统计学意义(P=0.187)。hUC-MSCs-2经M1和M3培养后,抑制Th17的功能与其在原始培养基M2培养相比,均显著降低(P分别为0.004 8和0.001 7)。见图7。表明不同培养体系对hMSCs抑制Th17增殖的功能影响很大,其中某化学成分确定的无血清培养条件对相关功能的影响最为显著。同时也说明,细胞培养过程中培养基的改变对hMSCs调控Th17功能的影响很大。
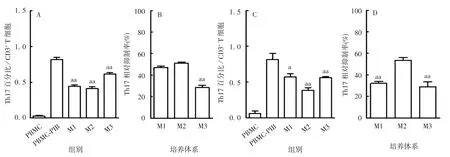
图7 不同培养条件对hMSCs抑制Th17的影响Fig.7 Effect of culture conditions on inhibitory rate of Th17 proliferation by hMSCs
3 讨论
本研究在以往成功建立1株hMSCs生物学有效性质量评价用标准细胞CCRC1细胞株的基础上,进一步建立了hMSCs调控Th17功能的标准化评价技术和相关功能的初级质量标准。由于hMSCs调控Th17的功能是其免疫调控功能参与治疗各种不同临床适应症所需的重要细胞生物学基础,因此也是hMSCs生物学有效性中的关键质量属性。本研究为有效评价hMSCs的这一关键质量属性提供了量化的、确证性的方法学基础和初级质量标准,为创造性地构建hMSCs标准化生物学有效性质量评价体系进一步充实了重要内容。
hMSCs通过细胞间直接相互作用和分泌不同免疫调控活性因子的方式综合调控Th17增殖和/或活性[21]。如 hMSCs可通过细胞表面表达Notch、PDL-1、FasL等,与不同分化阶段的Th17细胞相互作用从而抑制其功能[22-24],也可通过分泌细胞外泡(如外泌体、线粒体等)[25-26]以及表达 IDO1、HO-1、PGE2、HGF等因子抑制Th17分化、增殖和功能[27-29]。而越来越多的证据显示,hMSCs是通过调节Th17和Tregs之间的平衡来有效改善体内炎性环境[9,15]。上述研究均说明,对Th17细胞增殖和活性的抑制是hMSCs在免疫调控功能生物学有效性的关键质量属性。而本研究建立的标准化评价技术是在一定程度上对上述这些功能进行综合评价。因此,相关标准评价技术在生物学机制的关联性方面既具有确证性,又具有代表性。
建立hMSCs生物学有效性质量评价体系的核心是建立各生物学有效性关键质量属性评价用标准细胞株[12],该细胞株除需满足所有hMSCs的基本生物学特性外,还需具有hMSCs各生物学有效性质量属性的代表性和稳定性。通过前期研究我们确立了CCRC1作为该标准细胞株。而本研究进一步证明了该标准细胞株在建立新的生物学有效性关键质量属性的标准化评价技术和相关质量标准研究方面具有重要意义。
为使CCRC1发挥其参比细胞的作用,本研究首先获得了CCRC1自身调控Th17功能的初级标准值,再应用CCRC1及其初级标准值共同参与每一独立hMSCs相关功能的检测,且每一检测结果均需用CCRC1的初级标准值进行校正,以排除检测中可能存在的系统误差。这种以标准参比细胞和相关标准值为基础的评价技术是hMSCs生物学质量属性标准评价技术的基本内涵。
与该标准评价技术相关的最为关键和最难控制的误差是检测试验中所使用的PBMCs的质量因素。本研究中并未采用纯化的Th17诱导分化体系进行hMSCs调控Th17的检测,而是采用了更加简单快速、以PBMCs直接与MSCs共培养的基本方法,这种检测方法与FDA所发表的检测方法相一致[30-31]。但PBMCs质量的均一性是最为关键的影响因素,且其质量均一性是多方面的。首先,试验中所使用的PBMCs的来源为同种异体的不同健康供者,尽管是健康供者来源,但不同供者个体间可能存在多方面的细胞生物特性的差异,相关差异在本研究中可表现为对PIB激活剂反应性的差异和各自Th17含量的差异。因此,我们首先利用CCRC1对PMBCs的相关质量进行研究,排除了因对激活剂反应差和Th17绝对数量过低导致经PIB激活后Th17比例低于一定数量(如0.3%)的PBMCs的实验结果,同时获得了CCRC1调控Th17的初级标准值。其次,PBMCs的(液氮)冻存时间(以半年为关键时间点)相关的质量因素也是影响检测结果的重要因素,而本研究也排除了冻存时间超过半年的PBMCs的使用。
在标准细胞CCRC1、CCRC1调控Th17的初级标准值和对PBMCs进行质量控制的基础上,我们随即开展了hMSCs调控Th17功能的初级质量标准值的研究,选择了50个符合hMSCs综合性质量要求的不同个体、不同组织来源的hMSCs作为研究对象,并逐一对每个hMSCs进行相关检测。而每一独立检测中,均设置CCRC1作为参比细胞,并用CCRC1的初级标准值对每一独立检测结果进行校正,最终计算出50株hMSCs调控Th17功能的平均值(即51.98%)。理论上,该经过标准化评价技术在符合综合质量属性的hMSCs中所获得的平均值,就具有hMSCs调控Th17质量属性的初级标准值的性质。
需要强调的是,本研究是在建立标准化评价技术的基础上,对hMSCs调控Th17的质量属性标准的探索性工作,所获得的标准值只具有“初级标准”的意义。将其界定为“初级标准”而非“最终标准”的主要考虑是,研究中只使用了有限的样本数量,包括获得CCRC1初级标准值时所使用的PBMCs的数量(50例)和获得正常hMSCs初级标准值的hMSCs数量(50例)。其次,50例正常hMSCs各组织来源的数量差异也较大,以脐带组织来源所占比例最高。后续在hMSCs调控Th17的质量属性标准进一步精准化研究中,可加大相关研究所需的PBMCs数量和正常hMSCs的数量,并尽可能保障不同hMSCs来源组织数量的均衡性,同时还需优化对实验结果的数学分析和探索更加合理的标准值表达方式,以保证新的质量标准值更具有合理性,并不断接近“最终标准”。
本研究所创立的方法学在hMSCs质量研究领域中未见报道。研究成果中的标准化评价技术和初级标准值,已可直接应用于满足现阶段国家干细胞“临床研究备案”和“临床试验注册”相关的hMSCs质量控制的需要[32-33]。例如,利用本研究所建立的质量标准评价技术对不同研发者的hMSCs进行评价时,发现不同研发者间hMSCs调控Th17的能力差异巨大,差异范围可在20%~80%之间。这些质量评价的实践性成果进一步说明了新建立的标准化评价技术在hMSCs质量管理中的应用价值。
除直接应用于hMSCs产品的质量评价外,本研究所建立的标准化质量评价技术也可用于指导hMSCs制备工艺的研发和工艺质量控制。例如,本研究应用所建立的标准化评价技术,探索了与hMSCs制备工艺相关的体外细胞传代次数和培养体系对hMSCs调控Th17功能的影响,并发现在有限传代次数内,代次的高低与相关功能不存在特定关系。而培养体系的不同对相关功能影响巨大,其中含血小板裂解物的培养体系较有利于提高hMSCs调控Th17的功能,而成分确定的无血清培养体系则会大大降低该功能。该有关培养体系的研究结果与目前人们在hMSCs产品研发领域中的认知基本相符。因此,建议未来在hMSCs产品研发和质量管理方面,规定合理细胞代次或选择合理培养体系时,特别是对于成分明确的无血清培养体系进行选择或开发时,应严格基于产品特定质量控制的研究成果,而不应进行机械性地规定。
本研究只涉及hMSCs调控Th17功能的标准评价技术建立及相关质量标准的研究,未来还需分别建立hMSCs免疫调控其他质量属性的标准化评价技术和相关质量标准,如hMSCs调控Th1、Treg和巨噬细胞等的功能。由于hMSCs调控所有免疫细胞的基本细胞分子机制均是通过细胞间直接相互作用和分泌免疫调控活性因子,因此本研究所建立的方法学对这些关键质量属性的标准化研究均具有重要的指导意义。未来所要研发和建立的针对所有这些关键质量属性的标准化评价方法和质量标准,将共同构成hMSCs免疫调控相关生物学有效性综合质量评价体系,并用于综合评价hMSCs质量、指导hMSCs的产品研发及临床应用。

