多糖活化剂1-氰基,4-2甲氨基吡啶四氟硼酸盐降解产物的结构分析
董威 ,袁军,李红 ,陈煜 ,刘昊智 ,2,李津 ,庄再成 ,吴克
1.武汉博沃生物科技有限公司,湖北 武汉 430075;2.华东理工大学生物工程学院,上海 200237
异脲键连接反应是多糖-蛋白结合疫苗生产中过程中连接多糖与载体蛋白的常用方式之一[1]。1-氰基,4-二甲氨基吡啶四氟硼酸盐(1-cyano-4-dimethylamino-pyridinium,CDAP)是一种可用于异脲键连接反应中多糖活化的试剂,多应用于脑膜炎球菌结合疫苗、流行性嗜血杆菌结合疫苗、肺炎球菌结合疫苗及A族乙型溶血性链球菌疫苗等多糖-蛋白结合疫苗的工艺[2-5]。与广泛使用的溴化氰活化剂(多糖活化率为1%~2%)比较,使用CDAP多糖的活化率可高达50%[6],且其毒性较低,更易储存[6-7];CDAP虽能在水溶液的环境中活化多糖,但在水溶液中并不稳定,在中性水溶液中数小时即降解,而在碱性水溶液中则会迅速降解[6]。目前,已有多篇文献报道CDAP活化多糖制备的结合疫苗中残留CDAP的测定方法[8-9],但基于CDAP在中性和碱性水溶液中不稳定的特点,其在水溶液中的降解产物也应纳入相关疫苗的杂质检测中。
核磁共振波谱(nuclear magnetic resonance spectrum,NMR)分析作为一种定性手段,常应用于药品杂质的研究中。参考欧洲专利(EP 1 162 998 B1)[0113]项[10]的描述,在肺炎球菌结合疫苗的制备过程中应进行 4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)残留的测定,因此,本研究采用一维核磁氢谱(1H-NMR)及碳谱(13C-NMR)对 CDAP及DMAP进行检测,以确认CDAP降解产物的结构,并测定降解程度。
1 材料与方法
1.1 样品 CDAP和DMAP均购自美国Sigma公司,其中CDAP纯度为99.7%。
1.2 主要试剂及仪器 重水(99.9%)购自美国Sigma公司;NaOH(分析纯)购自国药集团化学试剂有限公司;600 MHz核磁共振波谱仪购自美国瓦里安公司;紫外-可见光分光光度计(型号UV-4802)购自尤尼柯(上海)仪器有限公司。
1.3 CDAP降解产物定性检测 称取20 mg的CDAP,经1 mL重水溶解,用1 mol/L NaOH调节pH至9.0,室温静置过夜,即为CDAP降解溶液,终浓度18.2 mg/mL。将CDAP和DMAP分别用重水配制成20和10 mg/mL的溶液。20 mg/mL CDAP溶液及CDAP降解溶液经200倍稀释后进行紫外光谱分析(200~ 400 nm);20 mg/mL CDAP溶液、10 mg/mL DMAP溶液及CDAP降解溶液进行1H-NMR和13CNMR分析。
1.4 核磁分析条件1H-NMR分析条件:探头温度25℃,扫描次数16次,增益值为20,弛豫系数5,采集时间1.4 min,频率600 MHz。13C-NMR分析条件:探头温度25℃,扫描次数28次,增益值为30,弛豫系数5,采集时间2.6 min,频率400 MHz。
1.5 CDAP降解程度的检测 将CDAP用重水配制成 1、0.5、0.2、0.1 和 0.05 mg/mL 的溶液,进行1H-NMR分析。样品在测定前配制,迅速上样分析,防止降解。
2 结果
2.1 CDAP降解产物的定性
2.1.1 紫外光谱分析 经碱性溶液过夜处理,CDAP降解产物的紫外吸收峰由300 nm移动至280 nm,见图1。

图1 CDAP与CDAP降解产物的紫外扫描图谱Fig.1 Ultraviolet spectra of CDAP and its degra-dation product
2.1.21H-NMR谱分析 CDAP及DMAP图谱在3.5~2.5 ppm处均有6个质子的单峰,可确定为甲氨基结构中甲基上的6个质子。在9.0~6.0 ppm处有2个裂分峰,与发生对位取代的苯环或1,4位取代的吡啶环吻合。CDAP的图谱中,2,6位质子的化学位移为8.08 ppm,3,5位质子的化学位移为6.95 ppm,甲氨基上质子的化学位移为3.27 ppm;DMAP的图谱中,2,6位质子的化学位移为7.85 ppm,3,5位质子的化学位移为6.38 ppm,甲氨基上质子的化学位移为2.74 ppm;CDAP降解产物图谱中,主峰有3.00的6个质子的单峰,6.67 ppm处2个质子和7.85 ppm处2个质子的裂分峰,其结构符合吡啶环上1、4位取代的结构。根据CDAP结构,该降解产物为DMAP或DMAP的某种N-末端衍生物,其N-末端基团无氢或其氢为活性氢。其中,3.00 ppm处为甲氨基上6个质子化学位移,6.67 ppm处为吡啶环上3、5位质子的化学位移,7.85 ppm处为吡啶环上2、6位质子的化学位移。由于其2,6位的质子化学位移与DMAP相同(均为7.85 ppm),表明降解产物在吡啶环的N-末端已不存在对相邻质子产生去屏蔽效应的基团连接。见图2。
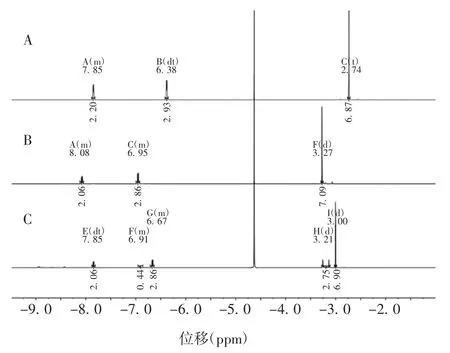
图2 CDAP(A)、DMAP(B)与 CDAP 降解产物(C)的 1HNMR谱Fig.21H-NMR spectra of CDAP(A),DMAP(B)and degradation product of CDAP(C)
2.1.313C-NMR谱分析 CDAP在124 ppm处有典型氰基(-CN)碳原子化学位移,CDAP降解产物未见化学位移峰,与DMAP的13C谱基本一致,仅出现4种碳的化学位移峰,见图3。可推断该降解产物的氰基(-CN)上的碳原子已丢失。

图3 CDAP(A)、DMAP(B)与 CDAP 降解产物(C)的 13CNMR谱Fig.313C-NMR spectra of CDAP(A),DMAP(B)and degradation product of CDAP(C)
CDAP降解主要产物保留了吡啶环4位与甲氨基连接的结构,其吡啶环氮端无氰基连接也无其他具有去屏蔽效应的基团连接。因此推断,CDAP降解的主产物结构与DMAP一致。
2.2 CDAP的降解程度 CDAP于8.08 ppm处的裂分峰,当其浓度为0.2 mg/mL以上时,8.08处质子峰信号已明显高于检测限(图略);浓度为0.1 mg/mL时为基线噪音的3倍以上;浓度为0.05 mg/mL时降低至2倍以下。见图4。因此认为1H-NMR法测定CDAP的检测限为0.1 mg/mL。由于CDAP降解产物中的CDAP浓度配制时为18.2 mg/mL,结合2.1.2项结果(CDAP降解产物图谱未见8.08 ppm处的质子化学位移),表明其中CDAP已降解至无法检出(0.1 mg/mL以下),因此其中CDAP的降解程度≥99.5%。

图4 不同浓度CDAP的降解情况Fig.4 Degradation of CDAP at various concentrations
3 讨论
基于CDAP的多糖蛋白结合工艺在pH 9.0有较高的多糖活化效率[11],且多篇文献均采用了pH 9.0作为活化多糖的条件[3-4],因此,本研究选择该环境进行CDAP降解,以模拟在结合过程中CDAP所处的溶液环境。本研究对多糖活化试剂CDAP在水环境中的降解产物进行了1H-NMR和13C-NMR分析,证实了CDAP在pH 9.0的碱性水溶液(重水)中降解的主产物为DMAP。
本研究紫外光谱分析表明,CDAP经降解后其吸收峰由300 nm移至280 nm,与文献[3]报道的一致,但无法依此判断降解产物的结构。NMR分析条件温和,且对样品溶液pH环境无要求,可确保分析过程中供试品的稳定性。由于-CN基团为吸电子基团(电负性),CDAP中各质子的化学位移受其去屏蔽效应影响,向低场移动。因此CDAP吡啶环2,6位质子的化学位移在8.08 ppm,而DMAP的质子化学位移在7.85 ppm,可依此区别CDAP与DMAP。本实验通过基于8.08 ppm峰的变化情况,根据检测限度进行了CDAP降解程度的分析。表明CDAP在碱性(pH 9.0)条件下的降解程度达99.5%。
考虑到多糖及多糖-蛋白结合物中质子峰可能对CDAP氢谱分析的干扰,本实验仅在重水溶液环境中进行了纯CDAP的降解研究,未在实际的多糖-蛋白结合过程中或过程后进行CDAP降解的研究。在今后的实验中,将结合过程前后对反应体系取样并通过透析、层析等手段获得CDAP的降解产物,以对真实结合环境下的CDAP降解产物进行结构分析。
本研究结果表明,在多糖-蛋白结合过程中,未被消耗的过量CDAP会在碱性水溶液环境中降解成以DMAP为主的杂质,应将DMAP残留纳入基于CDAP活化的多糖-蛋白结合疫苗生产过程中残留物分析的质量控制范围。
志谢感谢武汉生物样本库有限公司及其核磁共振波谱设备负责人杨中正博士在核磁共振波谱技术和仪器使用上对本研究的支持

