CD1d融合蛋白的表达及其在自然杀伤T细胞原代培养中的作用
刘计荣,赵冰,韩化敏
1.华北电力大学医院,北京 102206;2.拜西欧斯(北京)生物技术有限公司,北京 100070
自然杀伤 T(natural killing T,NKT)细胞是一群细胞表面既有T细胞受体TCR,又有NK细胞受体的特殊T细胞亚群[1]。NKT细胞能表达T细胞的TCR及NK细胞的NKR-P1两种受体,特别是NKT细胞多数表达Va14 TCR,识别CD1抗原,而NKR-P1识别各种糖链。绝大多数NKT细胞仅能识别由CD1d分子递呈的特异性糖脂类分子,而不能识别由主要组织相容性复合物(MHC)递呈的多肽[2]。NKT细胞表面的TCRαβ链,使得NKT细胞特异性识别由CD1d分子呈递的脂类或糖脂类抗原,其中α-GalCer通过与CD1d特异性结合,而CD1d又与TCR连接形成三联体复合体,将α-GalCer抗原递呈给Ⅰ型NKT细胞,激活的NKT细胞具有直接杀瘤效应,并进一步活化NK细胞,促进其杀瘤效应;α-GalCer激活的Ⅰ型NKT细胞可促进树突状细胞分泌IL-12,从而增强抗瘤效应;活化后的NKT细胞能够快速、大量分泌Th1、Th2型细胞因子,从而强有力地影响免疫反应类型,实现对免疫应答的调控。
目前,多项自体NKT细胞治疗肿瘤的临床试验 已注册进行(NCT01801801852,NCT02619058,NCT03093688)。张明徽[3]表示,将 NKT 特异性扩增后回输治疗,或采用激动药物将患者体内的NKT激活,可能会达到彻底压制肿瘤的目标。已有早期肝癌和胃癌转移患者仅依靠该项技术,无病存活超过3年。如何在体外获得足够量、有活性的NKT细胞是成功进行NKT细胞过继性免疫的关键。但由于NKT细胞在外周血数量有限,扩增效率低,难以获得足够治疗剂量的细胞数量。已知在NKT细胞激活过程中,CD1d和α-GalCer的作用不可代替。α-GalCer作为Ⅰ型NKT细胞的特异性激动剂,可用于在体内外活化并大量扩增Ⅰ型NKT细胞。自然情况下,CD1d与β2微球蛋白形成异源二聚体,通过将表达CD1d与hIgG1的基因连接,原核或真核表达重组蛋白,并借助hIgG1自身的二硫键形成二聚体,该重组蛋白负载α-GalCer后可作为诱导扩增NKT细胞的方法。另外,还可利用α-GalCer/CD1d四聚体作为Ⅰ型NKT细胞的检测工具。
本研究构建了一种CD1d/hIgG1重组蛋白,该重组蛋白在设计上除了可作为人工的抗原提呈细胞促进Ⅰ型NKT细胞的激活和扩增外,还加入了生物素化标签,可与链霉亲和素磁珠结合,起到富集Ⅰ型NKT细胞以及固相刺激的作用。通过RT-PCR获得编码CD1d蛋白和β2微球蛋白的cDNA,添加相应的酶切位点及标签后,将目的基因插入至表达载体中构建重组质粒,将重组质粒转入CHO-K1细胞建立稳定表达CD1d融合蛋白的细胞系,持续获得大量纯化重组蛋白,同时筛选出CD1d融合蛋白和α-GalCer的最佳添加剂量,进行NKT细胞培养。
1 材料与方法
1.1 外周血 由年满18周岁健康志愿者捐献,常规项目检查均正常,所有志愿者均签署知情同意书。
1.2 质粒、细胞及菌株 pcDNA3.1(-)载体购自美国Invitrogen公司;中国仓鼠卵巢细胞(CHO-K1细胞)及293T细胞购自协和医院细胞库;linker-BriA tag基因质粒由苏州金唯智生物科技有限公司合成并提供;hIgG1基因质粒和大肠埃希菌(E.coli)DH5α 由拜西欧斯(北京)生物技术有限公司研发实验室保存并提供。
1.3 主要试剂及仪器 Trizol试剂购自天根生化科技(北京)有限公司;限制性内切酶XbaⅠ、HindⅢ、BamHⅠ和T4 DNA连接酶购自美国NEB公司;DNA marker、逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit、转染试剂购自日本TaKaRa公司;兔抗人CD1d抗体购自美国Abcam公司;HRP标记的山羊抗人IgG购自北京索莱宝科技有限公司;BirA生物素蛋白连接酶标准反应试剂盒购自美国AVIDITY公司;Bio-Rad凝胶成像系统购自美国Bio-Rad公司;Protien A柱购自美国GE公司;PCR仪购自北京东胜创新生物科技有限公司。
1.4 引物设计及合成 根据GenBank-CD1d(No.NM210766)的功能编码区序列和载体pcDNA3.1(-)序列的特点,选择XbaⅠ和BamHⅠ作为限制性内切酶,应用Primer Premier 5.0软件设计上下游引物。Primer1:5′-gtctagaatg tctcgctccg tggccttagc tgtg-3′;Pimer2 R:5′-ctccgccaga tccgccacct ccgtctcgat cccacttaac tatc-3′;Primer3 R:5′-cgggatccgc cgccacccga gccacctccg ccagatccgc cacctcc-3′;Primer4 F:5′-cgggatccgtcccgcaaaggcttttcc-3′;Primer5 R:5′-gaggatggat cgga-ggtgta gctccc-3′;Primer6 F:5′-ctacacctcc gatccatcct ctagagtc-3′;Primer7 R:5′-cccccaccac ctttacccgg agacagg-3′;Primer8 F:5′-ccgggtaaag gtggtggggg ttcgggc-3′;Primer9 R:5′-ggaagctttt agtgccattc gattttttgt gcttcgaaga tgtcgttgag gcccg-3′。引物由苏州金唯智生物科技有限公司合成。
1.5 重组质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag的构建 分离外周血PBMC,Trizol试剂提取RNA,反转录为cDNA,以其为模板,利用引物Primer1/Primer2进行第一轮扩增(扩增条件:94℃30 s,55℃30 s,72 ℃ 75 s,33 个循环;72 ℃ 10 min);以第一轮扩增产物为模板,利用引物Primer1/Primer3进行第二轮扩增,获得片段 β2M+(G4S)3;以 cDNA 为模板,利用引物Primer4/Primer5进行扩增,获得CD1d基因;以hIgG1基因质粒为模板,利用引物Primer6/Primer7进行扩增,获得hIgG1片段;以linker-BriA tag基因质粒为模板,利用引物Primer8/Primer9进行扩增,获得linker-BriA tag片段;将hIgG1片段与linker-BriA tag片段混合,利用引物Primer6/Primer9进行overlap扩增,获得hIgG1+linker-BriA tag;将CD1d基因片段与hIgG1+linker-BriA tag片段混合,利用引物Primer4/Primer9进行overlap扩增,获得CD1d+hIgG1+linker-BriA tag;XbaⅠ、HindⅢ酶切pcDNA3.1(-)及 XbaⅠ、BamHⅠ酶切 β2M+(G4S)3,BamHⅠ、HindⅢ酶切 CD1d+hIgG1+linker-BriA tag,将酶切产物 pcDNA3.1(-)、β2M+(G4S)3 与CD1d+hIgG1+linker-BriA tag用T4 DNA连接酶连接,连接产物转化 E.coli DH5α,涂布含 100 μg/mL氨苄青霉素平板,进行克隆筛选,XbaⅠ和BamHⅠ酶切鉴定重组质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag,鉴定正确的质粒送苏州金唯智生物科技有限公司测序。
1.6 稳定表达细胞株的筛选 将CHO-K1细胞用含10%FBS的F12K培养基培养,至细胞融合度达80%时,采用磷酸钙转染法,转染质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag,G418筛选转染成功细胞株,接种至96孔板,每孔不超过1个细胞,进行扩增,37℃,5% CO2培养箱中进行培养。收集上清进行6%琼脂糖凝胶电泳鉴定及Western blot分析。将稳定表达CD1d蛋白的CHO-K1细胞系扩增培养,取细胞培养液上清,超滤离心获得超滤浓缩液(约30 mL),0.45 μm 滤膜过滤,用 Protien A 柱纯化,ELISA法检测表达量。将纯化后获得的CD1d蛋白按照BirA生物素蛋白连接酶标准反应试剂盒说明书进行蛋白生物素化,同时进行Western blot分析。
1.7 Western blot分析 取样品经8%SDS-PAGE分离,上样量均为20 μL,预染蛋白质marker上样量为5 μL。浓缩胶电泳条件为80 V,45 min,分离胶电泳条件为120 V,45 min。电泳结束后转膜,4~6℃,200 mA约2 h;封闭液(8%脱脂牛奶)37℃封闭2 h或4℃过夜;PBST洗涤1次,加入CD1d抗体(1∶1 000稀释)作为一抗,4℃过夜;加入HRP标记的山羊抗人IgG(1∶2 000稀释)作为二抗,脱色摇床室温振荡1 h;PBST洗涤3次,每次10 min,DAB试剂避光显色5~10 min,加入蒸馏水终止反应。用Bio-Rad凝胶成像系统进行拍照。
1.8 重组 pcDNA3.1(-)-CD1d-hIgG1-BriA tag 质粒的真核表达 试验分为3组:pcDNA3.1(-)空载体组、293T 细胞组、质粒 pcDNA3.1(-)-CD1d-hIgG1-BriA tag转染组。收集各组细胞培养液上清进行Western blot分析,方法同1.7项。
1.9 hIgG1-BriA tag蛋白对NKT细胞体外扩增影响的检测 采用流式细胞术。取分离的PBMC进行NKT细胞培养,试验分为2组:hIgG1-BriA tag组,在PBMC培养过程中加入hIgG1-BriA tag蛋白、α-Galcer糖及CD3抗体;对照组,仅加入CD3抗体。Beckmancyto FLEX流式细胞仪对培养细胞进行分析,采用 anti-CD3-FITC、anti-CD56-PE、anti-CD8-APC(ebiosicense)三种荧光通道,同型对照抗体确定散点门的未知及检测电压,并调节补偿。
2 结果
2.1 目的基因的鉴定 扩增产物CD1d-hIgG1-BriA tag经8%琼脂糖凝胶电泳分析,可见1 862 bp的特异性片段,见图1。

图1 CD1d+hIgG1+BriA tag扩增产物电泳图Fig.1 Electrophoretic profile of PCR products of CD1d+hIgG1+BriA tag
2.2 重组质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag的鉴定 质粒的双酶切(XbaⅠ/BamHⅠ)产物经8%琼脂糖凝胶电泳分析,pcDNA3.1(-)-CD1d-hIgG1-BriA 3个重组质粒均分别可见399、800和6 411 bp的特异性条带,大小与预期相符,见图2;质粒的双酶切(HindⅢ/BamHⅠ)产物经8%琼脂糖凝胶电泳分析,pcDNA3.1(-)-CD1d-hIgG1-BriA 3 个重组质粒均分别可见1 871和5 800 bp的特异性条带,大小与预期相符,见图3。证明3个重组质粒均构建成功。
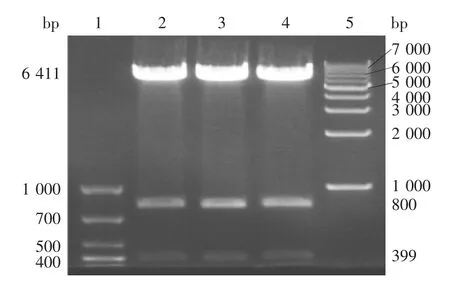
图2 CD1d基因3个重组质粒的双酶切(XbaⅠ/BamHⅠ)产物电泳图Fig.2 Restriction map of three recombinant vectors for CD1d gene(XbaⅠ/BamHⅠ)
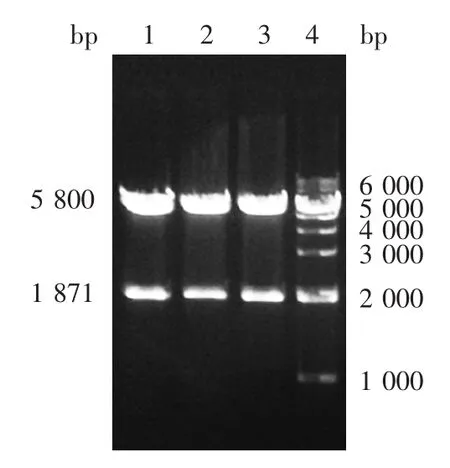
图3 CD1d基因3个重组质粒的双酶切(HindⅢ/BamHⅠ)产物电泳图Fig.3 Restriction map of three recombinant vectors for CD1d gene(HindⅢ/BamHⅠ)
2.3 pcDNA3.1(-)-CD1d-hIgG1-BriA tag稳定表达细胞株的筛选及鉴定 9号CHO-K1细胞株(泳道5)可表达CD1d融合蛋白,大小与预期相符,见图4;培养上清浓缩液经Protien A柱纯化,纯化后CD1d融合蛋白相对分子质量大小与预期相符,见图5;ELISA结果显示,转染重组载体的CHO-K1细胞培养液上清样品(编号 1~10)A280值分别为 0.073、0.098、0.093、0.082、0.090、0.076、0.106、0.088、0.187和0.107),未转染重组质粒的CHO-K1细胞培养液上清样品(阴性对照)A280值为0.130,9号CHO-K1细胞株纯化后CD1d蛋白样品(编号9-1~4)A280值分别为 3.781、3.259、3.519 和3.717,其中,9号CHOK1细胞培养液上清A280值最高,经纯化A280增加约19倍。纯化的CD1d融合蛋白先进行生物素化,再进行Western blot分析,相对分子质量大小与预期相符,见图6。表明9号细胞株为表达CD1d蛋白的稳定细胞株。

图4 质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag转染CHOK1细胞表达的CD1d融合蛋白的Western blot分析Fig.4 Western blotting of CD1d fusion protein expressed in CHO-K1 cells transfected with plasmid pcDNA3.1(-)-CD1dhIgG1-BriA tag

图5 9号转染细胞培养上清纯化后产物的Western blot分析Fig.5 Western blotting of purified protein expressed in clone 9 of transfected cells

图6 经生物素化的纯化的CD1d融合蛋白的Western blot分析Fig.6 Western blotting of purified CD1d fusion protein after biotinylation
2.4 重组CD1d-hIgG1-BriAtag蛋白的鉴定 Western blot分析显示,该融合蛋白的二聚体大小处可见明显条带,见图7。证明构建的重组质粒pcDNA3.1(-)-CD1d-hIgG1-BriA tag可在293T细胞中正确表达。

图7 CD1d蛋白表达水平的Western blot分析Fig.7 Determination of expression level of CD1d protein by Western blot
2.5 CD1d-hIgG1-BriA tag对NKT细胞体外扩增的影响 培养第8天,hIgG1-BriA tag组出现明显的细胞增殖,成团簇细胞出现,见图8;流式细胞术分析显示,与对照组(2.31%)相比,CD3+CD56+NKT细胞由培养前的0.30%扩增至4.99%,显著增加,提示CD1d-hIgG1-BriA tag融合蛋白对NKT细胞具有刺激作用,见图9。

图8 CD1d-hIgG1-BriA tag融合蛋白作用下培养不同天数的PBMC的显微镜观察(×200)Fig.8 Microscopy of PBMCs cultured for various days after treatment with CD1d-hIgG1-BriA tag(× 200)

图9 两组细胞不同培养时间CD3+CD56+NKT流式细胞仪计数细胞的比较Fig.9 Flow cytometry of CD3+CD56+NKT cells cultured for various days in two groups
3 讨论
恶性肿瘤是严重威胁人类健康的主要疾病之一。手术、放疗、化疗是肿瘤治疗的传统手段[4],免疫治疗目前已成为治疗肿瘤的第四种手段,而且是最有效的手段之一。通过采集患者自身免疫细胞,经体外培养扩增,再回输至患者体内以杀灭癌细胞、病原体,激活人体免疫能力,从而预防肿瘤复发和转移,可在一定程度上解决患者放化疗后免疫力差、生活质量下降的弊端。细胞免疫疗法在国际上已逐渐成为治疗癌症的新趋势,2011年世界顶级期刊《自然》发文提出“免疫治疗的时代已经到来”[5]。
目前用于细胞免疫治疗的主要有高纯度树突状细胞DC、CIK、NK细胞、CD3抗体激活的杀伤细胞(CD3AK)、嵌合抗原受体T细胞(CAR-T)和NKT细胞。NKT细胞是从人外周血或脐带血经体外分离获得单个核细胞,经刺激后连续培养获得,是联系固有免疫和获得性免疫的桥梁之一[6]。NKT细胞是不同于T、B淋巴细胞的第三类淋巴细胞,能表达T细胞的TCR与NK细胞的NKR-P1两种受体,特别是NKT细胞多数表达Va14TCR,识别CD1抗原,而NKR-P1识别各种糖链。NKT细胞仅能识别CD1d分子提呈的脂类、蛋白质抗原[7],在这些抗原的刺激下,NKT细胞不仅是IL-4和IFNγ的强力产生细胞,同时参与Th1/Th2分化的抑制,其主要生物学功能包括免疫调节和细胞毒作用,可直接杀伤某些肿瘤细胞和病毒感染细胞,因此在机体抗肿瘤、早期抗病毒或胞内寄生菌感染的免疫应答中起重要作用。
NKT细胞在人体内普遍存在,即使在肿瘤患者体内也存在具有效应作用的NKT细胞,且NKT细胞对肿瘤细胞的识别不受MHC表型的限制。因此,α-GalCer/CD1d-NKT系统可能成为人肿瘤免疫治疗中新的有效方法。
NKT细胞的激活不仅可直接发挥抗肿瘤免疫作用、间接激活多种免疫细胞,还可激活衰竭的CD8+T细胞和NK细胞,从而快速、持久地增强抗肿瘤活性。因此,NKT细胞免疫治疗是目前对免疫治疗耐药癌症患者的一个良好的选择[8]。
既往NKT细胞在临床抗肿瘤治疗中作用的研究主要集中在将NKT细胞配体α-GalCer用于激活癌症患者NKT细胞发挥抗肿瘤作用[9-10],对于NKT细胞唯一识别的递呈抗原分子CD1d研究较少,因此本研究体外成功重组了刺激NKT细胞活化的CD1d-hIgG1融合蛋白,并验证在体外用该蛋白刺激NKT细胞的增殖。由于NKT细胞比例较低,影响了扩增效果,下一步将对PBMC进行NKT细胞的磁珠分选纯化,并将CD1d-hIgG1融合蛋白/链霉亲和素磁珠作为固相再进行扩增,并对培养条件,如培养基、细胞因子、添加物及CD1d-hIgG1融合蛋白用量进行优化,为NKT细胞免疫治疗提供了一种体外刺激活化免疫细胞的选择。

