高水平血清铁蛋白对初诊AML患者远期预后的影响研究*
陈连连,罗 鹏,王海峰,薛 茹
(1.西北大学附属医院/陕西省西安市第三医院检验科 710018;2.重庆医科大学附属第一医院检验科 400016;3.陕西省西安市第四医院新生儿科 710004)
急性髓系白血病(AML)是一种异质性血液系统恶性肿瘤,AML患者的预后受年龄、细胞遗传学、分子异常等多重因素影响。多项研究表明铁代谢失衡和过量铁的积累与白血病的发生、发展密切相关[1-2]。生理情况下铁元素可促进细胞生长和增殖,但过量铁可使细胞发生氧化应激损伤。铁过载在血液恶性肿瘤中很常见,特别是在造血干细胞移植和反复输血的患者中[3]。血清铁蛋白(SF)是反映人体内储存铁的主要物质,因此,SF的明显增高被用来判断患者体内是否存在铁过载,而骨髓铁染色亦是判断储存铁的可靠依据。此外,SF也是一种急性时相反应蛋白,受炎症、感染、心肌梗死、肝功能不全、肿瘤等多种因素的影响。为了排除治疗相关的炎症或红细胞输注引起的铁超载的影响,本研究分析新确诊的AML患者治疗前后SF水平和骨髓组织铁染色的变化,评价不同SF水平患者治疗后的生存时间,试图阐明初诊时SF水平在AML治疗及预后中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年6月至2018年6月于西北大学附属医院血液科首次确诊的80例AML患者为研究对象。纳入标准:(1)符合世界卫生组织(WHO)造血与淋巴组织肿瘤分类(2008)的最低诊断标准;(2)征得受试者知情同意。排除标准:(1)合并重度感染、严重肝脏、心、肾等基础疾病者;(2)美国国立综合癌症网络(NCCN)指南中指出的某些预后明确的染色体核型和分子异常者。选取同期住院的100例非恶性肿瘤性疾病患者(除外肝病、活动性炎症、发热、溶血性贫血、应用铁剂治疗等可能影响血清蛋白水平者)作为对照组。80例AML患者中AML-M0 2例、AML-M1 7例、AML-M2 36例、AML-M4 10例、AML-M5 21例、AML-M6 3例、AML-M7 1例;男43例,女37例,中位年龄为58(17,78)岁。对照组男46例,女54例,中位年龄为52(16,81)岁。本研究符合伦理学标准。
1.2 方法
1.2.1观察指标
(1)临床资料:所有研究对象的临床资料,包括性别、年龄、WHO分型等。(2)SF:AML患者在初诊时、治疗后(化疗后8 d)和对照组均空腹抽血,乙二胺四乙酸二钾(EDTA-K2)抗凝,VIDAS全自动荧光分析仪(法国Biomerieux S60)检测SF水平。以初诊时AML患者SF水平(校正后)750 μg/L为分割点,分为高SF组(n=31)和低SF组(n=49)。(3)C反应蛋白(CRP):CRP>0.005 g/L(正常范围上限)的AML患者进行SF校正,校正因子为0.67[4]。(4)骨髓组织铁染色:采用环钻法在髂后上棘取骨髓组织,PCF法固定,塑料包埋后切片,普鲁士蓝染色法染色。镜下阳性含量及强度分级标准:镜下无阳性颗粒为(-);间质中少量散在蓝色颗粒和(或)巨噬细胞的胞质有蓝色颗粒为(+);间质中和巨噬细胞胞质中较多蓝色颗粒或小珠为(++);间质中及巨噬细胞质内分布广泛的蓝色颗粒、小珠或小团块为(+++);除散在蓝色颗粒、小珠外,并见小团块成堆分布为(++++)。骨小梁、脂肪细胞空泡内或无组织、无细胞的区域出现蓝色物质,均视为非特异性着色。
1.2.2随访
所有AML患者随访至2019年3月31日。无病生存(DFS)期按初次完全缓解开始,截至病情复发或任何原因导致死亡的时间或随访至2019年3月31日来计算。总生存(OS)期按初次确诊为AML开始,截至任何原因导致死亡的时间或随访至2019年3月31日来计算。
1.3 统计学处理
采用SPSS17.0软件进行数据分析,计量资料以M(Q1,Q3)表示,两独立样本比较采用Mann-WhitneyU秩和检验,多组独立样本比较采用Kruskal-walliH秩和检验;计数资料以频数或百分率表示,比较采用χ2检验;Kaplan-Meier法绘制生存曲线,应用Log-rank检验进行生存曲线比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 初诊时AML患者一般临床资料比较
高、低SF组性别、年龄和各WHO分型比较,差异无统计学意义(P>0.05),见表1。
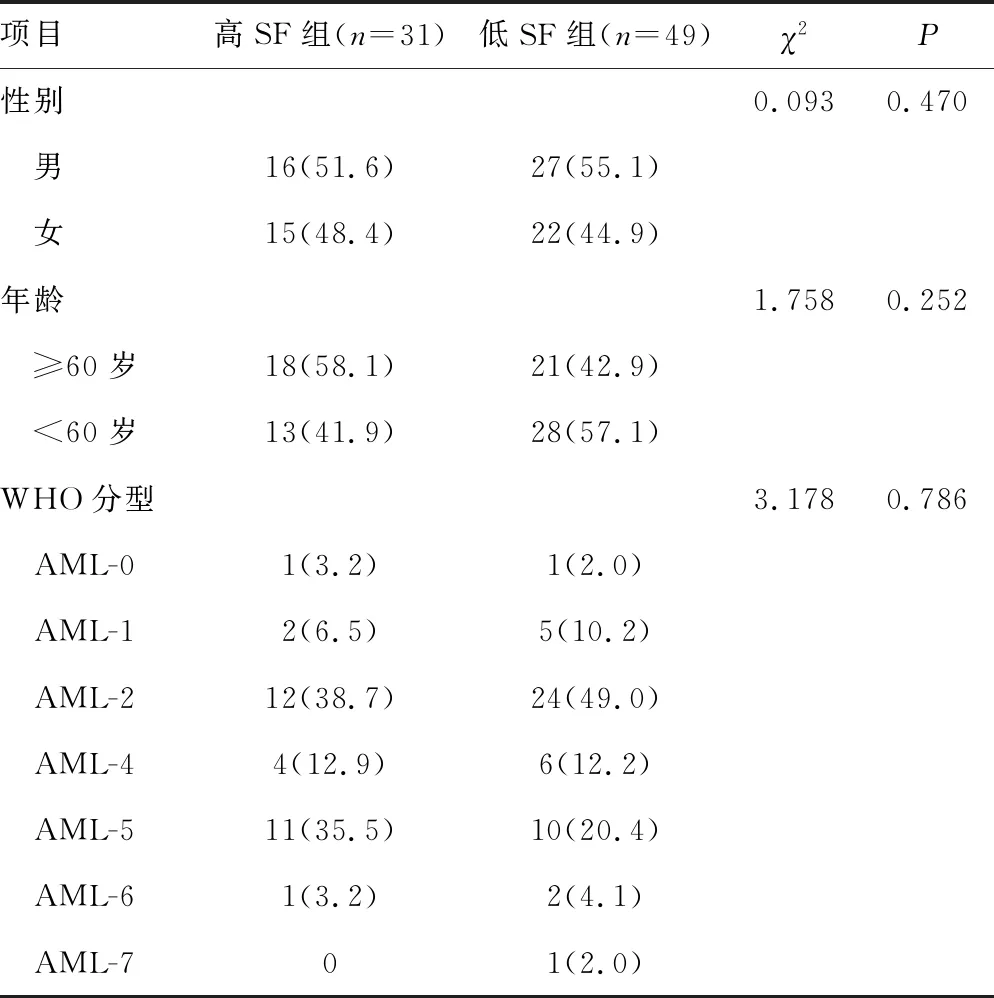
表1 不同组别初诊AML患者一般临床资料比较[n(%)]
2.2 AML初诊患者SF水平
80例AML患者首次确诊时SF为572.36(365.19,1 147.08)μg/L,明显高于对照组,差异有统计学意义(P<0.05)。AML患者治疗后SF为836.29(566.94,1 512.04)μg/L,明显高于治疗前,差异有统计学意义(P<0.05),见表2。
2.3 骨髓组织铁染色在白血病患者治疗前后的变化
初诊时AML患者骨髓组织铁染色阳性强度“+~++”64例(80.0%),“+++~++++”7例(8.7%),与对照组比较差异无统计学意义(P>0.05)。化疗后AML患者骨髓组织铁染色阳性强度“+++~++++”30例(37.5%),与初诊时比较明显升高,差异有统计学意义(P<0.05),见表2。

表2 SF和骨髓组织铁染色在初诊AML患者治疗前后的表达
2.4 初诊时SF对AML患者DFS和OS的影响
高SF组SF中位数为1 720.20 μg/L,低SF组为425.42 μg/L。高SF组和低SF组中位DFS期分别为18.4(13.6,30.7)和27.8(19.2,39.7)个月,差异有统计学意义(P<0.05)。高SF组和低SF组中位OS期分别为30.4(21.4,39.3)和36.8(27.4,47.2)个月,差异有统计学意义(P<0.05)。高SF组DFS期和OS期分别为19%和39%;低SF组分别为51%和65%,见图1。

A:DFS;B:OS。
3 讨 论
铁代谢失衡和过量铁的积累与白血病的发生、发展密切相关。铁过载可导致活性氧物质(ROS)增加而引起氧化应激,损伤DNA、蛋白质、脂质或其他生物分子,甚至导致细胞死亡[5]。过量的铁通过FoxO3、ATM、mTOR和AKT等ROS相关信号传导途径导致骨髓干细胞损伤,抑制骨髓造血功能[6-7]。此外,白血病细胞对铁摄取增加而铁流出减少,导致白血病患者体内系统铁池增加加重了上述效应[8]。有证据表明,以铁代谢为靶点的治疗可以诱导白血病细胞分化和凋亡[9-10]。
不可忽视的是,慢性炎症在骨髓恶性肿瘤发病中扮演着重要角色,由此引发的氧化应激可导致骨髓造血干细胞微环境功能障碍。有报道称,异常炎性反应激活的巨噬细胞可能是急性髓性白血病患者SF过度分泌的主要来源[11]。而SF作为一种急性时相反应蛋白,有理由推断初诊时SF升高的部分原因是由炎症引发的。因此,参考文献记载在分析前用CRP值对SF进行了校正[4]。
本研究主要关注AML患者体内储存铁的变化。人体内铁主要以SF和含铁血黄素形式存在于单核-吞噬细胞系统中(骨髓、肝、脾等)。结果显示,AML患者在初诊时SF水平已升高,这与文献[12]的结果相符合。初诊和治疗后AML患者SF水平较对照组均明显增高,对比化疗前后的SF值,发现治疗后AML患者SF水平更高。同时,骨髓组织铁染色结果显示初诊AML患者骨髓储存铁正常,而化疗后储存铁明显增高,甚至在骨髓苏木素-伊红常规染色时出现肉眼可见的含铁血黄素黄色颗粒的沉积。这与SF结果并非完全一致。究其原因,认为这可能与治疗诱发炎性反应有关。已有报道显示,SF水平与AML患者体内白细胞计数、原始细胞计数呈正相关[12],提示铁蛋白水平与肿瘤负荷之间存在关联。基于以上事实,推断初诊时AML患者体内SF水平可能反映AML患者体内的肿瘤负荷,而治疗后SF在一定程度上反映了机体储存铁的增加。
目前,AML的预后分层依据细胞遗传学和分子遗传学指标分为预后良好、预后中等和预后不良,在提示患者预后生存和指导治疗方案上发挥重要作用。但尚无有效的血清学标志评价AML预后。按照性别构成、年龄分布、WHO分型等进行统计,发现不同组别AML患者SF水平差异无统计学意义(P>0.05)。排除预后好或差的遗传学和分子异常后,结果仍显示初诊时AML患者高SF组内存在较低的OS和DFS,提示初诊AML时SF升高与明显的低生存率相关。有关临床研究也表明,初诊时高铁蛋白血症与化疗药物耐药、复发率较高及总体生存率较低明显相关[13]。所以,认为高水平的SF可以作为AML患者接受强化治疗后长期生存的不良预后因素。分析其原因,认为这可能由铁相关的毒性所致。事实上,血液系统恶性肿瘤中的铁超载与治疗过程中肝肾或其他脏器衰竭有关,特别是在异基因造血干细胞移植中,移植前SF水平升高是总体生存率和无复发死亡率的不利预后因素[13-14]。铁蛋白促进白血病细胞的生长,同时抑制正常祖细胞的集落形成;与正常造血干细胞相比,AML和白血病干细胞中铁蛋白重链(FTH)和铁蛋白轻链(FTL)均过度表达[12]。高SF通过ROS介导的毒性对正常细胞和白血病细胞产生影响,导致毒性和发病率增加[15]。氧化应激还可能加速白血病细胞的基因组不稳定性,从而增加复发的风险[16]。在AML中,ROS引起的氧化应激通过增加DNA双链断裂和修复错误促进造血干细胞移植的恶性转化[17]。此外,铁超载通过调节自然杀伤(NK)细胞、T淋巴细胞免疫功能允许白血病细胞免疫逃避[18]。
综上所述,初诊时高水平SF与AML患者无病生存期和总生存期有一定的相关性。但其在AML患者中的机制尚未完全明了。因此,未来临床试验应涵盖更大样本量的AML患者,并纳入更多的铁代谢参数以阐述其详细机制。祛铁治疗可能作为AML新的治疗靶点,从而延长患者的生存期。

