氯沙坦对非梗阻性肥厚型心肌病患者心肌肥厚程度的影响
李洁 左蕾 阳慧婷 马志玲 郭兰燕
肥厚型心肌病(HCM)是指非单纯因心脏负荷异常如高血压、主动脉瓣狭窄等所引起的左室壁肥厚,是一种以心肌进行性肥厚、心室腔进行性缩小为特征,以左心室血液充盈受阻、舒张期顺应性下降为基本病理特点的常染色体显性遗传性心肌病[1]。根据HCM对血流动力学的影响可分为非梗阻性肥厚型心肌病(NOHCM)和梗阻性肥厚型心肌病(HOCM)。HCM患者无论有无梗阻或左心室收缩功能如何,最终都会因心肌纤维化和其他重塑机制导致进行性心力衰竭,最终进展为终末期左心室射血分数减低的收缩性心力衰竭[2-3]。心肌细胞纤维化是HCM的特点,间质纤维化的形成可能是一种动态、可逆的过程,因此,针对间质纤维化的治疗有可能改变机体的病理性促纤维化基质,减缓疾病的进展[4-5]。肾素-血管紧张素系统(RAS)激活被认为在HCM的发生发展中起重要作用。较多研究均证实血管紧张素Ⅱ受体拮抗剂(ARB)类药物可有效逆转或阻止纤维化的进展。在合并左心收缩功能减低的NOHCM患者中,RAS拮抗剂包括血管紧张素转化酶抑制剂(ACEI)/ARB被推荐用于减少心力衰竭和猝死的风险[6]。但在左心收缩功能正常者中暂无相关指南推荐。RAS激活是HCM的发病机制之一,抑制RAS的活性可能有益于HCM的病程逆转。本文旨在探讨ARB类药物氯沙坦是否可抑制或逆转心功能正常的NOHCM患者心肌肥厚程度,为其临床应用提供依据。
对象与方法
1.对象:2017年5月~2018年1月于我院HCM诊治中心就诊的由经胸心脏彩色多普勒超声检查确诊为心功能正常的NOHCM患者41例,根据有无使用氯沙坦分为试验组[氯沙坦100 mg每日1次+β受体阻滞剂(美托洛尔)和(或)地尔硫卓]20例和对照组[β受体阻滞剂和(或)地尔硫卓)21例,其中试验组男10例,女10例,年龄34~70岁,平均年龄(51.00±9.94)岁;对照组男13例,女8例,年龄20~65岁,平均年龄(41.95±12.86)岁。HCM诊断标准:排除系统疾病(如高血压、主动脉瓣狭窄等)、先天性心脏病、代谢性疾病伴发心肌肥厚及运动员导致的左心室和(或)室间隔肥厚后,超声心电图检查提示左室壁任意节段厚度≥15 mm;如有HCM家族史,存在其他不可解释的左心室厚度在1个或多个心肌节段≥13 mm。NOHCM诊断标准:静息或激发状态状态下左室流出道峰值压力阶差(LVOGT)<30 mmHg。
2.方法:通过我院电子病历平台收集试验组和对照组患者的临床资料(包括性别、年龄、BMI、收缩压、病程、家族史、随访期、合并室性心律失常、分支传导阻滞患者例数、使用药物情况)、治疗前后心脏超声检查结果[心脏各腔室大小、室间隔各部位厚度、左心室射血分数(LVEF)、LVOTG、左心室舒张功能]及心电图参数[心率、QRS波宽度、校正的QT间期(QTc)、QRS波振幅]并进行比较。

结 果
1.两组患者临床资料比较:两组患者性别、年龄、BMI、收缩压、病程、家族史、随访期、使用美托洛尔、地尔硫卓及合并分支传导阻滞、室性心律失常患者比例比较差异均无统计学意义(P>0.05)。见表1。
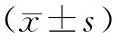
表1 两组患者临床资料比较
2.两组患者治疗前后心脏超声检查结果比较:试验组和对照组患者治疗前后及同组内治疗前后LVEF、左心室舒张末期容积(EDV)、左心房左右径(LA)、右心房左右径(RA)、右心室左右径(RV)、左心室左右径(LVlr)、左心室长轴直径(LVlong)、后间隔基底部(PIVSbase)、后间隔中部(PIVSmid)、后间隔心尖部(PIVSapical)、前间隔基底部(AIVSbase)、前间隔中部(AIVSmid)、前壁心尖部(AWapical)、侧壁基底部(LWbase)、侧壁中部(LWmid)、侧壁心尖部(LWapical)、后壁基底部(PWbase)、后壁中部(PWmid)、下壁基底部(IWbase)、LVOGT及左心室舒张功能[二尖瓣舒张早期血流速度(E峰)、二尖瓣舒张晚期血流速度(A峰)及二尖瓣环舒张早期瓣环位移速度(e’)]比较,差异均无统计学意义(P>0.05)。见表2。
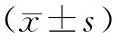
表2 两组患者治疗前后心脏超声检查结果比较
3.两组患者心电图参数比较:试验组患者治疗前后心率、QRS波宽度、QTc、各导联QRS波振幅比较差异均无统计学意义(P>0.05);对照组患者治疗后Ⅰ、Ⅱ、aVF导联QRS波振幅均高于治疗前(P<0.05),而对照组患者治疗前后其余心电图参数比较差异均无统计学意义(P>0.05)。见表3。
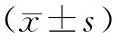
表3 两组患者治疗前后心电图参数比较
讨 论
HCM是一种进展性疾病,组织病理学主要表现为心肌细胞肥大和心肌细胞排列紊乱,可伴有心肌间质纤维化、心肌细胞变形、肌束结构破坏成螺旋状等。冠状动脉缺血、微循环障碍、氧化应激、异常肥厚的心肌能量需求增加均是心肌细胞过早死亡和局灶纤维化的机制[7]。有研究发现心肌疤痕是室性心律失常和心室重构及心力衰竭的基质,合并心肌纤维化常提示预后不良,且与纤维化程度呈正相关[8]。也有研究发现NOHCM患者的心肌纤维化较HOCM患者更明显,且更易发生室性心动过速(VT)/心室颤动(VF)等恶性心律失常事件,NOHCM是VT/VF的独立预测因素[9]。
RAS激活被认为在HCM的发生发展中起重要作用。HCM患者心肌醛固酮及其mRNA水平较正常人群升高4~6倍,且通过磷酸酰肌醇3激酶(PI3K)-蛋白激酶D(PKD)途径上调心肌成纤维细胞转化生长因子(TGF)-β1水平,进而促进胶原合成表达,导致心肌间质纤维化[10]。既往研究发现血管紧张素Ⅱ与血管紧张素(AT)1受体结合激活转化生长因子(TGF)-β信号通路,进而刺激胶原合成抑制胶原降解,促进心肌纤维化的发生发展[11-12]。有研究结果提示ARB类药物可抑制非肌细胞的增殖,但在抑制纤维化进展方面尚有一定争议。既往小样本的临床试验观察NOHCM患者使用氯沙坦50 mg每日1次治疗半年或1年,左心室重量(LVM)较治疗前明显减轻;治疗后左心房直径减小,氨基末端脑钠肽前体(NT-proBNP)水平降低,提示氯沙坦治疗后心肌肥厚和纤维化程度有所改善,并可能改善NOHCM的自然进展,也证实了ARB在治疗NOHCM中的有效性[13-14]。另外一项双盲、随机对照临床研究发现,在肌球蛋白重链(β-MHC)突变的HCM患者中(NOHCM占大多数),坎地沙坦滴定疗法治疗1年明显减轻左心室肥厚和左心室重量,改善左心舒缩功能、临床症状及运动耐量,且无严重不良事件和不良反应发生[15]。但也有研究与此结果不一致,Axelsson等[16]的INHERIT研究发现氯沙坦100 mg/d治疗1年并未改善HCM患者的左心室重量和心肌肥厚。因此,RAS拮抗剂能否在NOHCM的治疗中占有一席之地,预防并阻止疾病的进展,还需要临床试验进一步验证。
本研究观察分析了34例NOHCM患者,在平均2年的随访期内观察其心脏超声检查结果,发现氯沙坦治疗未能改善NOHCM患者的心脏大小、心功能、室壁厚度及流出道压力阶差。对照组患者治疗后肢体导联Ⅰ、Ⅱ、aVF导联QRS波振幅均高于治疗前,提示疾病进展,心肌纤维化或肥厚在电学上已有所加重,只是在心脏超声还未被发现,此为电学改变早于结构改变所致。但试验组患者治疗前后心电图QRS波振幅改变不大,有减小的趋势,但差异无统计学意义。提示氯沙坦治疗可以一定程度上控制甚至逆转心肌肥厚,减缓疾病的进展,但其疗效尚需进一步探讨。
试验组患者治疗前后心脏超声检查结果未观察到有统计学意义的改变,考虑可能与样本量较小、随访时间较短、氯沙坦未服用到靶剂量有关。本研究中有基因型检测报告的患者数量也较少,故未能对样本进行基因型分析,尚不能排除基因型对研究结果的影响。其次,患者未行心肌磁共振检查,因此不能精准客观评估心肌纤维化的程度。另外,该研究仅为观察性研究,而非前瞻性随机对照临床研究。因此,后期我们需要设计多中心前瞻性随机对照、大样本量的临床研究,完善心肌磁共振检查,并延长随访时间至5年甚至10年来观察药物的疗效。并可进一步行基因分型检查,分析氯沙坦等RAAS拮抗剂是否对不同基因型的NOHCM患者会有不同的疗效,以此来精准指导临床实践。

