海洋麦氏交替单胞菌共代谢降解布洛芬研究
郭 雅 丽,王 竞,顾 晨,郭 定 环
( 大连理工大学 环境学院, 辽宁 大连 116024 )
0 引 言
近年来,药品和个人护理产品(pharmaceutical and personal care products,PPCP)作为一种重要的环境优先污染物,受到越来越广泛的关注.布洛芬(ibuprofen,IBP)作为一种典型的PPCP,是目前使用最广泛的非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)之一[1].由于传统废水处理的去除效率相对较低,IBP无法完全去除并被排放入环境中[2].已有报道表明,IBP已在污水、地表水、海水甚至地下水中被检测到,浓度范围从ng·L-1至μg·L-1[3-4].毒理学研究表明,长期暴露于即使是低浓度的IBP,仍可显著影响生物体的生长和发育,并降低群落的生物多样性,对人类健康和生态系统的平衡具有潜在威胁[5-6].
在光照环境中,直接和间接(敏化)光解均可降解IBP[7].已有研究表明,溶解性有机物,尤其是富里酸是重要的光敏剂[8-9].而Matamoros等发现,在光照条件下,IBP也可以在海水中降解[10].在生物降解方面,已有研究报道白腐真菌、黏质沙雷氏菌和淡水硅藻舟形藻等从陆地及淡水环境中分离的微生物,在一定条件下也能够有效地降解IBP[11-13].有报道表明,由于IBP对颗粒的相对较高的吸附系数,能够吸附于颗粒有机碳并在湖水中以1 m·d-1的速度沉降,因而易于在沉积物中积累[14].因此IBP不仅存在于海水中,在沉积物中也被检出[15-19],这也就意味着,在海洋环境中光降解并不是IBP转化的唯一途径.因此,本研究利用从近海沉积物中分离得到的麦氏交替单胞菌GCW,考察IBP共代谢降解特性、降解过程中生理特性及胞外活性氧的变化,对研究海洋细菌对IBP的生物降解、了解IBP在海洋环境中的归趋具有重要意义.
1 材料与方法
1.1 实验材料
实验所用菌株GCW分离自大连市黑石礁近海表层沉积物,经富集培养后,反复利用稀释涂布平板划线法分离,从而得到菌株GCW,菌落呈白色,圆形,表面光滑,边缘整齐.经鉴定为麦氏交替单胞菌Alteromonasmacleodii(Genbank登录号:KY583738).
1.2 IBP降解实验
实验培养基均用人工海水配制,用20% NaOH溶液调节pH至8.0.
唯一碳源培养基:在人工海水中加入12.5 mg·L-1NH4NO3、2.5 mg·L-1K2HPO4·3H2O和250 mg·L-1IBP.
不同共代谢培养基:向人工海水中分别加入6 g/L的蛋白胨、牛肉膏和酵母浸粉.
1.3 活性物种定位及鉴别
为定位IBP降解发生在菌株胞内还是胞外,对降解活性物种进行了定域实验.将菌株培养72 h,取菌液6 000 r/min离心分离10 min,将上清液过0.22 μm有机滤膜去除细胞后作为胞外提取液.将沉淀洗涤后用浓度10 mmol·L-1的Tris-HCl缓冲液(pH=7.5)重悬,随后冰浴超声破壁5 min,15 000 r/min离心分离20 min,上清液作为胞内提取液.在无菌培养基(空白对照)、胞外和胞内提取液中分别加入1 mg·L-1的IBP,于25 ℃,150 r/min的恒温摇床中避光反应5 h.为了避免胞内活性物质在超声破碎过程中变性失活,又进行了完整细胞实验.将离心(6 000 r/min,10 min)后的沉淀用预冷无菌超纯水洗涤2次,重悬于灭菌人工海水,在相同条件下进行反应.
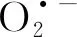
1.4 胞外活性氧及相关酶检测
(1)羟基自由基
•OH是一种典型的活性氧(reactive oxygen species,ROS),其测定采用苯甲酸高效液相色谱法[20].色谱柱为Sinochrom ODS-BP (4.6 mm×250 mm,5 μm),柱温为40 ℃.其中,流动相A为超纯水(含0.1%三氟乙酸),流动相B为乙腈,流动相A与流动相B体积比为87∶13,波长为255 nm,单个样品运行时间为20 min.•OH浓度计算方法如下式所示:
c(•OH)=c(p-HBA)×5.87
(1)
其中c(•OH)为•OH浓度,c(p-HBA)为对羟基苯甲酸浓度.
(2)超氧阴离子自由基
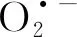
(3)过氧化氢
H2O2检测采用的是DPD/POD法[22].向2 mL 的胞外提取液中加入0.2 mL浓度为0.5 mol·L-1的磷酸盐缓冲液(pH=6),再加入37 μL 用浓度为0.05 mol·L-1的H2SO4配制的10 g·L-1DPD溶液和37 μL的1 g·L-1POD溶液,利用紫外-可见分光光度计测量吸光度,波长为551 nm,体系以不加POD为空白对照.
(4)铁载体
铁载体的检测基于铬天青(chrome azurol S,CAS)法[22].将CAS检测液与胞外提取液等体积充分混匀后放置1 h,利用紫外-可见分光光度计测定吸光度,波长为630 nm,以酵母浸粉培养基作为空白对照.
(5)L-氨基酸氧化酶
L-氨基酸氧化酶(L-amino acid oxidase,LAAO)的检测同样基于DPD/POD法[23].取1 mL 胞外提取液,加入等体积的5 g·L-1亮氨酸溶液作为底物,以不作处理的胞外提取液作对照,一同在25 ℃,150 r/min的恒温摇床中反应1 h,用DPD/POD法分别测定反应后体系的H2O2浓度,相减则为1 h内产生的H2O2.
1.5 生理特性分析
(1)生长曲线
生长曲线的测定采用比浊法,利用紫外-可见分光光度计测定菌悬液的光密度来推测菌体的浓度,测定波长为600 nm.
(2)胞外聚合物
利用碱法提取菌株经过72 h培养后的胞外聚合物(EPS).取10 mL菌液,10 000 r/min离心分离20 min,上清液即为溶解态EPS.在沉淀中加入10 mL超纯水充分混匀,加入0.06 mL浓度为36.5%的甲醛溶液,静置于4 ℃条件下反应1 h,随后向体系内加入4 mL浓度为1 mol·L-1的NaOH溶液静置于4 ℃条件下培养3 h,离心分离(10 000 r/min,4 ℃,20 min),收集上清液经0.22 μm 有机滤膜过滤后即为结合态EPS.EPS中多糖测定采用苯酚-硫酸法,蛋白质测定采用考马斯亮蓝法.
(3)胞外脱氢酶活性
脱氢酶活性(dehydrogenase activity,DHA)的检测采用氯化三苯基四氮唑-脱氢酶活性法[24].
(4)电子传递系统活性
电子传递系统活性(electron transport system activity,ETSA)的检测是基于四唑还原作用来体现耗氧值,底物是碘硝基氯化四氮唑蓝(INT)[25].
1.6 IBP分析方法
IBP的测定采用高效液相色谱法.色谱柱为Supersil ODS2(4.6 mm×250 mm,5 μm),柱温为40 ℃.其中,流动相A为含有0.02 mmol·L-1磷酸二氢钠的超纯水(用磷酸调pH=3.0±0.05),流动相B为乙腈,流动相A与流动相B的体积比为40∶60,流速为0.8 mL·min-1,在222 nm 波长下对IBP浓度进行测定.单个样品运行时间为12 min.
2 结果与讨论
2.1 IBP降解特性
首先,为了考察菌株GCW能否以IBP为唯一碳源生长,进行了唯一碳源降解实验(图1).实验发现,IBP未发生明显降解,表明在实验条件下,GCW不能够以IBP为唯一碳源生长.而IBP在自然环境中可能与各种易降解物质共存,因此,选取常见的有机质作为共代谢底物考察了IBP的共代谢降解效果(图1).实验表明,在无细胞接入和经过热失活细胞的两个不同空白对照组中,72 h 后IBP未发生明显降解(<5%).而牛肉膏和蛋白胨培养基中的3 d降解率分别为85%和69%,酵母浸粉培养基最高,为90%.因此,后续实验选择酵母浸粉作为共代谢底物.对菌株GCW好氧共代谢降解IBP进行动力学研究,实验结果如图2所示.在经历24 h的停滞期后,对24~72 h的IBP浓度基于c/c0值取对数,按一级反应动力学方程线性拟合,拟合结果符合准一级反应动力学,IBP降解速率常数为0.061 h-1,相对应的半衰期T1/2为35.4 h.
关于海洋环境中IBP生物降解目前还未见报道,本研究中的降解速率与IBP在海水中光降解的相关研究结果(0.14 h-1)也相当[10].对比淡水及陆地环境中IBP生物降解的研究,Marco-Urrea等发现白腐真菌对IBP的7 d降解率约为70%[11],Xu等分离的黏质沙雷氏菌对IBP的5 d降解率为93%[12],本研究在降解周期及降解率方面具有一定优势.
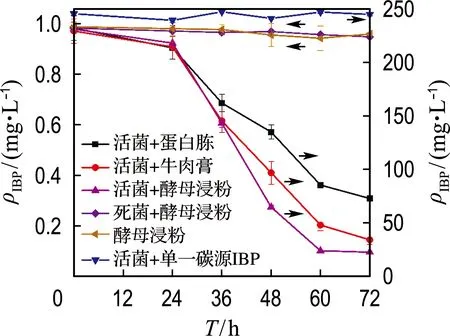
图1 不同培养基中的IBP降解曲线
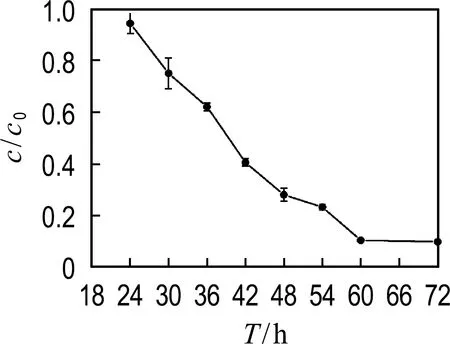
图2 IBP降解曲线
为了明确降解发生的位置,进行了降解活性物种定位实验(图3).实验结果表明,菌株GCW胞内提取液和完整细胞中的IBP均不发生降解,而胞外提取液中IBP发生明显降解,降解率达79%.因此,降解IBP的活性物质位于胞外.
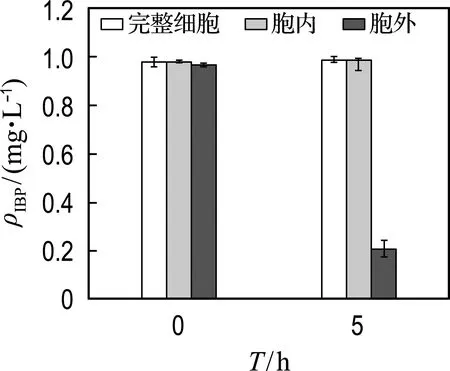
图3 GCW不同部分的IBP降解
为了分辨降解活性物质的种类,进行了活性物种淬灭实验(图4).发现煮沸抑制了97.2%的IBP降解,说明降解活性物质为热敏性物质.而蛋白酶K抑制了56.9%的降解,说明菌株GCW降解IBP为酶和非酶物质共同作用,其中酶的作用占56.9%.随后进行了ROS淬灭实验,发现SOD抑制了3.4%的降解,CAT抑制了31.2%的降解,硫脲抑制了56.8%的降解.结果表明,ROS参与了菌株GCW对IBP的降解,且H2O2和•OH起主要作用.
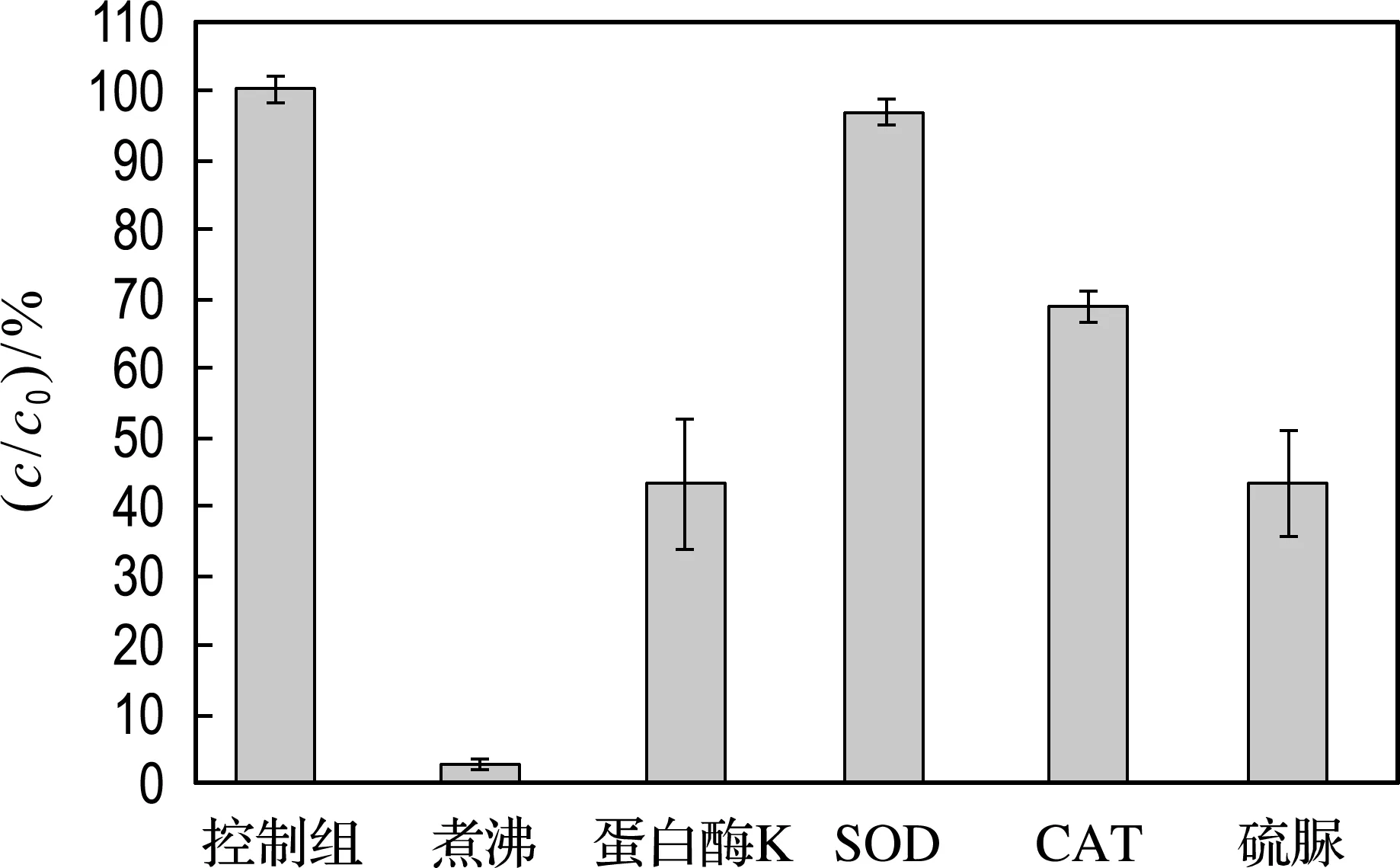
图4 淬灭实验的IBP相对降解率
2.2 降解过程中的生理特性变化
为了探究IBP对菌株GCW的影响,考察了菌株在含与不含IBP的培养基中的生长曲线、胞外聚合物、脱氢酶活性等生理特性,这些生理特性也在一定程度上反映了其降解IBP的机理.
菌株GCW在含与不含IBP体系中的生长曲线如图5所示.GCW经过6 h左右生长到达对数期,经过约36 h生长到达对数末期并进入稳定期,随后直至72 h菌量不再有明显变化.同时还可以看出,1 mg·L-1的IBP对菌株GCW的生长无显著影响.
胞外聚合物是微生物分泌于细胞外的高分子聚合物,它覆盖在微生物表面,在微生物与外部环境之间形成一个缓冲层,能够帮助细胞抵御有害物质的毒害.同时,已有报道表明Alteromonasmacleodii菌属能够产生EPS[26].经72 h培养后,IBP对菌株GCW分泌EPS的影响如图6所示.结果表明,加入IBP的实验组比对照组EPS的蛋白质含量提高了15.5%,多糖含量提高了
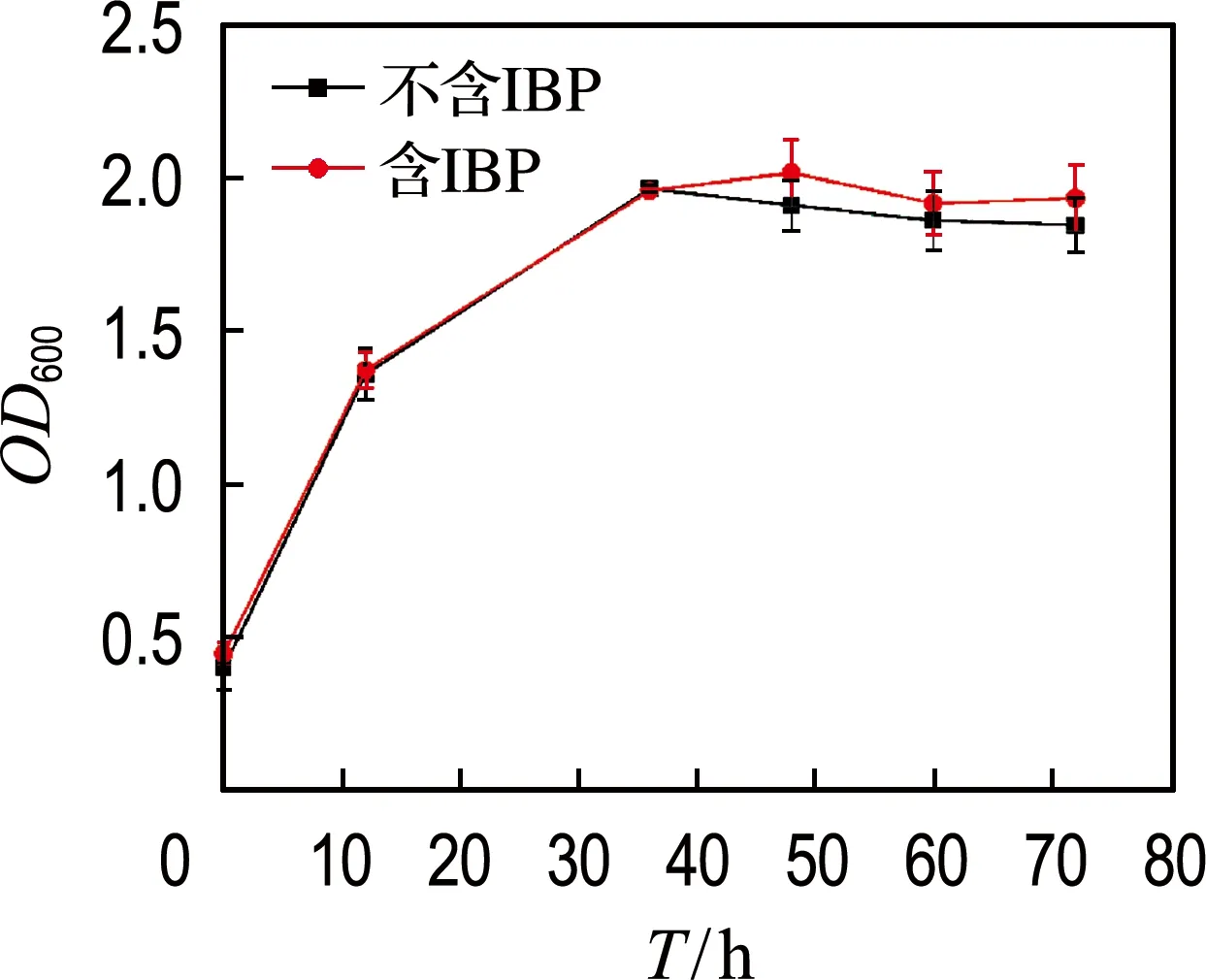
图5 含/不含IBP培养基中GCW的生长曲线
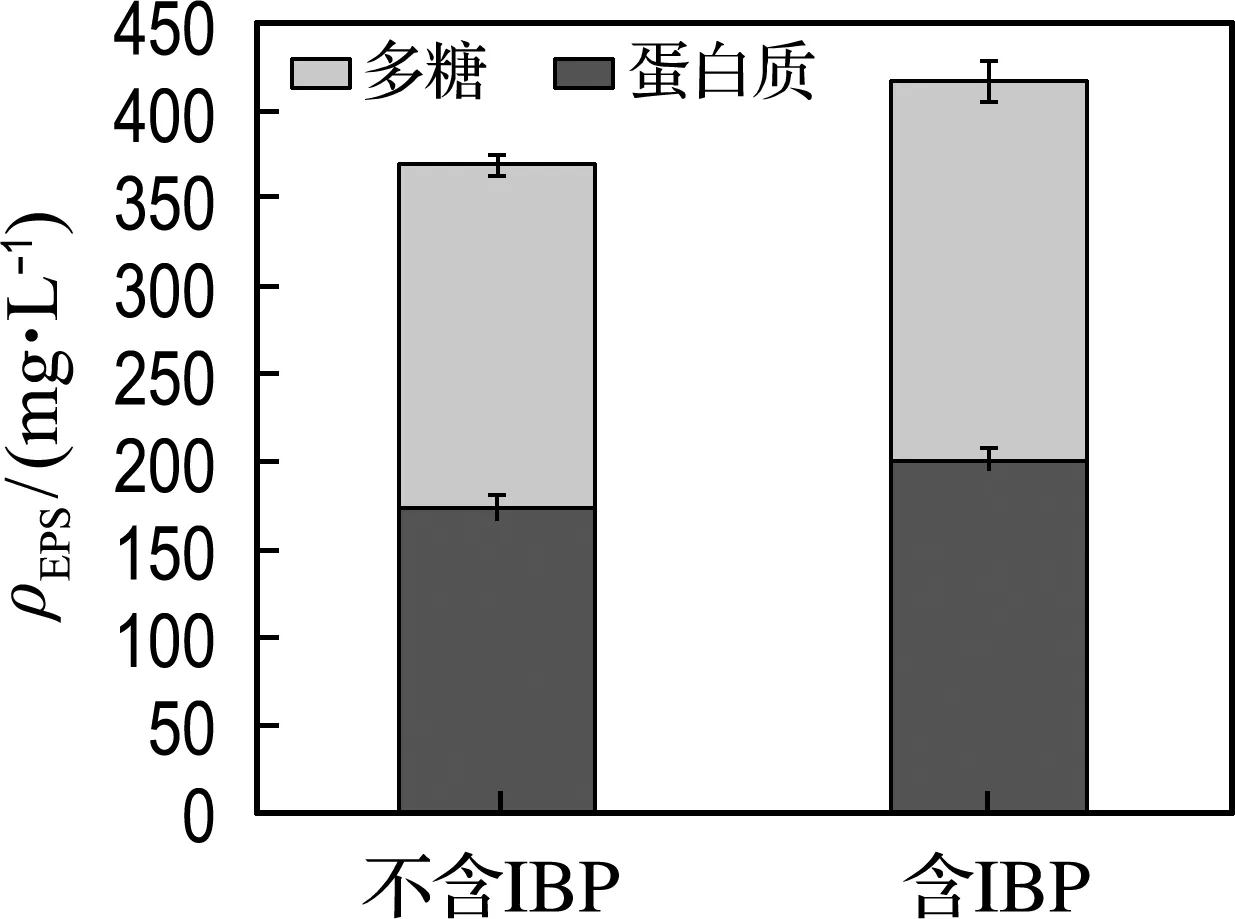
图6 IBP对EPS分泌的影响
16.7%,这一结果表明加入IBP促进了EPS的分泌,这可能是由于菌株通过分泌EPS来抵御外界环境的毒害.
脱氢酶是细菌关键的氧化还原酶之一,在细菌生长和降解污染物过程中起到重要作用.本实验测定了IBP对菌株胞外脱氢酶活性的影响,实验结果如图7所示.结果表明,含IBP实验组的DHA相对于不含IBP的对照组有显著提高,尤其是在前60 h内,提高了10.8%~35.5%.以上结果说明,IBP会刺激菌株GCW胞外脱氢酶活性,进而有利于污染物的降解.
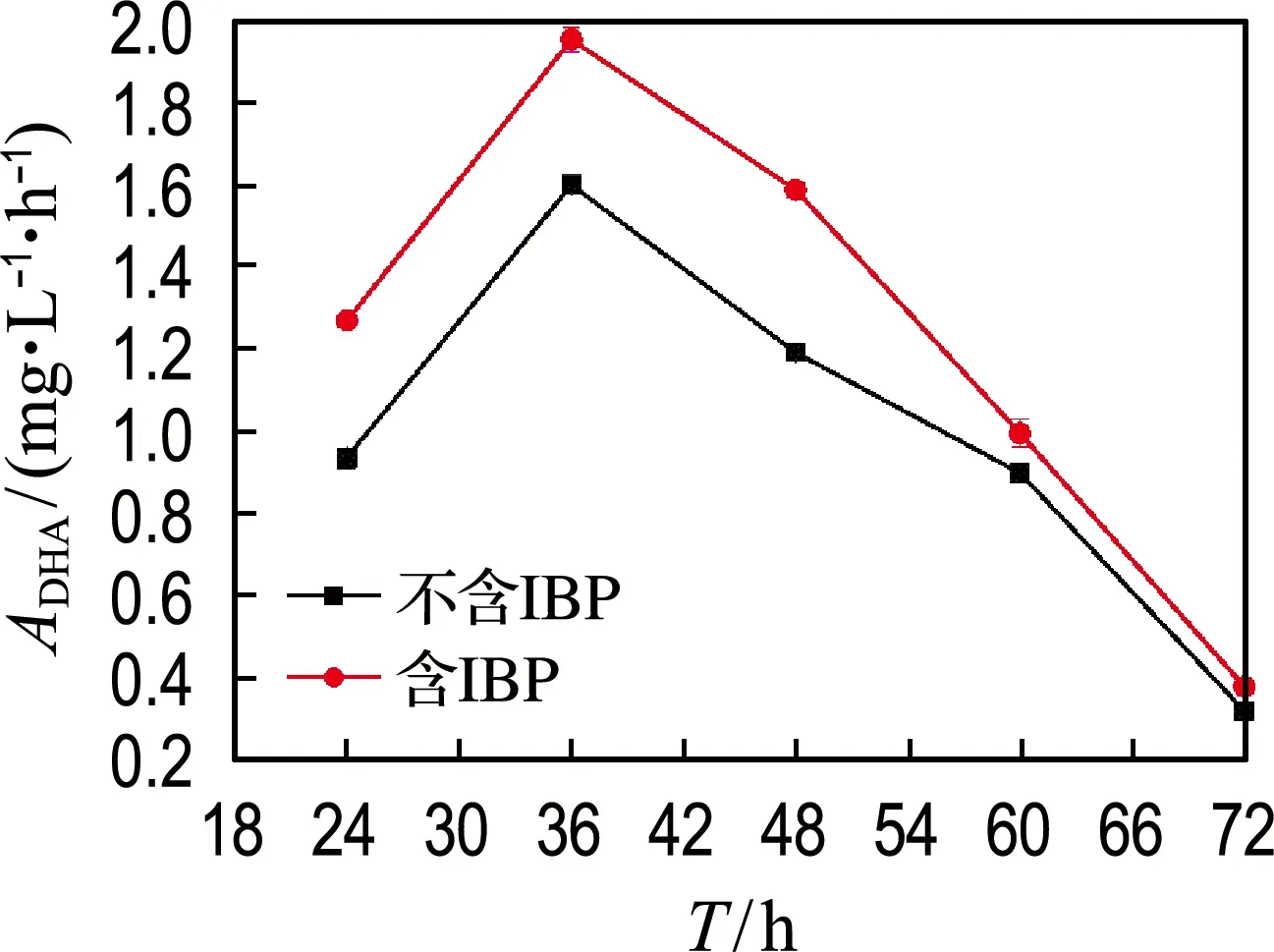
图7 IBP对胞外脱氢酶活性的影响
电子传递系统活性是检测微生物潜在代谢活性的重要生化指标之一,可作为降解能力测定的有力补充.测定其活力是测定电子传递过程中的限速步骤酶反应即CoQ-Cytb复合体的氧化活力.本实验测定了菌株胞内电子传递系统活性的变化,如图8所示.结果表明,菌株GCW在培养至36 h后ETSA最高,含IBP与不含IBP分别为1.11和0.85 μg·g-1·min-1,随后菌体的电子传递系统活性随时间呈降低趋势.菌株GCW在培养的前60 h内,含IBP实验组的ETSA相对于不含IBP的对照组有显著提高,提高了10.1%~30.7%.以上结果表明,IBP会刺激菌株GCW电子传递系统活性.
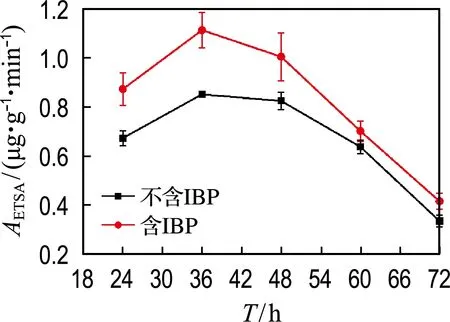
图8 IBP对电子传递系统活性的影响
2.3 ROS形成与IBP降解
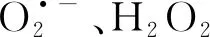
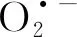
随后还测定了降解过程中H2O2浓度及IBP降解情况,如图10(a)所示.结果表明,H2O2浓度在降解过程中呈上升趋势,并在72 h结束时达到峰值,分别为0.93和1.21 μmol·L-1.同时发现在培养至指数期后期(36 h)之前,H2O2的产生几乎可以忽略不计.已有研究表明,LAAO在细胞外H2O2产生中起着至关重要的作用,广泛分布于包括细菌在内的不同生物中.Gómez等首次报道海洋细菌Marinomonasmediterranea可以合成L-赖氨酸-ε-氧化酶(lodA),该酶可以催化L-赖氨酸的氧化脱氨反应释放H2O2[30].他们进一步研究发现,lodA在生长的稳定期会分泌到细胞外环境中[31],这与本文的研究结果相一致.此外,在IBP降解过程中(24~60 h),含IBP的H2O2浓度低于不含IBP的;而通过对两组中LAAO活性检测发现,含IBP中LAAO的活性明显高于不含IBP的(图10(b)所示).这意味着含IBP的产胞外H2O2能力高于不含IBP的,进而说明含IBP的H2O2浓度下降并不是由于IBP抑制了H2O2的产生,而是降解IBP消耗了H2O2所致.这也解释了IBP降解结束后(72 h),含IBP的H2O2浓度高于不含IBP的这一现象.
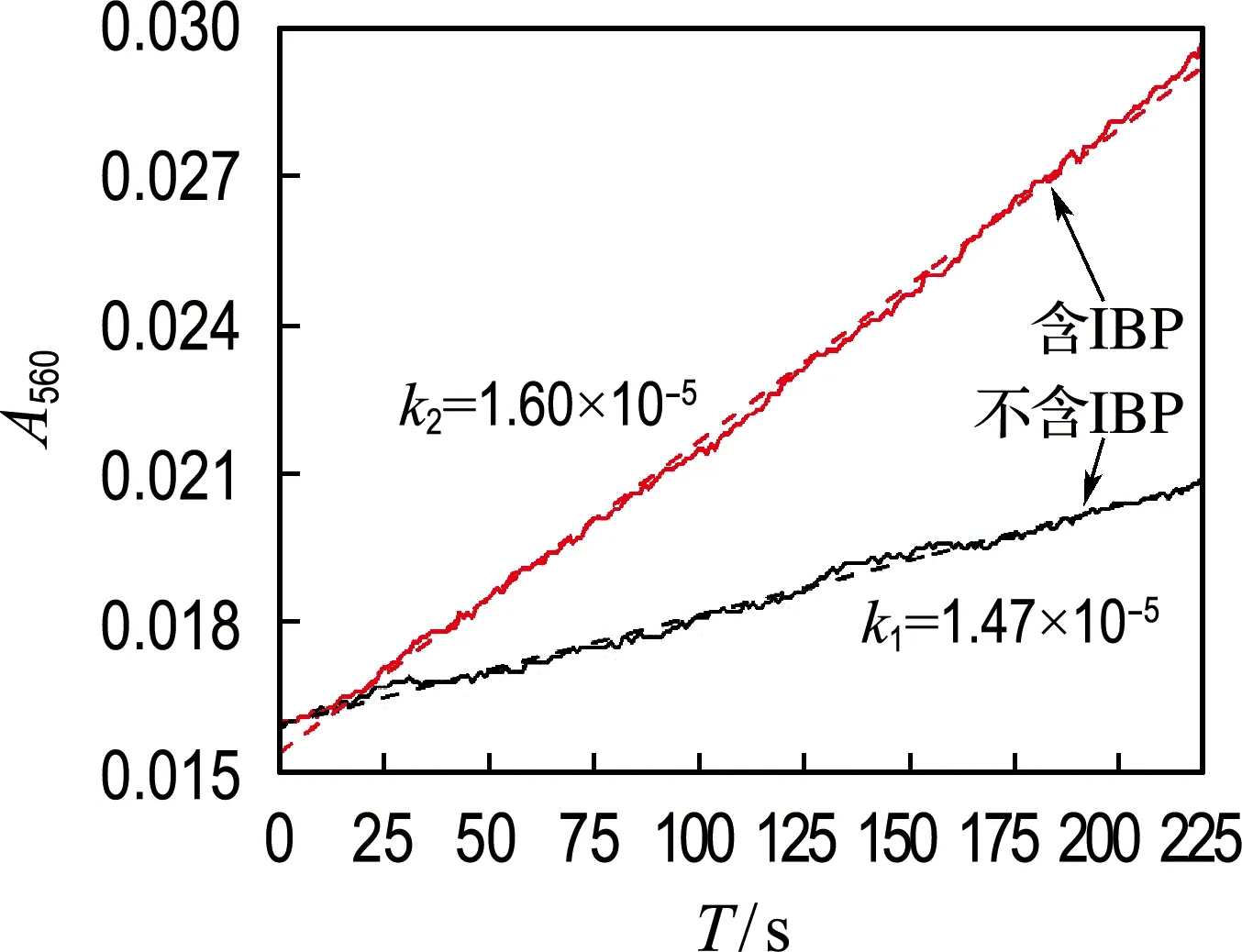
图9 IBP对NADH氧化还原酶的影响
而研究表明,H2O2本身并不能降解IBP,需要转化为其他活性物质才能起到降解作用.已有研究表明,海洋系统中有机Fe(Ⅱ)络合物可以催化H2O2发生芬顿反应产生•OH[32].在苏荣葵对UV/H2O2高级氧化技术降解布洛芬的研究中,•OH也被证明是导致IBP降解的最主要原因[33].因此,本研究测定了体系中的胞外•OH浓度和铁载体的活性.在胞外提取液中检测到•OH浓度分别为1.7和1.0 μmol·L-1,且在达到稳定期(60 h)后,浓度趋于稳定(图11(a)).同时,含IBP铁载体的活性显著高于不含IBP(图11(b)),结合H2O2的测定结果,含IBP的胞外•OH浓度应高于不含IBP的.然而含IBP的胞外•OH浓度却明显低于不含IBP的,因此这可能是由于在IBP降解中消耗了•OH,这也是IBP非酶降解的主要途径.
3 结 语
本研究首次探讨了海洋环境中IBP的生物降解,证实了麦氏交替单胞菌GCW能够共代谢降解IBP,以酵母浸粉为共基质时具有最好的降解效果,并且在降解周期及降解率方面具有一定优势.IBP的加入可以提高菌株EPS、DHA和ETSA等生理特性,并且促进与胞外ROS产生相关的NADH氧化还原酶、LAAO和铁载体的活性.GCW降解IBP发生在胞外,由酶和非酶物质共同介导.降解IBP的非酶物质主要为ROS,且•OH起最主要作用.本研究加深了对海洋环境中IBP生物降解的了解,对研究IBP在海洋环境中的归趋具有启示作用.

