Fe 负载UiO-66 协同非均相类Fenton 氧化降解废气苯的研究
张婷婷 ,周长松 ,周梦长 ,吴 昊 ,张 振 ,杨宏旻
(南京师范大学 能源与机械工程学院,江苏 南京 210023)
挥发性有机污染物(Volatile Organic Compounds,VOCs)由于排放量大、毒性高,是大气环境污染物的主要来源之一,中国已经将其列为优先控制污染物。VOCs 不仅会破坏人体健康引起畸变、癌变,还会在一定条件下与其他污染物反应形成光化学烟雾和PM2.5[1]。随着经济的快速发展,苯等VOCs 废气的排放呈逐年上升的趋势,成为当前大气污染物控制领域亟待解决的问题之一。
近年来,氧化降解法由于其经济、高效被广泛用于治理VOCs。其中,Fenton 技术因为其自身具有强氧化性的中间产物·OH,·OH 可与大多数有机物反应使其降解成CO2和H2O,实现永久脱除的目的,因而成为当前热门技术之一[2]。采用非均相类Fenton 体系可以避免均相Fenton 体系中反应溶液pH 值要求低且反应过程中容易造成二次污染的问题[3]。目前,非均相类Fenton 催化剂还仅仅局限于传统铁基催化剂,存在比表面积小、活性位点分布不均、铁元素溢出造成二次污染等问题。因此,研制新型、稳定、高效的非均相催化剂成为研究新方向。
UiO-66 是金属有机骨架材料(Metal-Organic Frameworks, MOFs 又称多孔配位聚合物)的一种,由含碳、氧等多齿有机配体与过渡金属离子自组装而成[4]。具有多种纳微尺度骨架型孔道结构、超大比表面积和孔隙率及可裁剪性[5]。在UiO-66 材料合成过程中,Zr 金属簇体与对苯二甲酸配位形成多孔骨架结构,由于存在空间阻碍等因素,引起有机配体的缺失形成缺陷位,并同时保持UiO-66 材料的骨架结构。Zr 金属簇体处于不饱和配位状态,暴露在UiO-66 材料的孔穴中,形成Lewis酸性位点,可以作为催化反应的活性中心[6]。Pan等[7]采用浸渍法制备Cu-UiO-66 催化剂协同非均相Fenton 体系降解含4-氯酚废水,研究结果显示降解效率可达98%。Gonzalez-Olmos 等[8]使用Fe-ZSM5 和Fe-Beta 作为非均相类Fenton 催化剂来降解苯酚、吡虫啉和二氯乙酸。研究对比发现,Fe-ZSM5 比Fe-Beta 具有更高的活性物质产率。李银莹[9]以Fe-MOF 作为催化剂,与H2O2形成非均相类Fenton 体系对罗丹明进行降解,研究结果显示降解效率可达90%。Sun 等[10]采用不同物质的量比的FeCl2和FeCl3为金属配体合成了一系列MOF非均相Fenton 催化剂,反应前后催化剂的结构未发生显著变化,且铁离子的溶出量较低,目前尚缺乏采用非均相Fenton 体系氧化降解挥发性有机污染物的研究报道。
本研究采用水热合成法制备了不同掺杂比例的Fe 负载UiO-66 催化剂,在自制的非均相类Fenton体系反应装置中进行对模拟废气中苯的氧化降解特性进行研究,探究温度在110、120、130、140 ℃,H2O2浓度为0.05、0.1、0.2、0.5、1.0、1.5 mol/L 对VOCs降解效率的影响。采用XRD、SEM、BET、XPS 和EPR 等测试手段对样品的理化性质进行了表征。根据实验结果和样品表征,初步阐明Fe 负载UiO-66 协同非均相类Fenton 对废气苯的脱除特性。
1 实验部分
1.1 Fe 负载UiO-66 样品制备
本研究采用水热合成法制备不同负载量的Fe/UiO-66 催化剂。具体过程如下:分别称取1.0 485 g(4.5 mmol)、0.932 g(4 mmol)、0.8155 g(3.5 mmol)、0.699 g(3 mmol)的四氯化锆(ZrCl4)对应加入0.094 g(0.5 mmol)、0.1988 g(1 mmol)、0.2982 g(1.5 mmol)、0.3976 g(2 mmol)的四水氯化亚铁(FeCl2·4H2O)溶解于150 mLN,N二甲基甲酰胺溶液(DMF)溶液中,加入0.83 g(5 mmol)对苯二甲酸(PTA),混合搅拌5 min 后超声处理20 min。将溶液放入200 mL聚四氟乙烯内衬的反应釜中密封,在120 ℃的烘箱中反应24 h 后冷却至室温。倒掉上层母液,得到产物,再向其中加入100 mL DMF,用玻璃棒充分搅拌后静置12 h。抽滤,向所得产物中加入100 mL无水乙醇并用玻璃棒充分搅拌,静置12 h 后更换DMF,如此重复,洗涤四次。抽滤,将产物置于真空干燥箱中,设定温度为120 ℃,真空干燥12 h 后得到最终产物。所制备的样品分别标记为10%Fe/UiO-66、 20%Fe/UiO-66、 30%Fe/UiO-66、 40%Fe/UiO-66。
1.2 催化剂的表征
催化剂的扫描电镜(SEM)图像采用日本日立公司S-4800 分析获得。催化剂的表面晶体结构采用德国BRUKER 公司的D8 ADVANCE X 射线衍射仪(XRD)测定,扫描5°-80°。催化剂的比表面积、孔容和孔径采用美国Micromiritcs 公司的ASAP2010 型比表面积测定仪测量。测量前,试样在250 ℃真空下排气4 h,以清洁催化剂表面。在相对压力(p/p0)为0.05-0.20 的条件下,采用BET 法获得比表面积(SBET)。在p/p0= 0.99 时估算总孔隙体积(vtotal)。催化剂的表面元素含量以及价态采用美国Thermo Fisher Scientific 公司的ESCALAB 250xi 型X 射线电子能谱分析仪(XPS)进行测定,利用Avantage 软件对催化剂表面元素的相对含量和化学价态进行分峰拟合分析。非均相类Fenton 反应过程中间体·OH 自由基通过德国Bruker X-Band A 200 型电子顺磁共振光谱仪(EPR)获得,由于·OH 自由基寿命极短且非常活泼,在反应过程中加入捕获剂5,5-二甲基-1 吡啶-N-氧化物(DMPO)优先与·OH 反应生成相对稳定的DMPO-·OH 加合物,通过检测羟基加合物来间接判断·OH 自由基的含量。
1.3 实验装置及方法
催化剂活性评价在自制的非均相类Fenton 体系装置中进行,具体见图1。氮气分成两路,一路进入苯发生装置;另一路作为平衡气体,通过混气瓶混合后进入非均相类Fenton 反应体系,通过调节两路氮气流量和苯发生器的温度可以获得稳定的挥发性有机污染物质量浓度。非均相类Fenton 反应体系主要由加热带、内径为20 mm 的圆柱形石英反应管和填充的催化剂构成。用便携式氢离子火焰检测仪(FID)测定反应前后苯含量变化以定量评估催化剂对苯的催化氧化性能。
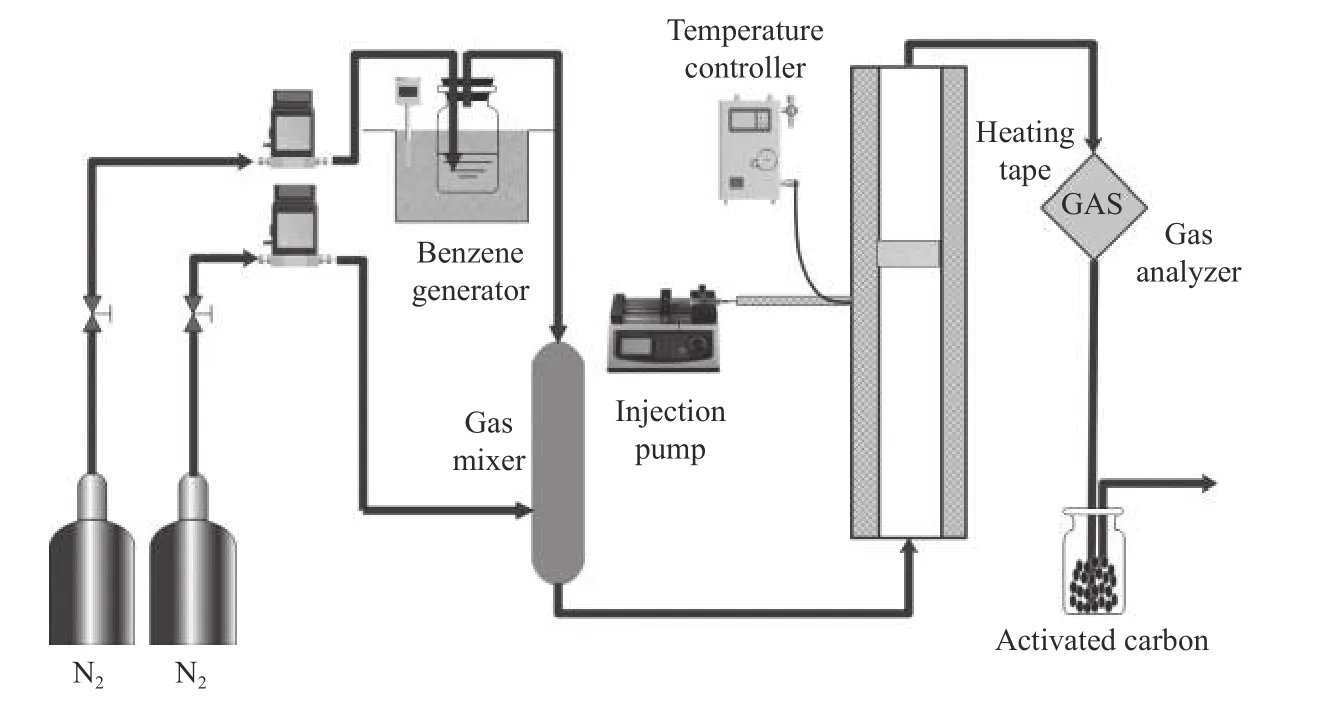
图1 实验装置流程示意图Figure 1 Schematic diagram of the experimental apparatus
催化剂的活性以苯的转化率表示,苯的转化率定义为反应器进出口处苯质量浓度差与进口处苯质量浓度的比率,具体计算公式如下:

式中,η为苯的脱除率,%;Cin为非均相类Fenton反应器进口处苯质量浓度,mg/m3;Cout为非均相类Fenton 反应器出口处苯浓度,mg/m3。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD 分析
采用水热合成法制备Fe/UiO-66,所制备的样品分别标记为10%Fe/UiO-66、20%Fe/UiO-66、30%Fe/UiO-66、40%Fe/UiO-66。对所制备的样品进行X 射线衍射分析,结果见图2。所有制备的Fe/UiO-66 XRD 谱图与UiO-66 的标准谱图基本一致,在7.2°和8.3°处有两个较强的衍射峰,为UiO-66 的特征衍射峰,与文献报道到一致[11]。
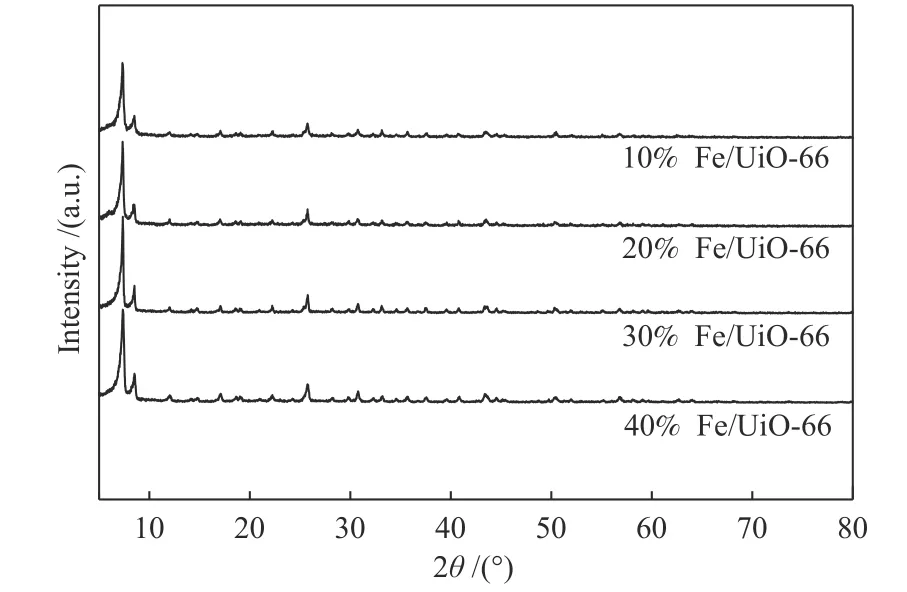
图2 不同Fe 负载量的Fe/UiO-66 催化剂的XRD 谱图Figure 2 XRD patterns of the Fe/UiO-66 catalysts with different Fe loadings
随着Fe 负载量的增加与UiO-66 的XRD 衍射谱图没有显著差异,说明在合成过程中,UiO-66 的晶体结构没有遭到破坏。随着Fe/Zr 比的增加,催化剂的峰值强度也增加,结晶度增强[12]。所有样品的XRD 谱图中很难观察到与氧化铁相关的峰,说明在UiO-66 上Fe 可能处于高度分散的状态或者粒度小,这对提高催化剂参与氧化反应的活性是有利的[13,14]。
2.1.2 SEM 分析
图3 为不同Fe 负载量的Fe/UiO-66 的SEM 照片。由图3 可知,Fe/UiO-66 催化剂为不规则的球状。随着Fe 掺杂量的增大,Fe/UiO-66 催化剂表面微粒尺寸逐渐减小,球状越来越明显。当Fe 掺杂量达到30%时,Fe/UiO-66 表面呈现出大小统一且分散的球状;进一步加大掺杂量至40%,Fe/UiO-66 微粒形状更为统一且出现明显团聚现象。

图3 不同Fe 负载量的Fe/UiO-66 催化剂的SEM 照片Figure 3 SEM images of the Fe/UiO-66 catalysts with different Fe loadings
2.1.3 BET 分析
催化剂的比表面积及孔性质对其催化活性至关重要。表1 为四种催化剂样品的BET 测试结果。由表1 可知,随着Fe 负载量的增多,合成的Fe/UiO-66 催化剂的比表面积和孔体积均发生了一定的变化。其中,30% Fe/UiO-66 催化剂样品具有最大的比表面积,也就意味着其表面拥有的活性物质相对越多,从而在非均相类Fenton 反应体系中与H2O2分子接触产生的·OH 自由基更多,可以明显提高催化效率。
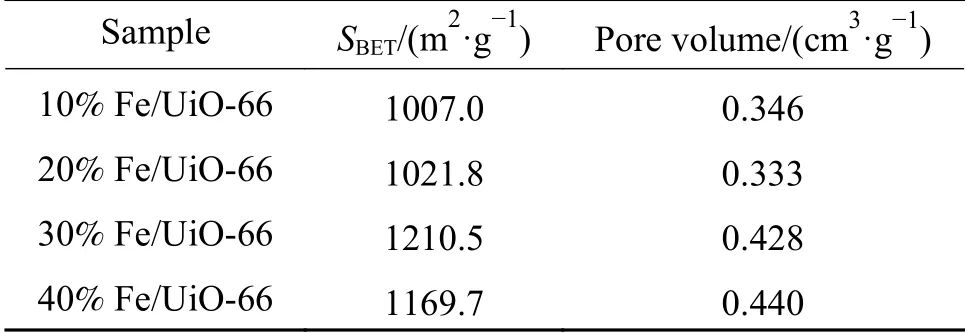
表1 催化剂的比表面积及孔容Table 1 Surface area and pore volume of the catalysts with different Fe loadings
2.1.4 XPS 分析
通过XPS 测量进一步探讨20%Fe/UiO-66、30%Fe/UiO-66 及40%Fe/UiO-66 催化剂表面的化学状态,结果见图4。图4(a)为催化剂样品的全谱图,图4(a)中可见随着铁含量的增加Fe 2p光谱强度增强。Fe 2p的XPS 谱图(图4(b))中结合能在711.7 及725.3 eV 附近的峰分别对应Fe 2p3/2和Fe 2p1/2的 特 征 峰[15]。20%Fe/UiO-66 样 品Fe 2p分 峰 结 果中,有两个较为明显的峰为708.5、713.4 eV 的峰分别对应于Fe-C、Fe3+[16]。30%Fe/UiO-66 样品Fe 2p分峰结果中,710.9 和724.5 eV 的峰分别对应于Fe2+,而713.5 和728.2 eV 的峰对应于Fe3+[17]。40%Fe/UiO-66 样品Fe 2p分峰结果中,710.1 和723.6 eV的峰对应于Fe2+[18],而711.7、725.3 和728.2 eV 对应于Fe3+[19]。随着Fe 负载量的增加,Fe2+的相对含量增加,Fe3+的相对含量减少。O 1s的XPS 谱图(图4(c))中结合能531.19、530.96 和531.8 eV 的峰对应于-OH,Fe-O 和M-OH[20]。
2.2 非均相类Fenton 氧化降解VOCs 实验分析
2.2.1 Fe 负载量对非均相类Fenton 氧化降解废气苯的性能影响
本研究考察了水热合成法制备的催化剂样品中Fe 负载量对催化活性的影响,图5 为Fe/UiO-66催化剂样品协同非均相类Fenton 氧化降解苯反应的活性评价结果。
图5 为不同负载量的Fe/UiO-66 协同非均相类Fenton 对苯的氧化脱除效率。由图5 可知,10%Fe/UiO-66 催化剂样品对苯的脱除效率较低,可能由于Fe 负载量较低时,催化活性中心的数目较少。当Fe 负载量增大后,苯的氧化降解效率明显提高,当掺杂比例为30%时,反应体系对苯的脱除效率可高达93%。随着Fe 负载量进一步加大,苯的氧化降解效率降低,这是因为,一方面40% Fe/UiO-66 催化剂样品由于Fe 负载量的增多导致比表面积减小,从而使表面绝对活性物质减少,从SEM 分析可见,40% Fe/UiO-66 出现明显团聚与UiO-66 的相互作用减弱。同时,随着Fe 负载量的增加,Fe2+/Fe3+增大,过量的Fe2+会消耗非均相类Fenton 体系中生成的·OH 自由基(式(2))[21]。催化剂活性与表面物化结构和元素组成有非常密切的关系,非均相类Fenton 对VOCs 的氧化脱除效率主要决定于·OH 的产量。XPS 表征也发现催化剂表面有Fe2+/Fe3+的氧化还原对,这促进了·OH 自由基的产生[22]。
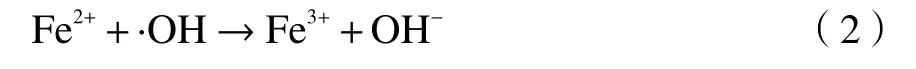
2.2.2 H2O2 浓度对VOCs 氧化降解性能的影响
非均相类Fenton 体系的脱出效率主要取决于·OH 自由基的产率,而·OH 自由基主要来源于H2O2分子,因此,H2O2的浓度对苯的氧化脱除效率起决定性作用。图6 为四种催化剂在不同H2O2浓度下非均相类Fenton 氧化脱除苯的效率。由图6 可知,当分别添加0.05、0.1 和0.2 mol/L 的H2O2后,四种催化剂样品对苯的氧化降解效率均有一定的提高,这是由于有更多的H2O2分子与Fe2+反应,从而产生更多的·OH 自由基,与Xin 等[23]探究CuFeO2非均相降解四环素中H2O2的影响研究结果一致。对于10%Fe/UiO-66 及30%Fe/UiO-66催化剂,当H2O2浓度由0.1 mol 增至1.0 mol/L 时,效率出现缓慢的提高,继续增加H2O2浓度,苯的脱除效率不再提高。对于20% Fe/UiO-66 及40%Fe/UiO-66 催化剂,当H2O2浓度由0.1 mol/L 增至1.5 mol/L 时, 效 率 未 出 现 明 显 提 高, 表 明30%Fe/UiO-66 表面活性位点较多,由40% Fe/UIO-66 SEM 照片可知,催化剂表面微粒较小且分布致密,且BET 结果显示比表面积减小,活性位点的绝对数量较为有限,当H2O2浓度增加到一定数值时,催化剂表面的活性位点与H2O2达到反应相对饱和状态,因此,继续增大H2O2浓度,苯的脱除效率不再提高。另一方面,当溶液中的H2O2浓度过高时,很容易发生式(3)副反应消耗一部分的·OH 自由基,产生氧化能力较弱的·OOH 自由基[24],或者可能生成低氧化性且不具备反应能力的·HO2(式(4)、(5))。因而过高的H2O2浓度不利于苯的氧化脱除。
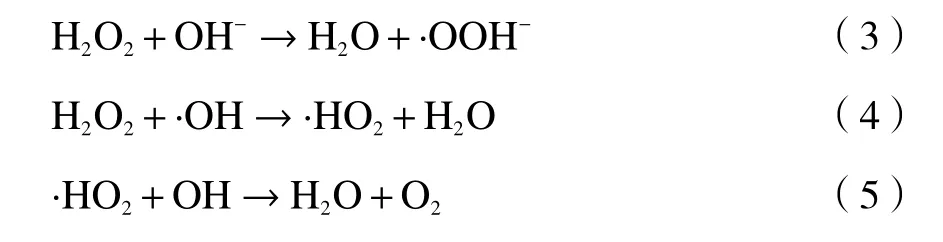
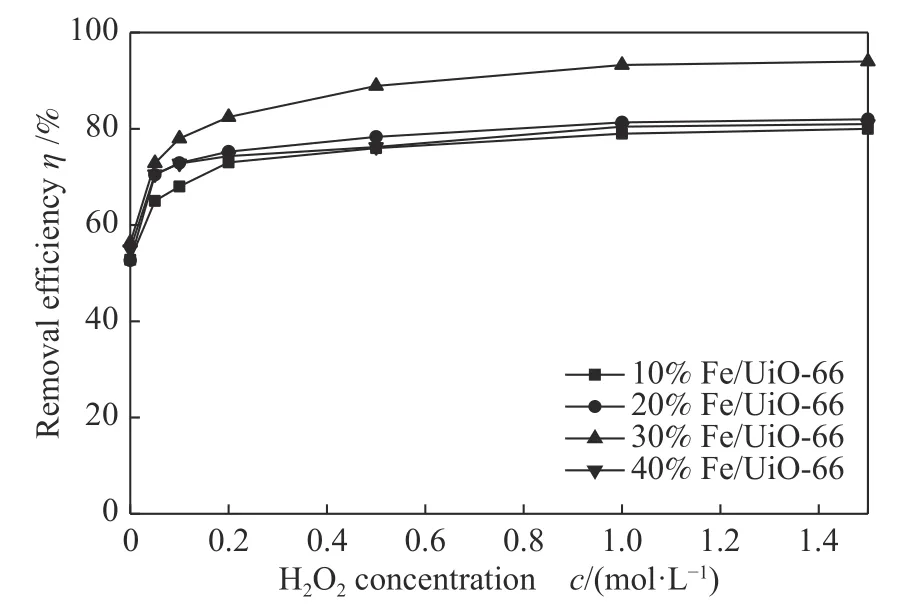
图6 H2O2 浓度对不同Fe 掺杂量Fe/UiO-66催化剂氧化降解苯的影响Figure 6 Effect of H2O2 concentration on benzene removal by four Fe/UiO-66 catalysts with different Fe loadings (reaction conditions: the initial concentration is 600 mg/m3,temperature is 130 ℃)
2.2.3 空塔速率的影响
研究空塔速率对非均相类Fenton 氧化降解苯效率的影响,可以得出在实验条件下,非均相类Fenton 氧化降解VOCs 最经济高效的条件。由图7可知,空塔速率分别为25、12、8 W /h 时,随着空塔速率增大,非均相类Fenton 氧化降解苯的效率略有提高。在一定范围内,随着催化剂用量的增加,参与非均相类Fenton 反应体系中的Fe2+和Fe3+的浓度增大,产生的·OH 自由基浓度越高,氧化降解苯的效率随之提高,当催化剂用量到达一定数值时,非均相类Fenton 氧化降解苯反应达到饱和,催化剂的促进作用不再增强。
2.2.4 反应温度的影响
反应温度对非均相类Fenton 氧化降解苯效率具有较大的影响,本研究考察了在110-140 ℃温度下30% Fe/UiO-66 催化剂协同非均相类Fenton氧化降解苯的效率。结果见图8,当反应温度为110 ℃时,苯的氧化降解效率为68%左右;随着反应温度提高至130 ℃时,苯的氧化降解效率升高至81%左右。反应随着温度的升高,分子的无规则运动加快,使得H2O2分子与催化剂表面的活性组分反应加快,·OH 自由基产率加快,从而提高了化学反应的速率。当温度进一步提高,苯的氧化降解效率降低,这是由于·OH 自由基非常活泼,在高温下会发生自消耗反应(式(6))[25],·OH 自由基来不及与废气苯发生反应。另一方面,在较高的温度下,H2O2性质不稳定,容易发生自分解反应生成水和氧气。


图7 空塔速率对30% Fe/UiO-66 非均相类Fenton氧化降解苯的影响Figure 7 Effect of superficial velocity on benzene removal by 30% Fe/UiO-66 heterogeneous Fenton reaction (reaction conditions: the initial concentration is 600 mg/m3, temperature is 130 ℃, H2O2 concentration is 1 mol/L)
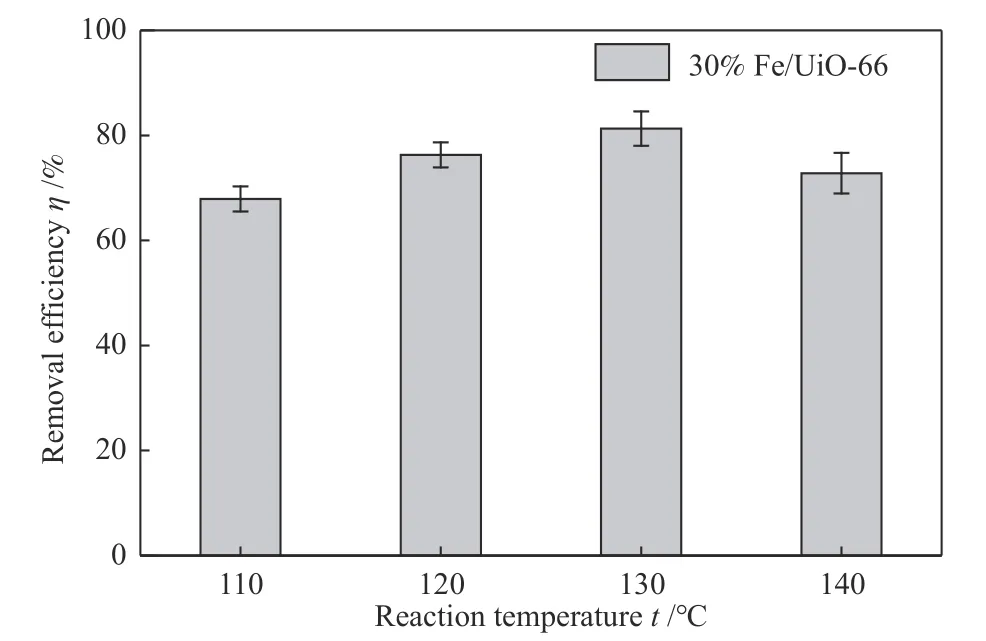
图8 反应温度对30% Fe/UiO-66 非均相Fenton氧化降解苯的影响Figure 8 Effect of reaction temperature on benzene removal by 30% Fe/UiO-66 heterogeneous Fenton reaction(reaction conditions: the initial concentration is 600 mg/m3,the concentration of H2O2 is 1 mol/L)
2.2.5 反应机理
为了探究Fe 负载UiO-66/H2O2体系中的催化机理,本研究通过电子顺磁共振技术(EPR)测试非均相类Fenton 体系在反应过程中的主要活性物质。图9 为四种催化剂的非均相类Fenton 反应的EPR 波谱强度。
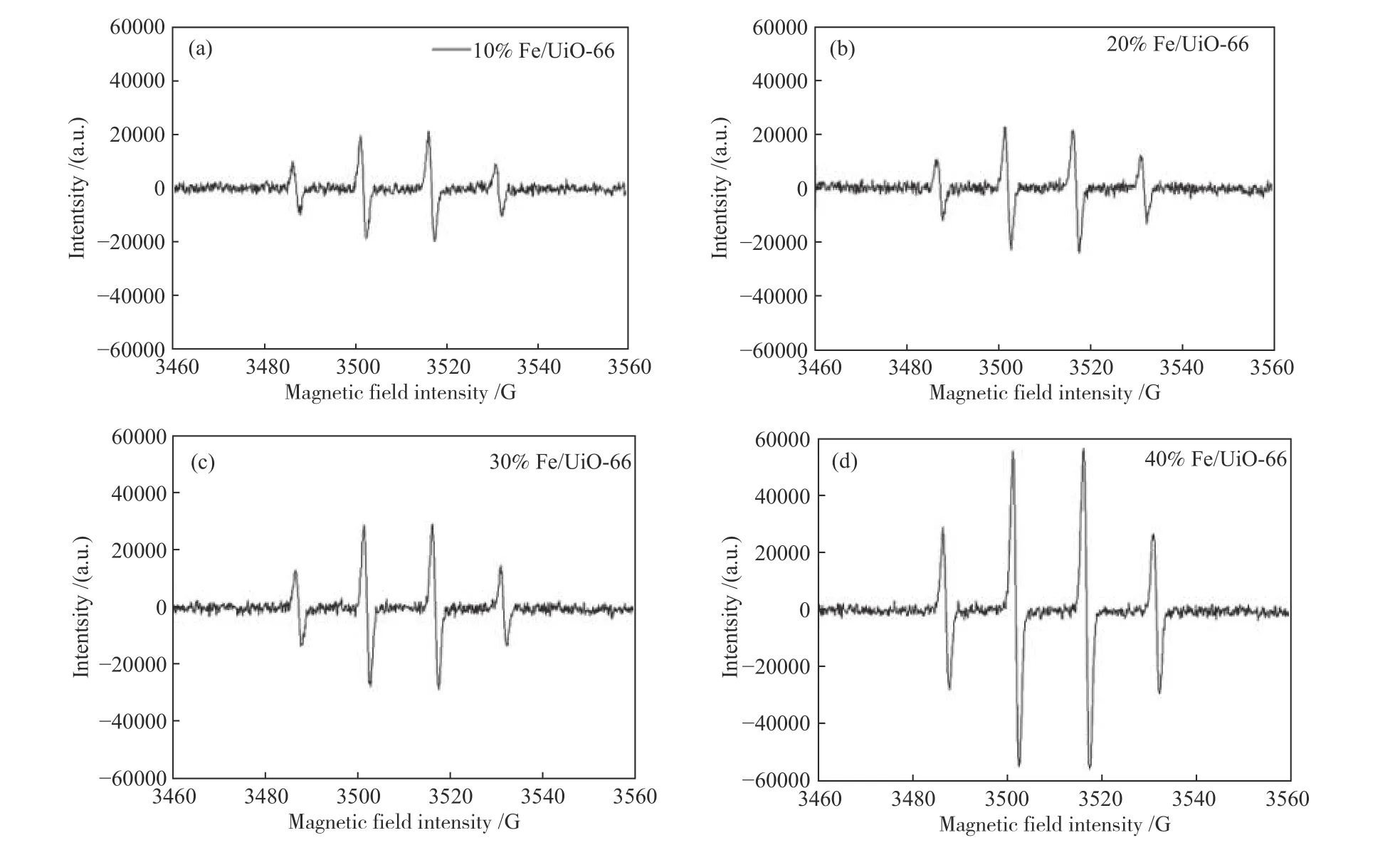
图9 10% Fe/UiO-66、20% Fe/UiO-66、30% Fe/UiO-66 和40% Fe/UiO-66 类Fenton 反应过程的EPR 波谱强度Figure 9 EPR spectrum intensity of 10% Fe/UiO-66, 20% Fe/UiO-66, 30% Fe/UiO-66 and 40% Fe/Ui O-66 Fenton reaction processes reaction conditions: H2O2 concentration is 1 mol/L, DMPO concentration is 5 mmol/L and reaction measurement time is 15 min
由图9 可知,在四种催化剂样品的EPR 波谱中1∶2∶2∶1(超精细耦合系数αN=αH= 15G)的信号峰最强,并且未检测到其他杂化峰,表明在反应过程中有·OH 自由基的产生且浓度大于其他自由基[26]。且随着Fe 负载量的增加,10% Fe/UiO-66 的EPR 波谱中DMPO-·OH 加合物的信号强度最弱,40% Fe/UiO-66 的EPR 波 谱 中DMPO-·OH 加 合 物的信号强度最强,即随着Fe 负载量的增加,·OH 自由基的信号峰越来越明显,·OH 自由基的产率越大。
综合XPS 分析,本研究推测了在Fe 负载UiO-66/H2O2体系中对废气苯的降解机理。·OH 自由基是氧化降解苯的关键,催化剂表面的Fe2+/Fe3+的氧化还原对可以促进·OH 自由基的产生(式(7)-(11)),从而提高Fe/UiO-66 协同非均相类Fenton 氧化降解苯的性能。

2.2.6 Fe/UiO-66 催化剂的稳定性
为了进一步了解Fe/UiO-66 催化剂的稳定性,本研究选取催化活性最高的30%Fe/UiO-66 催化剂在苯初始浓度为600 mg/m3,温度为130 ℃,H2O2浓度为1 mol/L 连续实验10 h 的稳定性,结果见图10。催化剂在经过10 h 实验过程中,催化效率未出现明显下降,仍然保持在90%以上,表明Fe/UiO-66 非均相类Fenton 反应降解废气中苯具有良好的稳定性。

图10 30% Fe/UiO-66 催化剂的稳定性Figure 10 Stability test of the 30% Fe/UiO-66 catalyst
3 结 论
10% Fe/UiO-66、20% Fe/UiO-66、30% Fe/UiO-66、40% Fe/UiO-66 均具有较高的结晶度,一部分负载Fe 在不破坏UiO-66 结构的情况下取代Zr 的位置,以无定形的形式存在或者在UiO-66 上处于高度分散的状态。催化剂表面同时存在Fe2+/Fe3+。
30%Fe/UiO-66 协同非均相类Fenton 氧化降解苯的效率最高;·OH 自由基的产率增大促进非均相类Fenton 氧化降解废气苯;催化剂表面的Fe2+/Fe3+氧化还原对促进·OH 自由基的产生,但过高的·OH 自由基产率会发生·OH 自消耗。
高温下,H2O2分解过快而导致·OH 发生自消耗反应;低空塔速率对非均相类Fenton 氧化降解废气苯的效率提升有限。

