D-甘露醇标准样品的研制
晋文慧,陈伟珠,张怡评,方华,洪专,蒋声铸,巢志茂(. 自然资源部第三海洋研究所,自然资源部海洋生物资源开发利用工程技术创新中心,福建 厦门 36005;2. 厦门塔斯曼生物工程有限公司,福建 厦门 3602;3. 中国中医科学院中药研究所,北京 00700)
D-甘露醇(D-mannitol)为单糖,六元醇,为白色或无色结晶性粉末,无臭,具有清凉甜味,微涩,甜度约为蔗糖的70%,是海带中重要的生物活性物质[1-7]。研究表明,甘露醇在体内不被代谢,具有脱水、利尿、降颅内压及眼内压的作用,可治疗颅内高压和青光眼[8-15]。临床主要用于颅内压增高症的急救用药,还用于肠道准备,脱水效果迅速、可靠、反跳小,并且具有镇咳、平喘等作用。甘露醇毒副作用小,溶液性质稳定,不参与体内代谢,治疗眼部炎症时不改变其通透性,是高渗脱水剂中的首选药。甘露醇一般容易耐受,很快经肾脏排泄,可用于糖尿病患者。
甘露醇在食品、医药、化工等行业中,具有广阔的应用前景,常作为相关产品质量控制的重要指标性成分。目前市场上含D-甘露醇的产品及药品均需要以D-甘露醇作为检测标准,但目前,我国尚未研制出D-甘露醇国家标准样品,相关企业、检测机构、科研院所和医院基本采用的是进口高纯试剂,价格昂贵,且纯度参差不齐,没有进行过定值试验,也没有不确定度的数据评价,准确性、可比性、可溯源性均不能保证[16-18]。由于国内市场需求较大,因此,迫切需要开展D-甘露醇物质标准样品的研发。本研究以海带为原料,通过提取、浓缩、低温析晶、反复重结晶、去除残余溶剂等制备和纯化过程,获得高纯D-甘露醇单体,按现行国家标准GB/T 15000.3-2008《标准样品工作导则(3)标准样品:定值的一般原则和统计方法》[19]要求,系统开展了标准样品的研制工作,以提供获得国家标准样品证书的D-甘露醇国家标准样品。
1 材料
1.1 仪器
400 MHz 型核磁共振波谱仪(德国Bruker 公司);LTQ Orbitrap Velos pro 质谱仪(美国Thermo公司);Vario EL cube 元素分析仪(德国Elementar公司);VERTEX 70 红外光谱仪(德国Bruker 公司);电感耦合等离子体质谱仪iCAP 7200(美国Thermo 公司);Waters 高效液相色谱仪(e2695型),配蒸发光散射检测器和工作站(美国Waters公司);AL104 电子天平(瑞士Mettoler Toledo 公司);SXJQ-120 型搅拌器、R-1001-VN 型旋转蒸发器、MPC201Tp 型隔膜真空泵、DLSB-10/20 型低温冷却循环泵(郑州长城科工贸有限公司);马弗炉SX2-4-10G(苏州江东精密仪器有限公司)。
1.2 试药
乙醇(分析纯,国药集团化学试剂有限公司);实验室用水为重蒸水,乙腈(色谱纯,德国Merck 公司);干燥的海带(厦门农贸市场,产自漳州,由福建中医药大学黄鸣清教授鉴定为海带Laminaria japonicaAresch 的叶状体,样品保存于自然资源部第三海洋研究所实验室)。
2 方法与结果
2.1 样品的制备
2.1.1 D-甘露醇粗提物的制备 称取海带干粉2 kg 放入反应釜中,加入90%乙醇80 L,在80℃加热条件下,浸提1 h,上述操作重复3 次,合并提取液,在旋转蒸发仪上减压浓缩,并进行低温析晶,即得D-甘露醇粗提物。
2.1.2 D-甘露醇纯化精制 将D-甘露醇粗提物加0.9 倍的水溶解后,加热使其溶解,保持沸腾5 min 左右,放冷结晶。不断搅拌,防止结块,离心分离,得第一次重结晶物。加1.0 倍量的蒸馏水,0.1 倍量的活性炭,加热使其溶解保持0.5 h,在90 ℃左右减压过滤得滤液,冷却结晶、离心,得结晶物。将此结晶物分别加0.7 倍、0.5 倍的水进行重结晶,方法同上。
将上述D-甘露醇用0.1 倍量以上的95%乙醇进行醇洗,离心甩干,最终获得并收集白色高纯晶体,经鉴定为D-甘露醇。
2.2 结构鉴定
2.2.1 元素分析 分子式为C6H14O6,理论值计算,按照C 原子12.0000,H 原子1.0078,理论值C [%] 39.54、H [%] 7.75,实际测定平均值C [%]39.63、H [%] 7.83。测定值与理论值相符。
2.2.2 旋光性分析 称取甘露醇样品,置于25 mL量瓶中,加入8 mL 钼酸铵溶液(0.1 g·mL-1),再加入4 mL 硫酸溶液(0.5 mol·L-1),加水稀释至刻度,摇匀,在25℃下测定。测得其比旋度[α]25D=137.80,与数据库中D-甘露醇的比旋度[α]25D=137 ~145 一致,证明立体构型是D 型。
2.2.3 红外光谱 通过KBr 压片法测定红外光谱。从结果可知,3400 cm-1为-OH 的伸缩振动,1421 cm-1为-CH2的变形振动,1289 cm-1为-CH2OH基团中-OH 的变形振动,1082 cm-1为-CHOH 基团中-OH 的变形振动,1018 cm-1为-CHOH 基团中C-O 的伸缩振动,630 cm-1为形成氢键的OH产生的变性振动。样品的红外光谱数据说明结构中存在-CH2、-OH、-CH2OH、-CHOH 等基团。
2.2.4 高分辨质谱 采用APCI 电离源(正离子模式),高分辨质谱测得的准分子离子峰m/z=205.0689 [M +Na]+,与对应的精确分子量205.0684(分子式C6H14O6)相符。
2.2.5 核磁共振波谱 以D2O 为溶剂,测定1H、13C、HSQC 的核磁共振数据,并对其进行归属。13C NMR 显示3 个碳原子峰,位于δ63.14、69.15和70.72。通过HSQC 可以认为,δ63.14 的碳原子对应1H NMR 的δ3.74 (dd,J=11.6,2.4 Hz,2H)和3.54 (dd,J=11.6,6.0 Hz,2H)的4 个质子,应为1、6 位的2 个CH2,它们具有同样的碳原子的化学位移,但是质子的耦合常数具有差异,说明1 位和6 位的质子各自相邻的2 和5 位的CH 质子具有不等的立体环境。δ3.64 (ddd,J=8.8,6.0,2.0 Hz,2H)既具有与J=2.0 和6.0 Hz 耦合常数的1、6 位质子产生耦合,也有与3、4 位质子产生的耦合(J=8.8 Hz),为2、5 位的2 个质子峰。δ3.67 (d,J=8.8 Hz,2H)峰具有与2、5 位质子的耦合。通过HSQC 的对应关系得知,1、6 位CH2质子对应的碳原子为δ63.14,2、5 位CH 质子对应的碳原子为δ70.72,3、4位CH 质子对应的碳原子位于δ69.15。D-甘露醇核磁共振数据的解析结果与文献[20]报道完全一致(见图1)。
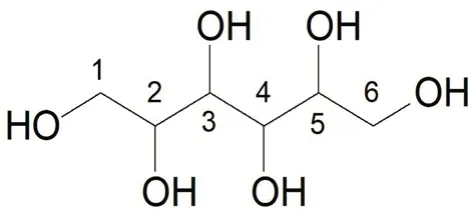
图1 D-甘露醇结构式Fig 1 Structure of D-mannitol
2.3 D-甘露醇的纯度分析
2.3.1 高效液相色谱蒸发光散射法 NH2柱(4.6 mm×250 mm,5 μm)(Thermo Hypersil GOLD Amino),流动相:乙腈-水(70∶30,V/V),流速:1 mL·min-1;漂移管温度:65℃,增益:50,气体压力:40 psi,进样量:10 μL。精密称取D-甘露醇1 mg,加1 mL 甲醇溶解,过0.22 μm 微孔滤膜,即得1 mg·mL-1的样品溶液。采用峰面积归一化法对D-甘露醇进行纯度分析。该样品除溶剂峰外,无明显杂质峰出现,见图2。
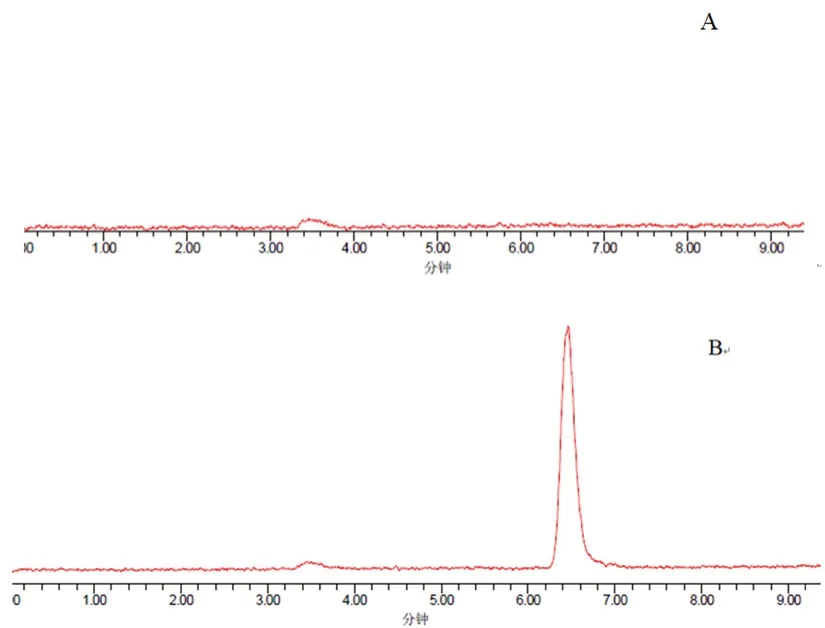
图2 D-甘露醇的高效液相色谱图Fig 2 HPLC chromatogram of D-mannitol
2.3.2 离子色谱法 色谱柱:CarboPac PA10 (250 mm×4.0 mm,5 μm)(Thermo),流动相:H2ONaOH (250 mmol·L-1)(84∶16,V/V),流速:0.80 mL·min-1,柱温:30℃。精密称取D-甘露醇1 mg 置10 mL 量瓶中,加去离子水溶解并稀释至刻度,过0.22 μm 微孔滤膜,即得1 mg·mL-1的样品溶液。采用离子色谱法对D-甘露醇进行纯度分析。该样品除溶剂峰外,仅单一洗脱峰,无明显杂质峰出现,见图3。

图3 D-甘露醇的离子色谱图Fig 3 Ion chromatography of D-mannitol
2.3.3 溶剂残留的测定 按照《中国药典》2020年版第四部[21]的方法,对D-甘露醇的残留溶剂进行检测,精确称取D-甘露醇样品约1.8 g,平行称量样品6 份,用水加热溶解到10 mL 顶空瓶中,采用气相色谱法测定,外标曲线法进行定量分析,以水为空白基质,平行测定6 次,均未检测到甲醇、乙醇等提取过程中接触的有机溶剂的残留。
2.3.4 水分残留的测定 采用卡尔费休法(Metrohm AG)进行6 次平行测定,结果水分残留率为0.049%、0.050%、0.051%、0.049%、0.050%、0.051%,平均值为0.050%,RSD为0.018%。
2.3.5 灰分测定 通过高温灼烧法,测得其灰分小于0.01%;通过质谱法测定Na、K、Ca、Mg、Fe 5 种金属元素,结果Na、K、Ca、Mg、Fe 元素均低于检测限。
2.4 均匀性检验
根据GB/T15000.3-2008《标准样品工作导则(3)标准样品:定值的一般原则和统计方法》[19]的指导,开展了标准样品均匀性检验的研究工作。本批次D-甘露醇单体样品共分装200 瓶,每瓶5 mg,从1 号到200 号,通过在线随机数生成器随机挑选和重复测量的方法,本次抽样数目为15个,采用单因素多水平试验方差分析法进行纯度的均匀性检验,按“2.3.1”项下方法测定,每个样品重复测3 次。用峰面积归一化法计算纯度,然后用方差分析法进行均匀性检验。结果见表1 及表2。
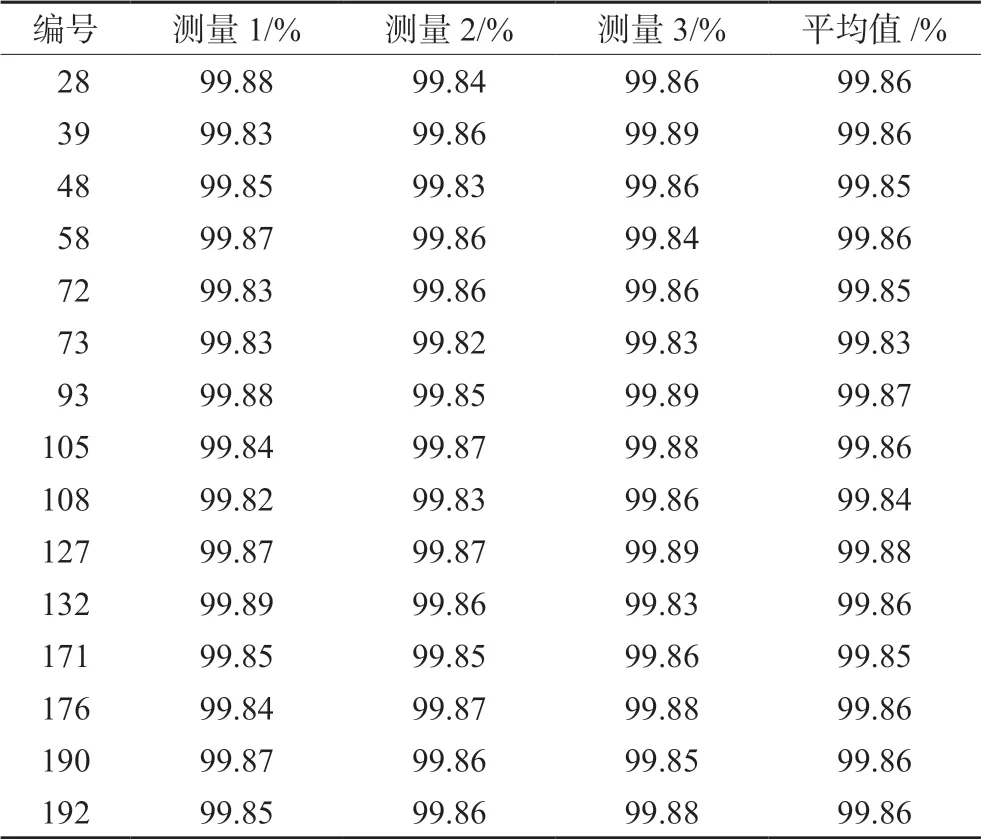
表1 D-甘露醇标准品均匀性检验Tab 1 Homogeneity of certified reference material of D-mannitol
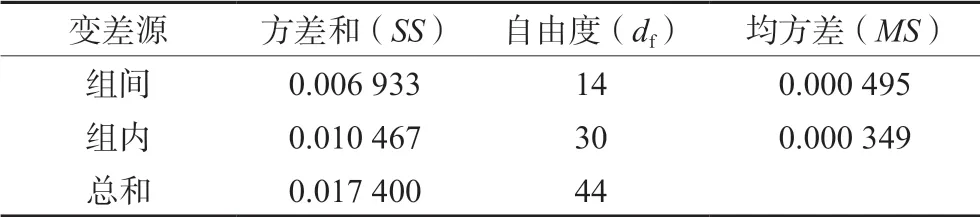
表2 D-甘露醇标准品均匀性试验的方差分析Tab 2 Variance analysis of homogeneity test of certified reference material of D-mannitol
根据方差分析结果计算,统计量F=MS组间/MS组内=0.000 495/0.000 349 =1.42,通过查F界值表,F值小于F(0.05,14,30)的值2.04,说明在95%的置信区间,D-甘露醇样品均匀性良好。
瓶间方差:SA2=(MS组间-MS组内)/n=(0.000 495-0.000 349)/3 =0.000 049
瓶间标准偏差:Sbb=SA=0.01%
均匀性实验的不确定度(Ubb)等于瓶间标准偏差(Sbb),故Ubb=Sbb=0.01%。
2.5 稳定性检验
2.5.1 长期稳定性 取标准样品的若干样品瓶,按市售包装样式进行包装,在2 ~4℃条件下放置24 个月,并分别于第0、6、12、18、24 个月随机抽取3 个样品瓶,在进行外观性状检查后,按“2.3.1”项下方法配制样品溶液并测定。每份样品连续进样两次,然后用峰面积归一化法求出其纯度的平均值,结果见表3。根据检测结果,D-甘露醇标准样品具有24 个月的长期稳定性。
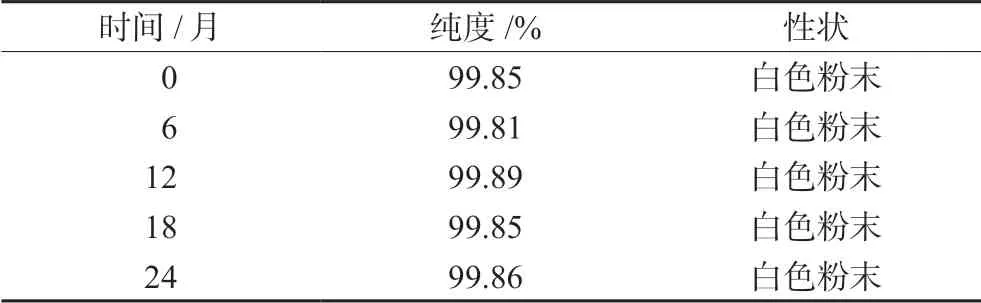
表3 D-甘露醇标准样品的纯度稳定性Tab 3 Stability of certified reference material of D-mannitol
根据导则[19]对稳定性研究的要求,采用直线模型,对表3 中长期稳定性试验测得的纯度数据进行分析。根据表3 所示检测结果,斜率b1根据下式计算:
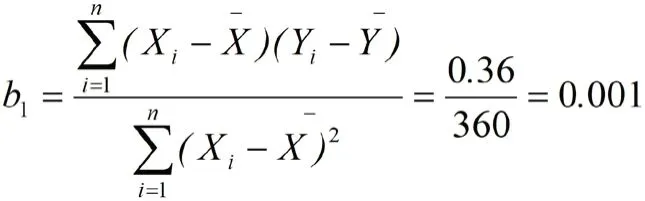
式中Xi为每次检测时间(月数);X=12,为表3 中每次检测间隔的时间总和月数与间隔检测的次数之比;Yi为每次测得的纯度(%);Y=99.85%,为表3 中5 次检测纯度的平均值。
截距b0由下式计算:b0=Y-b1X=99.852-(0.001 000×12)=99.84%。
直线上的点的标准偏差可由下式计算:
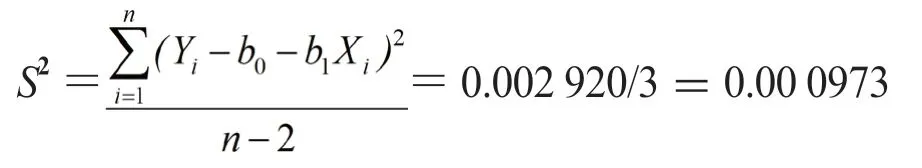
取其平方根s=0.031 198%,与斜率相关的不确定度用下式计算:
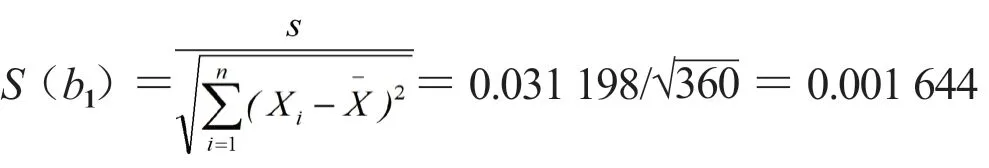
自由度为n-2 和P=0.95(95%置信水平)的分布t因子等于3.182。由于|b1|<t0.95,n-2×s(b1)=3.182×0.001 644%=0.005 231 6%,故斜率是不显著的,说明未观测到不稳定性,表明D-甘露醇在24 个月实验周期内稳定性良好。
长期稳定性试验的不确定度(Ults)计算公式为Ults=s(b1)×t(试验时间月数)。将相应数据代入公式计算,得值为长期试验稳定性的不确定度贡献度即为:
Ults=Sb×t=0.001 644%×24 =0.04%
以上直线模型分析结果表明,D-甘露醇标准样品在低温密闭环境下保存24 个月稳定性良好。试验结果说明,在实际保藏条件(温度:2 ~4℃)下,D-甘露醇的稳定期不低于2年。
2.5.2 短期稳定性 将样品模拟运输条件,测定运输条件下(25 ℃)样品6 d 内的稳定性。分别于0、2、4、6 d 进行检测,采用峰面积归一化法测定样品配制后的稳定性,样品纯度分别为99.86%、99.82%、99.87%、99.85%,RSD为0.022%,说明样品在模拟运输条件下6 d 内稳定。
2.5.3 样品溶液稳定性 为考察样品配制后,在多长时间内可以准确使用,考察样品配制4 ℃放置7 d 的稳定性。取本品1 mg,加1 mL 的甲醇溶解得1 mg·mL-1的样品溶液,分别于0、0.5、1、2、4、7 d 检测,采用峰面积归一化法测定样品配制后的稳定性,样品纯度分别为99.86%、99.85%、99.87%、99.84%、99.85%、99.83%,RSD为0.014%,故样品配制后7 d 内保持稳定。
2.6 定值分析
根据导则[19]规定及实际条件,采用8 家实验室协作试验定值的方式进行D-甘露醇标准样品的定值,每家分别随机抽取2 瓶样品送检,每个样品平行测试2 次,对8 家实验室的6 个数据进行统计,按“2.3.1”项下色谱条件,每瓶重复测定3次,应用峰面积归一化法进行定量[22](见表4)。
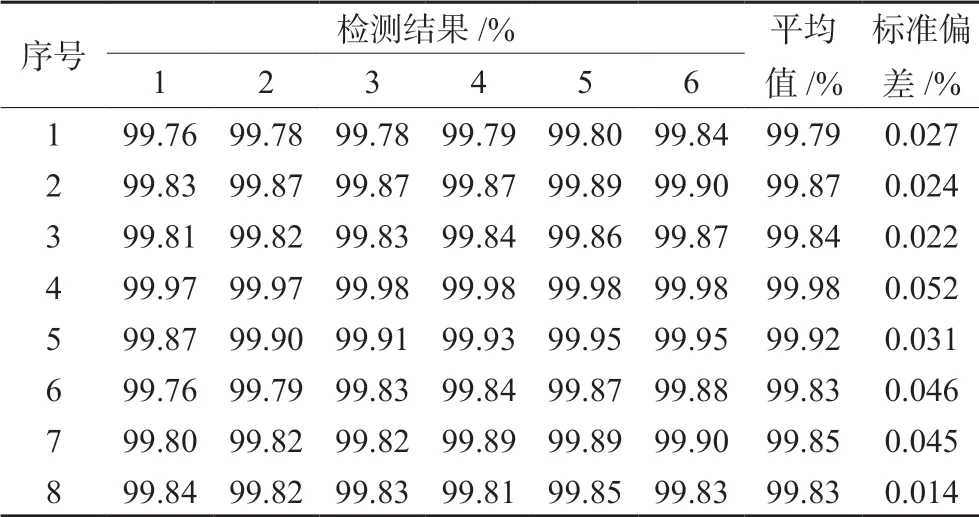
表4 8 家实验室D-甘露醇纯度定值数据Tab 4 Certification data of D-mannitol in 8 laboratories
对所采集的测定结果,采用格拉布斯(Grubb’s)检验法进行检验,未发现异常值,测定结果呈正态分布。通过以上对检验数据的考察,所得数据符合导则[19]的要求。采用峰度法检验各实验室数据的正态性,没有检出异常值。故各组所有数据全部有效,进行下一步统计,再用Grubb’s 法对每家实验室的平均值进行检验,将其看成一组测定值进行异常值检验,实验室间的Grubb’s 统计量G 均小于G'0.95(6)和G'0.99(6),因此将各家实验室测得的数据作为无偏估计值,计算8 家测定结果的平均值及标准偏差。通过统计分析,总平均值为x=99.86%。对表4 的数据进行方差分析,结果见表5。

表5 对8 家实验室定值数据的方差分析结果Tab 5 Variance for purity test data by 8 laboratories
总和0.180 69847-
2.7 定值分析的不确定度评定
根据导则[19]规定,定值结果由特性值和不确定度组成。根据全部测定结果,计算D-甘露醇标准样品的特性值和不确定度。
因未检测到甲醇、乙醇等溶剂残留,且Na、K、Ca、Mg、Fe 元素均低于检测限,故由溶剂残留及灰分引起的不确定度均可忽略不计。水分引起的不确定度包括仪器产生的不确定度和测量重复产生的不确定度。电子天平(最大称样量为32 g,精确度为0.01 mg),按照均匀分布,仪器产生的不确定度为U1=0.01%,水分测量结果及总的不确定度为U水=0.02%。
实验数据经统计分析,确定了D-甘露醇标准样品的实验室内重复性标准偏差Sr为0.021%,复现性标准偏差SL为0.058%,综合稳定性检验不确定度,均匀性检验不确定度,定值检验不确定度,水分测定不确定度等实验结果可得,D-甘露醇特性标准值为(1-0.02%)×99.86%=99.84%。合成不确定度U=0.06%,扩展不确定度U95=kU=2×0.06%=0.12%(P=95%,k=2)。D-甘露醇标准样品的纯度为99.84%,置信度为95% 的扩展不确定度值为0.12%。
3 结论
本文建立了D-甘露醇的制备分离纯化方法,制备所得的D-甘露醇标准样品,根据标准样品工作导则[19]的要求,按照研制流程对其进行了稳定性、均匀性以及定值检测研究,定值结果为99.84%,符合国家标准样品的技术规范要求。所研制的D-甘露醇标准样品填补了国内该领域研究的空白,不仅可用于D-甘露醇含量测定、检测方法评定、相关产品的检测与质量控制,对海带等含有D-甘露醇的相关产品及药品的检测提供了标准样品,也为检测结果的准确性、可比性以及溯源性提供了技术支撑。

