中华鳖投放密度对稻鳖共生田土壤细菌群落结构的影响
陈静 何吉祥 吴本丽 黄龙 张烨



摘要:【目的】明確稻鳖共生模式下稻田土壤微生物多样性及菌群结构组成的变化特征,为推广稻鳖共生模式及开展稻田土壤微生物功能研究提供理论依据。【方法】水稻移栽25 d后投放中华鳖,于8月10日、9月19日和10月10日采用五点法分别在水稻根部周围和鳖池水底采集0~5 cm表层土,应用Illumina MiSeq高通量测序分析稻田表层土壤和鳖池底泥的菌群结构特征及其多样性,并以冗余分析(RDA)识别稻鳖共生田土壤菌群结构变化的关键环境因子。【结果】放养中华鳖后稻鳖共生田土壤的理化性质均发生明显变化。从24份样品中测序获得145239个OTUs,涵盖的菌群涉及到74门184纲294目301科373属。各样品均具有较高的丰度和多样性,Chao1指数范围为7817.78~17453.39,Shannon指数范围为8.64~11.29,且中华鳖投放密度低的稻鳖共生田土壤菌群多样性相对较高。在稻田表层土壤和鳖池底泥菌群结构中,相对丰度大于1.00%的门共有10个,分别是变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、Ignavibacteriae、螺旋体门(Spirochaetes)、芽单胞菌门(Gemmatimonadetes)和疣微菌门(Verrucomicrobia),以变形菌门的相对丰度最高,达28.96%~64.76%;丰度大于1.00%的属有16个,相对丰度排名前10的属包括f_Anaerolineaceae、地杆菌属(Geobacter)、厌氧粘细菌属(Anaeromyxobacter)、f_Acidobacteriaceae_ [Subgroup_1]、寡养单胞菌属(Stenotrophomonas)、Sideroxydans、c_SBR2076、f_Nitrosomonadaceae、c_Bacteroidetes_vadinHA17和f_FW13。RDA分析结果表明,与稻鳖共生田土壤菌群结构分布极显著(P<0.01)相关的环境因子有pH、总氮(TN)含量和有机质(OM)含量,其中pH对稻鳖共生田土壤菌群结构分布影响最大。【结论】稻鳖共生模式能促进稻田土壤中氮、磷、钾的累积,有效提高土壤养分,且中华鳖投放密度低的稻田土壤菌群多样性相对较高。pH、TN含量和OM含量对稻鳖共生田土壤菌群结构的变化产生极显著影响,因此在实际生产中,中华鳖投放密度的确定除了要结合水稻和中华鳖的生产性能外,还应考虑稻鳖共生模式中饲料化肥的环境释放特点、营养物质循环特征及微生物结构组成等。
关键词:稻鳖共生;稻田土壤;群落结构;多样性;高通量测序
中图分类号:S154.37 文献标志码: A 文章编号:2095-1191(2021)10-2650-12
Abstract:【Objective】To clarify the variation characteristics of soil microbial diversity and bacterial community structure under rice-turtle symbiotic model, and to provide theoretical basis for the promotion of rice-turtle intergrowth model and the study of soil microbial function in rice field.【Method】Chinese soft-shelled turtles were placed 25 d after the rice was transplanted. On August 10, September 19, and October 10, the five-point method was used to collect 0-5 cm topsoil around the root of rice and the bottom of turtle pond, respectively. Illumina MiSeq high-throughput sequencing was used to analyze the characteristics and diversity of bacteria in soil and the bottom mud of the Chinese soft-shelled turtle pond, and redundancy analysis(RDA) was used to identify the key environmental factors affecting the structural changes of soil bacteria in rice-turtle symbiotic field. 【Result】The results showed that the physical and chemical properties of soil in rice-turtle symbiotic field changed greatly after putting Chinese soft-shelled turtle. 145239 OTUs were obtained from 24 samples, covering 74 phyla, 184 classes, 294 orders, 301 families and 373 genera. Each sample had high richness and diversity, with Chao1 index range of 7817.78-17453.39, and Shannon index range of 8.64-11.29. Moreover, the diversity of soil microbial community in rice-turtle symbiotic field with low stocking density was relatively high. There were 10 phyla with relative abundance greater than 1.00% in the soil of rice-turtle symbiotic field and bottom mud of turtle pond. They were Proteobacteria, Chloroflexi, Acidobacteria, Bacteroidetes, Nitrospirae, Firmicutes, Ignavibacteriae, Spirochaetes, Gemmatimonadetes and Verrucomicrobia, respectively. The relative abundance of Proteobacteria was the highest, reaching 28.96%-64.76%; there were 16 genera with abundance greater than 1.00%. The top 10 genera with relative abundance included f_Anaerolineaceae, Geobacter, Anaeromyxobacter, f_Acidobacteriaceae_[Subgroup_1], Stenotrophomonas, Sideroxydans, c_SBR2076, f_Nitrosomonadaceae, c_Bacteroidetes_vadinHA17 and f_FW13. The results of RDA analysis showed that pH, total nitrogen(TN) content and organic matter(OM) content were extremely correlated to the distribution of soil microbial community structure in the rice turtle symbiotic field (P<0.01), and pH had the grea-test impact on the distribution of soil microbial community structure in the rice-turtle symbiotic field. 【Conclusion】The rice-turtle symbiosis model can promote the accumulation of nitrogen, phosphorus, and potassium in the paddy soil, and effectively improve the soil nutrients, and the soil microbial diversity of the paddy field with low stocking density of the Chinese soft-shelled turtle is relatively high. The pH, TN content and OM content have extremely significant indigenous effects on the changes of soil microbial community structure in the rice-turtle symbiotic field. Therefore, in the actual production, the determination of the feeding density of turtle should not only combine the production performance of rice and turtle, but also consider the environmental release of feed and fertilizer, nutrient cycling characteristics and microbial structure in the symbiotic mode of rice and turtle.
Key words: rice-turtle intergrowth; paddy soil; community structure; diversity; high-throughput sequencing
Foundation item:National Key Research and Development Program of China(2018YFD0300904-4); Chief Expert Office of Hefei Agricultural Industry (202107); Innovative Team Building Special Project of Anhui Academy of Agricultural Sciences(2021YL028)
0 引言
【研究意义】水稻—土壤及其生态系统是环境友好、生态健康、可持续利用的人工湿地生态系统(曹志洪等,2006),稻田综合种养是一种绿色农业种养模式,既能充分利用有限的土地资源和水资源,又能保护和改善农业生态环境,是促进绿色农业发展和确保粮食安全的有效途径(Pretty,2008;王昂等,2019)。随着农业绿色发展理念的提出,我国稻田养殖得到快速发展,2019年我国稻田养殖水产品面积达231.75万ha,年产出水产品达291.33万t(农业部渔业渔政管理局等,2020),其中稻鱉共生(稻田养殖甲鱼)是稻渔综合种养的一种重要模式。土壤微生物参与土壤有机质分解、腐殖质形成和分解,直接或间接影响土壤养分的转化及土壤肥力的提高(Win-ding et al.,2005;朱永官等,2017;张晟等,2019)。因此,农业领域研究热点已逐渐从地上部分的农艺性状分析扩展到地下部的土壤微生物群落结构及其功能研究。【前人研究进展】稻田养殖的快速发展,促使稻田养殖技术得到显著提高。佀国涵等(2016)研究认为,稻虾共作模式能提高稻田土壤微生物的活性及其群落功能多样性;赵翔刚等(2017)研究表明,稻田养殖沙塘鳢后其水体及底泥的微生物群落结构与常规稻田存在明显差异;王蓉等(2019)研究发现,稻虾共作模式对稻田土壤氨氧化细菌群落无显著影响,但显著增加氨氧化细菌的丰度并影响其群落结构组成;张军等(2020)研究认为,稻鸭共作通过改变土壤理化性质来影响细菌群落的空间分布。目前关于稻鳖共生的研究主要集中在生产技术及经济效益等方面(刘才高等,2015;张静等,2016;李竣等,2019;张开礼,2019)。周爱珠等(2014)研究认为,运用生态经济学原理、系统工程方法和健康消费理念建立稻鳖共生基地,可探索出一条稻田养殖和稳粮增收的有效途径,在保障粮食安全的同时促进农业增效及农民增收。蔡炳祥等(2016)根据浙江省德清县单季晚稻主要病虫害发生特点,总结出稻鳖共生技术中的绿色稻米病虫害控制关键措施,能有效控制病虫害发生及减少农药使用量。宋光同等(2017)研究表明,在稻鳖共作模式中水稻品种宜选择粳稻,而幼鳖放养密度以控制在3000只/ha左右为宜。常培恩等(2019)研究证实,稻鳖共作模式有利于增加水稻的有效穗数和实粒数,显著提升再生稻产量,提高出糙率、精米率和整精米率,改善稻米加工品质,同时能降低垩白率和垩白度,提升稻米的外观品质。杨飞翔等(2019)研究表明,稻鳖共作模式下水稻田土壤的全氮和全磷含量呈“峰”形变化,有机质含量长期保持较高水平,通过提高单位面积有效穗数和穗粒数而增加水稻产量,具体表现为头季稻平均增产9.75%,再生稻平均增产10.05%。佟德利等(2019)研究发现,全生育期内稻蟹种养生产田的氨化细菌、反硝化细菌、嫌气性纤维素分解菌、好气性自生固氮菌、亚硝酸细菌分别是常规稻田的9.28、6.44、5.22、3.65和3.00倍,即稻蟹种养生产田主要微生物种类增加,改变了微生物多样性格局,尤其是细菌多样性指数峰值出现的时间提早20 d。【本研究切入点】稻田综合种养正逐步发展成为具有“稳粮、促渔、提质、增效、生态”等多方面功能的现代农业新模式,有关水稻与动物共育影响稻田土壤细菌群落结构和多样性的研究已有报道,但针对稻鳖共生模式下水稻田土壤微生物群落结构多样性分析的研究较少。【拟解决的关键问题】通过分析中华鳖投放密度对稻鳖共生田土壤细菌群落结构的影响,明确稻鳖共生模式下稻田土壤微生物多样性及菌群结构组成的变化特征,以期为推广稻鳖共生模式及开展稻田土壤微生物功能研究提供理论依据。
1 材料与方法
1. 1 田间处理
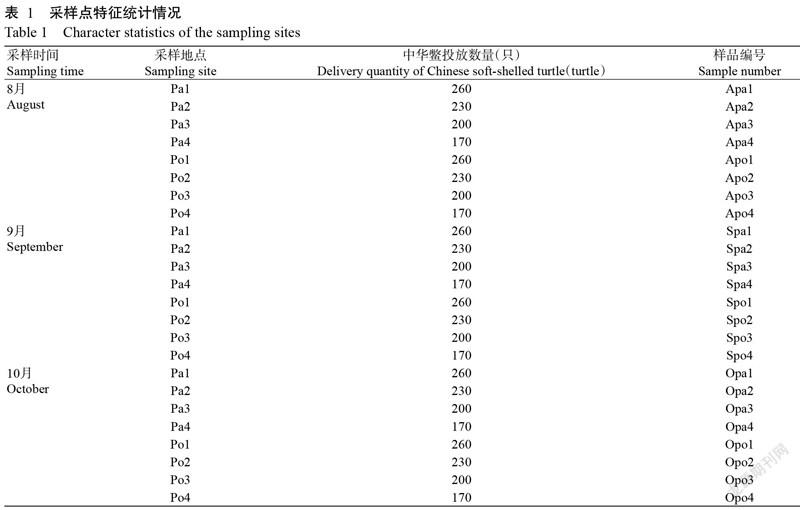
在安徽省太湖县徐桥镇桃铺村稻鳖生态种养基地(东经116°36′,北纬30°29′)开展稻鳖共生试验,该区域属亚热带季风气候,四季分明,夏季高温多雨,冬季温和少雨,常年平均气温16.4 ℃,年均降水量1368.4 mm,无霜期249 d。试验共设4块试验稻田(P1、P2、P3和P4),每块试验田的稻鳖共生工程如图1所示。每块试验稻田总面积约1600.0 m2(长47.0 m,宽34.0 m),其中,水稻种植面积为1360.0 m2(每块试验稻田内的水稻田编号分别为Pa1、Pa2、Pa3和Pa4),鳖池面积为108.0 m2(长12.0 m,宽9.0 m,深1.0 m)(每块试验稻田内的鳖池编号分别为Po1、Po2、Po3和Po4),与鳖池长边垂直方向设长21.0 m、宽1.0 m、深0.6 m的水沟,水稻移栽25 d后投放中华鳖,中华鳖规格为0.35~0.40 kg/只,实际投放数量分别为260、230、200和170只,投放的中华鳖均为雄性。水稻品种为籼型两系杂交水稻——隆两优华占,于6月26日移栽,行株距为25 cm×15 cm,10月11日收割。水稻移栽前施用复合肥1125 kg/ha、尿素150 kg/ha,整个水稻生长期间不施用任何化肥及农药,每天按中华鳖体重的3%~5%投喂中华鳖饲料(湖州海皇甲鱼配合饲料)。
1. 2 样品采集与处理
于8月10日、9月19日和10月10日,采用五点法分别在水稻根部周围和鳖池水底采集0~5 cm表层土,具体稻田表层土壤样品和鳖池底泥样品如表1所示。样品剔除根茬、杂草及石块等杂物后充分混匀并分成2份。一份用于土壤理化性质测定;另一份装入干净塑料封口袋,以干冰运回实验室后存放于-80 ℃冰箱,用于细菌多样性分析。
1. 3 Illumina MiSeq高通量测序分析
采用TIANamp Soil DNA Kit试剂盒(TIANGEN,DP 336)提取基因组DNA,提取的DNA以1.0%琼脂糖凝胶电泳和紫外分光光度计检测其浓度、纯度及完整性,-80 ℃保存备用。在PCR仪(ABIGeneAmp®9700)上使用引物515F(5'-GTGCCAGCMGCCGCG GTAA-3')和907R(5'-CCGTCAATTCMTTTRAGTT T-3')对16S rRNA序列V4~V5高变区片段进行PCR扩增(Stubner,2002;Lundberg et al.,2013),PCR反应体系50.0 μL:DNA模板10 ng,5×Buffer 10.0 μL,2.5 mmol/L dNTPs 4.0 μL,引物515F和907R(5 μmol/L)各1.0 μL,Taq DNA聚合酶0.5 μL,ddH2O补足至50.0 μL。扩增程序:98 ℃变性1 min;98 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,進行27个循环;72 ℃延伸5 min。参照Illumina 16S Metagenomic Sequencing Library Preparation构建文库,利用NanoDorp和Agilent 2100 Bioanalyzer检测文库浓度及其片段大小,检测合格后委托广州赛哲生物科技有限公司在Illumina MiSeq平台上完成高通量测序分析。
1. 4 数据处理分析
去除测序所得序列中低质量碱基和接头污染序列,数据过滤后得到优质序列(Bokulich et al.,2013);采用UCHIME v4.2鉴定并去除嵌合体(Edgar et al.,2011;李忠奎等,2019),得到可用于后续分析的有效数据(Effective Tags)。将相似度大于97%的序列归为一类OTU,然后将OTU比对到相关数据库中各物种相应的序列进行物种识别;利用QIIME 1.8.0进行Alpha多样性分析等(Adler et al.,2013),并以Canoco 4.5进行菌群结构与环境因子的冗余分析(RDA)。
2 结果与分析
2. 1 稻鳖共生田土壤的理化性质
于稻田中投放不同密度的中华鳖,结果发现稻鳖共生田土壤的理化性质均发生明显变化(表2)。土壤pH在P1试验田和P2试验田间无显著差异(P>0.05,下同),但有一定程度的提高;总氮(TN)、总磷(TP)和全钾(TK)含量在P3试验田和P4试验田也均呈上升趋势;有机质(OM)含量在P1试验田、P2试验田和P4试验田有一定程度的下降趋势,且在P1试验田的差异达显著水平(P<0.05,下同);阳离子交换量(CEC)在4块试验田均呈下降趋势,其差异均达显著水平。
2. 2 稻鳖共生田土壤菌群丰富度及其多样性
从24份样品中测序获得7580378条Reads,经双端Reads拼接及过滤后共获得5303353条Effective Tags。按97%的相似度进一步归类,共产生145239个OTUs,每份样品的OTU数量介于4465~7466个。将OTU进行门、纲、目、科及属水平分类,除部分分类地位不明确的菌群外,共鉴定出74门184纲294目301科373属(表3)。除9月的P1试验田和P2试验田外,同一时期同块试验田的OTU数量均表现为稻田表层土壤高于鳖池底泥;在3个采样时期的样品中,OTU数量均表现为10月>8月>9月。
Alpha多样性分析结果(表3)显示,不同采样点的多样性指数变化与OTU具有相同的变化趋势。24份样品均具有较高的丰度和多样性,Chao1指数范围为7817.78~17453.39,Shannon指数范围为8.64~11.29。稻鳖共生田土壤细菌多样性指数存在明显的时空变化特征,除10月的P1试验田和P2试验田外,同一时期同块试验田菌群的Chao1指数和Shannon指数均表现为稻田表层土壤高于鳖池底泥。在投放不同密度的中华鳖稻田中,3个采样时期的样品菌群Chao1指数和Shannon指数平均值排序均表现为P4试验田>P3试验田>P2试验田>P1试验田。
2. 3 稻鳖共生田土壤菌群结构特征
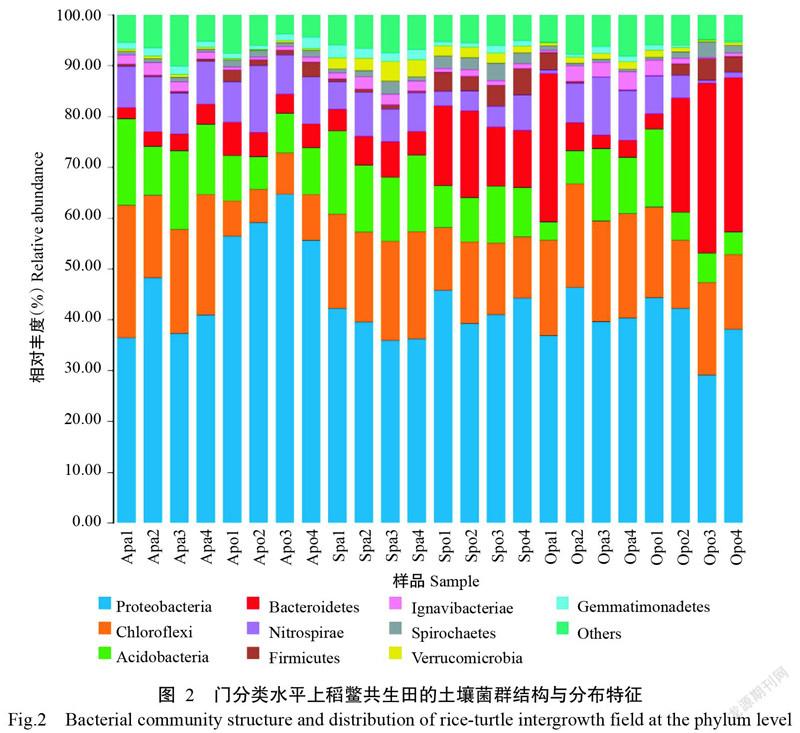
2. 3. 1 门分类水平下优势菌群的分布特征 如图2所示,稻田表层土壤和鳖池底泥菌群在门分类水平上具有较高的多样性。对于所有样品而言,相对丰度大于1.00%的门共有10个,分别是变形菌门(Proteobacteria,28.96%~64.76%)、绿弯菌门(Chloroflexi,6.56%~26.05%)、酸杆菌门(Acidobacteria,3.67%~17.15%)、拟杆菌门(Bacteroidetes,2.18%~33.54%)、硝化螺旋菌门(Nitrospirae,0.53%~13.23%)、厚壁菌门(Firmicutes,0.38%~5.26%)、Ignavibacteriae(0.23%~ 3.56%)、螺旋体门(Spirochaetes,0.45%~3.51%)、芽单胞菌门(Gemmatimonadetes,0.17%~2.51%)和疣微菌门(Verrucomicrobia,0.16%~3.85%),相对丰度之和达90.02%~96.26%。其中,变形菌门为最优势菌门,其次是绿弯菌门、酸杆菌门、拟杆菌门和硝化螺旋菌门。
变形菌门的相对丰度随中华鳖放养时间的推移呈逐渐下降趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中其相对丰度排序为P2试验田>P1试验田>P4试验田>P3试验田。绿弯菌门的相对丰度与变形菌门恰好相反,随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中其相对丰度排序为P3试验田>P4试验田>P1试验田>P2试验田。酸杆菌门在9月采集样品中的相对丰度最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中其相对丰度排序为P1試验田>P3试验田>P4试验田>P2试验田。拟杆菌门的相对丰度随中华鳖放养时间的推移也呈上升趋势,但稻田表层土壤低于鳖池底泥,在稻鳖共生田中其相对丰度排序为P4试验田>P3试验田>P2试验田>P1试验田。硝化螺旋菌门的相对丰度随中华鳖放养时间的推移也呈下降趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中其相对丰度排序为P2试验田>P4试验田>P3试验田>P1试验田。
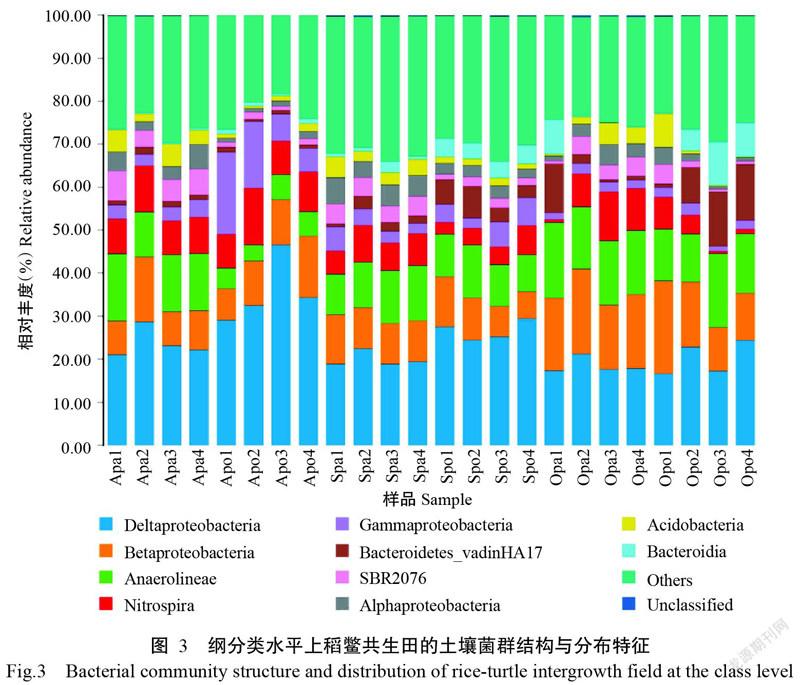
2. 3. 2 纲分类水平下优势菌群的分布特征 稻田表层土壤和鳖池底泥菌群组成在纲分类水平上相对丰度大于1.00%的共有19个,相对丰度排名前10的纲(图3)包括δ-变形菌纲(Deltaproteobacteria,16.49%~46.55%)、β-变形菌纲(Betaproteobacteria,6.20%~21.69%)、厌氧绳菌纲(Anaerolineae,3.83%~ 17.39%)、硝化螺旋菌纲(Nitrospira,0.52%~13.23%)、γ-变形菌纲(Gammaproteobacteria,1.16%~19.05%)、Bacteroi-detes_vadinHA17(0.53%~13.29%)、SBR2076(0.59%~6.92%)、α-变形菌纲(Alphaproteobacteria,0.67%~3.19%)、酸杆菌纲(Acidobacteria,0.21%~7.86%)和拟杆菌纲(Bacteroidia,0.10%~10.03%),相对丰度之和为66.07%~81.61%。其中,δ-变形菌纲、β-变形菌纲和厌氧绳菌纲的相对丰度较高,为主要优势菌纲。
δ-变形菌纲的相对丰度随中华鳖放养时间的推移呈下降趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中的相对丰度排序为P3试验田>P2试验田>P4试验田>P1试验田。β-变形菌纲在10月采集样品中的相对丰度最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P2试验田>P1试验田>P4试验田>P3试验田。厌氧绳菌纲的相对丰度随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P3试验田>P4试验田>P1试验田>P2试验田。硝化螺旋菌纲的相对丰度随中华鳖放养时间的推移呈下降趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P2试验田>P4试验田>P3试验田>P1试验田。γ-变形菌纲的相对丰度随中华鳖放养时间的推移也呈下降趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P2试验田>P4试验田>P3试验田。Bacteroidetes_vadinHA17的相对丰度随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中其相对丰度排序为P4试验田>P3试验田>P2试验田>P1试验田。SBR2076在9月采集样品中的相对丰度最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P2试验田>P4试验田>P3试验田。Alphaproteobacteria在9月采集样品中的相对丰度最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P3试验田>P1试验田>P4试验田>P2试验田。
2. 3. 3 属分类水平下优势菌群的分布特征 稻鳖共生田土壤和鳖池底泥菌群组成在属分类水平上相对丰度大于1.00%的有16个,相对丰度排名前10的属(图4)包括f_Anaerolineaceae(3.33%~11.98%)、地杆菌属(Geobacter,4.19%~22.69%)、厌氧粘细菌属(Anaeromyxobacter,1.36%~14.61%)、f_Acidobacteriaceae_[Subgroup_1](0.18%~7.50%)、寡养单胞菌属(Stenotrophomonas,0.11%~15.37%)、Sideroxydans (0.01%~8.19%)、c_SBR2076(0.30%~3.65%)、f_Nitrosomonadaceae(0.14%~3.78%)、c_Bacteroidetes_vadin HA17 (0.34%~8.78%)和f_FW13(0.10%~4.19%),相对丰度之和为25.18%~50.95%。
f_Anaerolineaceae的相对丰度随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P4试验田>P3试验田>P2试验田>P1试验田。地杆菌属的相对丰度随中华鳖放养时间的推移呈下降趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中的相对丰度排序为P3试验田>P4试验田>P2试验田>P1试验田。厌氧粘细菌属的相对丰度随中华鳖放养时间的推移呈下降趋势,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中的相对丰度排序为P4试验田>P2试验田>P1试验田>P3试验田。f_Acidobacteriaceae_[Subgroup_1]的相对丰度随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P3试验田>P4试验田>P2试验田。寡养单胞菌属在8月采集样品中的相对丰度最高,且稻田表层土壤低于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P2试验田>P3试验田>P4试验田。Sideroxydans的相对丰度随中华鳖放养时间的推移呈上升趋势,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P2试验田>P3试验田>P4试验田。c_SBR2076在9月采集样品中的相对丰度最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P1试验田>P2试验田>P4试验田>P3试验田。f_Nitrosomonadaceae在9月采集样品中的相对丰度也最高,且稻田表层土壤高于鳖池底泥,在稻鳖共生田中的相对丰度排序为P2试验田>P3试验田>P4试验田>P1试验田。
2. 4 菌群结构与环境因子的RDA分析结果
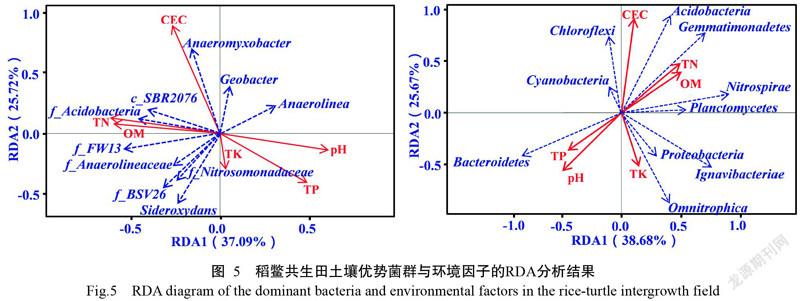
为了解稻鳖共生田土壤主要菌群与环境因子的相互关系,采用Canoco 4.5进行RDA分析,选用相对丰度排名前10的门和属,环境因子参数包括pH、TN含量、TP含量、TK含量、OM含量和CEC。在环境因子梯度分析中,特征值(F)越大,表明环境因子对菌群结构影响越大,P越小则其相关性越显著。由表4可知,稻鳖共生田土壤菌群结构变化是不同环境因子变化的共同结果,与稻鳖共生田土壤菌群结构分布极显著(P<0.01)相关的环境因子有pH、TN含量和OM含量,其中pH对稻鳖共生田土壤菌群结构分布影响最大。稻鳖共生田土壤优势菌群与环境因子的RDA分析结果(图5)显示,环境因子对稻鳖共生田土壤优势菌群的影响主要通过各环境因子的长度表征,而环境因子对优势菌群的影响程度通过夹角余弦值来反映。变形菌门及其门下的地杆菌属、厌氧粘细菌属和Sideroxydans与OM含量呈正相关,变形菌门受TK含量的影响较大,地杆菌属和厌氧粘细菌属受CEC的影响较大;绿弯菌门及其门下的f_Anaero-lineaceae和f_Acidobacteriaceae_[Subgroup_1]、酸杆菌门、硝化螺旋菌门和Ignavibacteriae与pH呈负相关,与TN含量和OM含量呈正相关;拟杆菌门与pH呈正相关,且受pH影响较大。
3 讨论
3. 1 中华鳖投放密度对稻鳖共生田土壤菌群多样性的影响
菌群多样性是细菌谱系在生境中的重要生态影响因素(Cohan,2002),土壤微生物多样性越高,越有利于维持土壤功能和生态系统稳定(Cardinale et al.,2006)。与其他的稻田综合种养模式(佀国涵等,2016;赵翔刚等,2017;罗衡等,2018)相比,本研究的稻鳖共生田土壤菌群多样性指数(Chao1和Shannon)处于偏高水平,究其原因可能是应用高通量测序分析获得的菌群多样性指数与以PCR-DGGE和T-RFLP分析得到的多样性指数相比其数值更高(Kirchman et al.,2010;王欢等,2018),且表层土壤微生物多样性高于下层(任万军等,2009),稻田土壤和鳖池底泥均采集0~5 cm表层,菌群结构组成丰富。
稻田土壤微生物作为稻田土壤生态系统的重要组成部分,对外界环境的作用具有一定响应。在稻鳖共生模式下,中华鳖通过爬行、掘穴及觅食等生物扰动改变营养物质和氧气的供应,进而影响稻田表层土壤和水稻根系的微生物群落结构及其多样性(罗衡等,2018)。本研究结果表明,中华鳖对稻鳖共生田土壤菌群产生一定程度的影响,且中华鳖投放密度对稻鳖共生田土壤菌群的影响表现为低投放密度的稻田土壤菌群多样性相对较高,可能是中华鳖引入打破了原有稻田的平衡,短时间内未能适应,而导致菌群多样性降低,中华鳖投放密度越大其干扰越大,但与佀国涵等(2016)、罗衡等(2018)的研究结论不一致,即稻渔共生模式的土壤菌群多样性高于水稻单作模式。
3. 2 中华鳖投放密度对稻鳖共生田土壤菌群结构组成的影响
稻田土壤在经历淹水和控水的干湿交替后,具有独特的氧化还原条件和性质,发生一些如硝化作用、反硝化作用、铁氧化还原、产甲烷和甲烷氧化等过程(王娟,2015)。与其他土壤相比,具有更丰富的好氧、厌氧和兼性微生物(Jangid et al.,2008)。變形菌门、绿弯菌门、酸杆菌门、拟杆菌门和硝化螺旋菌门是稻鳖共生田土壤的主要菌门,且以变形菌门的相对丰度最高,与Jangid等(2008)、罗衡等(2018)的研究结果相似。f_Anaerolineaceae、地杆菌属、厌氧粘细菌属、f_Acidobacteriaceae_[Subgroup_1]和寡养单胞菌属是稻鳖共生田的主要菌属。不同菌门和菌属的分布呈明显时空特征。变形菌门及其门下的地杆菌属和厌氧粘细菌属及硝化螺旋菌门的相对丰度均随中华鳖放养时间的推移呈下降趋势,究其原因可能是变形菌门和硝化螺旋菌门与OM含量呈正相关,在水稻生长旺季需要养分较多,加上水体流动带走稻田土壤的一些养分,致使OM含量呈下降趋势,导致变形菌门和硝化螺旋菌门随时间推移而下降趋势。绿弯菌门及其门下的f_Anaerolineaceae和f_Acidobacteriaceae_[Subgroup_1]及拟杆菌门的相对丰度则随中华鳖放养时间的推移呈上升趋势。此外,变形菌门及其门下的地杆菌属、厌氧粘细菌属和寡养单胞菌属及拟杆菌门的相对丰度表现为稻田表层土壤低于鳖池底泥,可能是这些菌群主要与CEC呈负相关,而稻田表层土壤的CEC大于鳖池底泥。绿弯菌门及其门下的f_Anaerolineaceae和f_Acidobacteriaceae_[Subgroup_1]、酸杆菌门、硝化螺旋菌门及其门下的f_Nitrosomonadaceae的相对丰富表现为稻田表层土壤高于鳖池底泥。
不同中华鳖投放密度的稻鳖共生田土壤菌群分布也不同。本研究结果表明,稻鳖共生田土壤f_Nitrosomonadaceae的相对丰度随中华鳖投放密度的增加而增加, f_Nitrosomonadaceae为亚硝化细菌,能将NH4+氧化成NO2-,是硝化作用的第一步和限速步骤,控制着硝化作用的整个过程,在土壤生态系统的氮循环中发挥重要作用(路璐和何艳,2018;Lu et al.,2018),可能是由于中华鳖的活动提高了土壤通透性和硝化作用,与佀国涵等(2019)的研究结果相似。拟杆菌门在稻鳖共生田土壤中的相对丰度也随中华鳖投放密度的增加而增加,拟杆菌门利用碳能减少甲烷排放,具有减少温室效应的潜力。盛锋(2019)在探究稻鸭共育时发现,鸭子的行走或觅食等行为促使土壤氧化还原状况得到改善,进而有利于降低CH4排放。
3. 3 稻鳖共生田土壤营养物质分布对菌群结构变化的影响
稻田土壤菌群结构与土壤的理化性质密切相关(袁红朝等,2015;刘其根等,2018)。本研究中菌群结构与环境因子的RDA分析结果表明,pH、TN含量和OM含量对稻鳖共生田土壤菌群结构的变化产生极显著影响。pH是调控土壤菌群结构的主导因子,不仅直接影响菌群的生长情况,还能改变土壤理化性质,进而影响菌群结构及其多样性(张宇亭,2017)。土壤含有的有机和无机营养物是微生物生长与繁殖的天然培养基(陈力力等,2018)。在稻鳖共生田土壤中,相对丰度最高的菌属是f_Anaero-lineaceae,隶属于绿弯菌门,为兼性厌氧生物,具有绿色色素,在光合作用中不产生氧气,不能固氮,与pH呈负相关,与TN含量和OM含量呈正相关。其次是地杆菌属和厌氧粘细菌属,二者均为变形菌门δ-变形菌纲的革兰氏阴性及兼性细菌,广泛分布于厌氧沉积环境。RDA分析结果显示,地杆菌属和厌氧粘细菌属与pH的相关系数分别为0.603(P=0.21)和-0.833(P=0.16),结合采样点的土壤pH,发现并不在其最适生长的pH范围内(朱超等,2011)。f_Acidobacteriaceae_[Subgroup_1]隶属于酸杆菌门,是土壤中一类常见且重要的细菌类群,在植物残体降解中发挥重要作用,酸杆菌门与土壤pH呈显著负相关(Lauber et al.,2008;王光华等,2016)。由于稻田土壤环境十分复杂,土壤理化因子与微生物各种作用途径的相互关系及分子机理均有待进一步探究。吴雪(2012)在研究稻鱼共作时发现,随着田鱼投放密度的增加,饲料养分的流失也相应增加,氮利用效率降低。在实际生产中,中华鳖投放密度的确定除了要结合水稻和中华鳖的生产性能外,还应考虑稻鳖共生模式中饲料化肥的环境释放特点、营养物质循环特征及微生物结构组成等。
4 结论
稻鳖共生模式能促进稻田土壤中氮、磷、钾的累积,有效提高土壤养分,且中华鳖投放密度低的稻田土壤菌群多样性相对较高。pH、TN含量和OM含量对稻鳖共生田土壤菌群结构的变化产生显著影响,因此在实际生产中,中华鳖投放密度的确定除了要结合水稻和中华鳖的生产性能外,还应考虑稻鳖共生模式中饲料化肥的环境释放特点、营养物质循环特征及微生物结构组成等。
参考文献:
蔡炳祥,王根连,任洁. 2016. 稻鳖共生单季晚稻主要病虫发生特点及绿色防控关键技术[J]. 中国稻米,22(4):75-76. [Cai B X,Wang G L,Ren J. 2016. Characteristics of main diseases and insect pests of single cropping late rice and green protection and control technology in rice-turtle farming[J]. China Rice,22(4):75-76.] doi:10. 3969/j.issn.1006-8082.2016.04.020.
曹志洪,林先贵,杨林章,胡正义,董元华,尹睿. 2006. 论“稻田圈”在保护城乡生态环境中的功能II.稻田土壤氮素养分的累积、迁移及其生态环境意义[J]. 土壤学报,43(2):256-260. [Cao Z H,Lin X G,Yang L Z,Hu Z Y,Dong Y H,Yin R. 2006. Ecological function of “paddy field ring” to urban and rural environment II. Characteristics of nitrogen accumulation,movement in paddy field ecosystem and its relation to environmental protection[J]. Acta Pedologica Sinica,43(2):256-260.] doi:10.3321/j.issn:0564-3929.2006.02.013.
常培恩,陈灿,黄璜,杨飞翔. 2019. 稻田养鳖对水稻产量形成及稻米品质的影响[J]. 作物研究,33(5):388-391. [Chang P E,Chen C,Huang H,Yang F X. 2019. Effect of raising turtle in paddy field on yield formation and rice quality[J]. Crop Research,33(5):388-391.] doi:10. 16848/j.cnki.issn.1001-5280.2019.05.11.
陈力力,刘金,李梦丹,杨伊磊,邹应斌,黄敏. 2018. 不同耕作方式稻田土壤细菌的多样性[J]. 微生物学杂志,38(4):62-70. [Chen L L,Liu J,Li M D,Yang Y L,Zou Y B,Huang M. 2018. Diversity of bacterial community in paddy fields with different tillage styles[J]. Journal of Microbiology,38(4):62-70.] doi:10.3969/j.issn.1005-7021. 2018.04.009.
李竣,陈洁,姜楠. 2019. 中国稻田养殖现状及发展前景[J]. 农业展望,15(1):61-65. [Li J,Chen J,Jiang N. 2019. Status quo and development prospect of paddy field aquaculture in China[J]. Agricultural Outlook,15(1):61-65.] doi:10.3969/j.issn.1673-3908.2019.01.011.
李忠奎,凌爱芬,李红丽,陈娟,朱显俊,王勇,陈玉蓝,王岩. 2019. 基于多样性测序对健康与易感病烟田根际土壤微生物群落分析[J]. 河南农业大学学报,53(6):918-925. [Li Z K,Ling A F,Li H L,Chen J,Zhu X J,Wang Y,Chen Y L,Wang Y. 2019. Analysis of rhizosphere soil microbial communities in healthy and susceptible tobacco fields based on diversity sequencing[J]. Journal of Henan Agricultural University,53(6):918-925.] doi:10.16445/j.cnki.1000-2340.20191120.014.
刘才高,周爱珠,徐刚. 2015. 稻鳖共生效益試验[J]. 安徽农业科学,43(7):157. [Liu C G,Zhou A Z,Xu G. 2015. Experiment of rice turtle symbiosis benefits[J]. Journal of Anhui Agricultural Sciences,43(7):157.] doi:10.3969/j.issn.0517-6611. 2015.07.056.
刘其根,李丰,罗衡,郭松海,张文博. 2018. 引入养殖鳖对稻田土壤固氮菌的影响[J]. 应用与环境生物学报,24(3):483-492. [Liu Q G,Li F,Luo H,Guo S H,Zhang W B. 2018. The influence of introducing soft-shelled turtle on soil nitrogen-fixing microorganisms in paddy field[J]. Chinese Journal of Applied and Environmental Biology,24(3):483-492.] doi:10.19675/j.cnki.1006-687x.2017. 06041.
路璐,何燕. 2018. 不同林分土壤中氨氧化微生物的群落结构和硝化潜势差异及其驱动因子[J]. 南方农业学报,49(11):2169-2176. [Lu L,He Y. 2018. The difference of ammonia-oxidizing microorganism communities structure and nitrification potential in soils of different forest stands and their driving factors[J]. Journal of Southern Agriculture,49(11):2169-2176.] doi:10.3969/j.issn. 2095-1191.2018.11.08.
罗衡,赵良杰,李丰,郭海松,沈竑,刘其根. 2018. 养殖鳖的引入对稻田土壤细菌群落结构的影响[J]. 水产学报,42(5):720-732. [Luo H,Zhao L J,Li F,Guo H S,Shen H,Liu Q G. 2018. Effects of the introduction of cultured turtle on soil bacterial community structure in paddy field[J]. Journal of Fisheries of China,42(5):720-732.] doi:10.11964/jfc.20170310730.
农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 2020. 2020中国渔业统计年鉴[M]. 北京:中国农业出版社. [Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs,National Aquatic Technology Extension Station,China Society of Fisheries. 2020. 2020 China fishery statistical yearbook[M]. Beijing:China Agriculture Press.]
任万军,刘代银,吴锦秀,伍菊仙,陈德春,杨文钰. 2009. 免耕高留茬抛秧对稻田土壤肥力和微生物群落的影响[J]. 应用生态学报,20(4):817-822. [Ren W J,Liu D Y,Wu J X,Wu J X,Chen D C,Yang W Y. 2009. Effects of returning straw to soil and different tillage methods on paddy field soil fertility and microbial population[J]. Chinese Journal of Applied Ecology,20(4):817-822.] doi:10. 13287/j.1001-9332.2009.0131.
盛锋. 2019. 稻鸭共育对稻田环境的影响及效益评估[D]. 武汉:华中农业大学. [Sheng F. 2019. Effects of rice-duck farming on rice field environment and its benefit evaluation[D]. Wuhan:Huazhong Agricultural University.] doi:10.27158/d.cnki.ghznu.2019.000026.
佀国涵,彭成林,徐祥玉,赵书军,徐大兵,袁家富,贾平安,刘军. 2016. 稻—虾共作模式对涝渍稻田土壤微生物群落多样性及土壤肥力的影响[J]. 土壤,48(3):503-509. [Si G H,Peng C L,Xu X Y,Zhao S J,Xu D B,Yuan J F,Jia P A,Liu J. 2016. Effects of rice-crayfish integrated mode on soil microbial functional diversity and fertility in waterlogged paddy field[J]. Soils,48(3):503-509.] doi:10.13758/j.cnki.tr.2016.03.013.
佀國涵,袁家富,彭成林,夏贤格,程建平,徐祥玉,贾平安,谢媛圆,周剑雄. 2019. 稻虾共作模式氮和磷循环特征及平衡状况[J]. 中国生态农业学报,27(9):1309-1318. [Si G H,Yuan J F,Peng C L,Xia X G,Cheng J P,Xu X Y,Jia P A,Xie Y Y,Zhou J X. 2019. Nitrogen and phosphorus cycling characteristics and balance of the integrated rice-crayfish system[J]. Chinese Journal of Eco-Agriculture,27(9):1309-1318.] doi:10.13930/j.cnki.cjea.190088.
宋光同,何吉祥,吴本丽,陈静,夏国钧,汪翔,武松. 2017. 中华鳖与两个水稻品种共作比较与效益分析[J]. 水产科技情报,44(1):46-49. [Song G T,He J X,Wu B L,Chen J,Xia G J,Wang X,Wu S. 2017. Comparison and benefit analysis of co-cultivation of Chinese turtle and two rice varieties[J]. Fisheries Science & Technology Information,44(1):46-49.] doi:10.16446/j.cnki.1001-1994.2017.01.011.
佟德利,許璐,于鑫,贺海升,张颖. 2019. 稻蟹生态种养对水稻根际微生物区系的影响[J]. 沈阳师范大学学报(自然科学版), 37(3):232-235. [Tong D L,Xu L,Yu X,He H S,Zhang Y. 2019. Differdeces of rhizosphere microflora between rice-planting and crab-raising system and normal rice-planting system[J]. Journal of Shenyang Normal University (Natural Science Edition),37(3):232-235.] doi:10.3969/j.issn.1673-5862.2019.03.009.
王昂,戴丹超,马旭洲,牟群,于永清,吕为群. 2019. 稻蟹共作模式对土壤微生物量氮和酶活性的影响[J]. 江苏农业学报,35(1):76-84. [Wang A,Dai D C,Ma X Z,Mou Q,Yu Y Q,Lü W Q. 2019. Effects of rice-crab culture system on soil microbial biomass nitrogen and soil enzymes activities[J]. Jiangsu Journal of Agricultural Scien-ces,35(1):76-84.] doi:10.3969/j.issn.1000-4440.2019. 01.011.
王光华,刘俊杰,于镇华,王新珍,金剑,刘晓冰. 2016. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报,32(2):14-20. [Wang G H,Liu J J,Yu Z H,Wang X Z,Jin J,Liu X B. 2016. Research progress of acidobacteria ecology in soils[J]. Biotechnology Bulletin,32(2):14-20.] doi:10.13560/j.cnki.biotech.bull.1985.2016.02.002.
王欢,赵文,谢在刚,魏杰,姜洋. 2018. 碧流河水库细菌群落结构特征及其关键驱动因子[J]. 环境科学,39(8):3660-3669. [Wang H,Zhao W,Xie Z G,Wei J,Jiang Y. 2018. Bacterial community structure characteristics in the biliuhe reservoir and its key driving factors[J]. Environmental Science,39(8):3660-3669.] doi:10.13227/j.hjkx.2017 11022.
王娟. 2015. 稻田土壤碳氮转化与微生物群落结构及活性之间的联系机制[D]. 杭州:浙江大学. [Wang J. 2015. The relationship of microbial community structure and activity to carbon and nitrogen transformations in paddy soil[D]. Hangzhou:Zhejiang University.]
王蓉,朱杰,金涛,刘章勇. 2019. 稻虾共作模式下稻田土壤氨氧化微生物丰度和群落结构的特征[J]. 植物营养与肥料学报,25(11):1887-1899. [Wang R,Zhu J,Jin T,Liu Z Y. 2019. Characteristics of ammonia oxidation microbial abundance and community structure in paddy soils of rice-crayfish symbiosis farming system[J]. Journal of Plant Nutrition and Fertilizers,25(11):1887-1899.] doi:10.11674/zwyf.18414.
吴雪. 2012. 稻鱼系统养分循环利用研究[D]. 浙江:浙江大学. [Wu X. 2012. The utilization of nutrients in traditio-nal rice-fish co-culture system[D]. Zhejiang:Zhejiang University.]
杨飞翔,黄璜,陈灿,常培恩,欧林志. 2019. 稻鳖共作模式中的土壤养分动态变化及产量形成[J]. 作物研究,33(5):402-407. [Yang F X,Huang H,Chen C,Chang P E,Ou L Z. 2019. Dynamic changes of soil nutrients and yield formation in rice-turtle model[J]. Crop Research,33(5):402-407.] doi:10.16848/j.cnki.issn.1001-5280.2019.05.14.
袁红朝,吴昊,葛体达,李科林,吴金水,王久荣. 2015. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报,26(6):1807-1813. [Yuan H C,Wu H,Ge T D,Li K L,Wu J S,Wang J R. 2015. Effets of long-term fertilization on bacterial and archaneal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology,26(6):1807-1813.] doi:10.13287/j.1001-9332.20150413.008.
張静,蒋业林,王士梅,侯冠军,王芬,张国前,王庆健. 2016. 稻鳖鱼共生系统种养技术研究与效益分析[J]. 安徽农学通报,22(21):77-79. [Zhang J,Jiang Y L,Wang S M,Hou G J,Wang F,Zhang G Q,Wang Q J. 2016. The construction of integrated rice-chinese soft shelled turtle-fish ecosystem and studies on the technology[J]. Anhui Agricultural Science Bulletin, 22(21):77-79.] doi:10.16377/j.cnki.issn1007-7731.2016.21.031.
张军,刘菁,陈长青. 2020. 有机稻鸭共作对土壤理化性状和细菌群落空间分布的影响[J]. 生态学杂志,39(3):822-829. [Zhang J,Liu J,Chen C Q. 2020. Effects of organic rice-duck farming on soil physicochemical properties and spatial distribution of bacterial community[J]. Chinese Journal of Ecology,39(3):822-829.] doi:10.13292/j. 1000-4890.202003.007.
张开礼. 2019. 稻鳖综合种养技术[J]. 河南水产,(5):15-16. [Zhang K L. 2019. Integrated rice-turtle breeding technology[J]. Henan Fisheries,(5):15-16.]
张晟,张徐洁,赵远,张玉虎,胡茜,荆玉林,符菁. 2019. 不同温度制备的水稻秸秆生物炭对稻田土壤固碳减排及微生物群落结构的影响[J]. 江苏农业学报,35(5):1102-1111. [Zhang S,Zhang X J,Zhao Y,Zhang Y H,Hu Q,Jing Y L,Fu J. 2019. Effects of rice straw biochar prepared at different pyrolysis temperatures on carbon sequestration and mitigation and microbial community structure in paddy soil[J]. Jiangsu Journal of Agricultural Sciences,35(5):1102-1111.] doi:10.3969/j.issn.1000-4440.2019.05.015.
张宇亭. 2017. 长期施肥对土壤微生物多样性和抗生素抗性基因累积的影响[D]. 重庆:西南大学. [Zhang Y T. 2017. The effect of long-term fertilization on soil microbial diversity and the accumulation of antibiotic resistance genes[D]. Chongqing:Southwest University.]
赵翔刚,罗衡,刘其根,赵良杰,蔡林荣,戴亮亮,张真. 2017. 稻田养殖沙塘鳢对稻田水体及底泥微生物群落结构及多样性的影响[J]. 淡水渔业,47(4):8-14. [Zhao X G,Luo H,Liu Q G,Zhao L J,Cai L R,Dai L L,Zhang Z. 2017. Influence of the cultured Odontobutis obcurus to the microbial community structure and diversity in rice-fish system[J]. Freshwater Fisheries,47(4):8-14.] doi:10.3969/j.issn.1000-6907.2017.04.003.
周爱珠,刘才高,徐刚勇,黄永明. 2014. 稻、鳖共生高效生态种养模式探讨[J]. 中国稻米,20(3):73-74. [Zhou A Z,Liu C G,Xu G Y,Huang Y M. 2014. Discussion of efficient and ecological rice turtle symbiosis planting pattern[J]. China Rice,20(3):73-74.] doi:10.3969/j.issn.1006-8082.2014.03.018.
朱超,Stefan Ratering,曲东,Sylvia Schnell. 2011. 短期淹水培养对水稻土中地杆菌和厌氧粘细菌丰度的影响[J]. 生态学报,31(15):4251-4260. [Zhu C,Ratering S,Qu D,Schnell S. 2011. Effects of short-term flooding on Geobacteraceae spp. and Anaeromyxobacter spp. abundance in paddy soil[J]. Acta Ecologica Sinica,31(15):4251-4260.]
朱永官,沈仁芳,贺纪正,王艳芬,韩兴国,贾仲君. 2017. 中国土壤微生物组:进展与展望[J]. 中国科学院院刊,32(6):554-565. [Zhu Y G,Shen R F,He J Z,Wang Y F,Han X G,Jia Z J. 2017. China soil microbiome initiative:Progress and perspective[J]. Bulletin of the Chinese Academy of Sciences,32(6):554-565.] doi:10.16418/j.issn.1000-3045.2017.06.002.
Adler C J,Dobney K,Weyrich L S,Kaidonid J,Walker A W,Haak W,Bradshaw C J A,Townsend G,Soltysiak A,Alt K W,Parkhill J,Cooper A. 2013. Sequencing ancient calcified dental plaque shows changes in oral microbiota with dietary shifts of the Neolithic and Industrial revolutions[J]. Nature Genetics,45(4):450-455. doi:10.1038/ng.2536.
Bokulich N A,Sathish S,Faith J J,Gever D,Gordon J I,Knight R,Mills D A,Caporaso J G. 2013. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods,10(1):57-59. doi:10. 1038/nmeth.2276.
Cardinale B J,Srivastava D S,Duffy J E,Wright J P,Dow-ning A J,Sankaran M,Jouseau C. 2006. Effects of biodiversity on the functioning of trophic groups and ecosystems[J]. Nature,443(7114):989-992. doi:10.1038/nature05202.
Cohan F M. 2002. What are bacterial species?[J]. Annual Review of Microbiology,56:457-487. doi:10.1146/annurev.micro.56.012302.160634.
Edgar R C,Haas B J,Clemente J C,Quince C,Knight R. 2011. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics,27(16):2194-2200. doi:10. 1093/bioinformatics/btr381.
Jangid K,Williams M A,Franzluebbers A J,Sanderlin J S,Reeves J K,Jenkins M B,Endale D M,Coleman D C,Whitman W B. 2008. Relative impacts of land-use,ma-nagement intensity and fertilization upon soil microbial community structure in agricultural systems[J]. Soil Bio-logy and Biochemistry,40(11):2843-2853. doi:10.1016/j.soilbio.2008.07.030.
Kirchman D L,Cottrell M T,Lovejoy C. 2010. The structure of bacterial communities in the western Arctic Ocean as revealed by pyrosequencing of 16S rRNA genes[J]. Environmental Microbiology,12(5):1132-1143. doi:10.1111/j.1462-2920.2010. 02154.x.
Lauber C L,Strickland M S,Bradford M A,Fierer N. 2008. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology and Biochemistry,40(9):2407-2415. doi:10.1016/ j.soilbio.2008.05.021.
Lu L,Li H L,He Y,Zhang J,Xiao J,Peng C. 2018. Compositional shifts in ammonia-oxidizing microorganism communities of eight geographically different paddy soils—Biogeographical distribution of ammonia-oxidizing microorganisms[J]. Agricultural Sciences,9(3):351-373. doi:10.4236/as.2018.93025.
Lundberg D S,Yourstone S,Mieczkowski P,Jones C D,Dangl J L. 2013. Practiacl innovations for high-throughput amplicon sequencing[J]. Nature Methods,10(10):999-1002. doi:10.1038/nmeth.2634.
Pretty J. 2008. Agricultural sustainability:Concepts,principles and evidence[J]. Philosophical Transactions of the Royal Society of London. Series B:Biological Sciences,363(1491):447-465. doi:10.1098/rstb.2007.2163.
Stubner S. 2002. Eneration of 16S rDNA of Desulfotomaculum lineage 1 in rice field soil by real-time PCR with SybrGreen detection[J]. Journal of Microbiological Me-thods,50(2):155-164. doi:10.1016/s0167-7012(02)000 24-6.
Winding A,Hund-Rinke K,Rutgers M. 2005. The use of microorganisms in ecological soil classification and assessment concepts[J]. Ecotoxicology and Environmental Safety,62(2):230-248. doi:10.1016/j.ecoenv.2005.03.026.
(責任编辑 兰宗宝)

