酶联免疫吸附法快速检测黄曲霉毒素
张宁,赵志琴,范志华,2*,郝建祥,刘珊娜,2,孙溪,2
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
黄曲霉毒素(aflatoxins,AF)是所有天然物质中毒性最强,且是目前世界范围内公认的致癌性最强的真菌类毒素[1]。根据联合国粮农组织的分析估计,每年在全世界的谷物中,至少有四分之一受到了AF污染。目前鉴定出的AF有10多种,受污染的食品中主要检测的项目以黄曲霉毒素B1(aflatoxin B1,AFB1)最为常见,动物体摄入AFB1后,经过体内代谢转化可产生黄曲霉毒素M1(aflatoxin M1,AFM1)、黄曲霉毒素M2(aflatoxin M2,AFM2)这两种代谢产物,会存在于乳液、蛋类、血液、肝脏、肌肉等可食用组织中[2]。其中以乳制品残留情况最为突出。随着世界各国对黄曲霉毒素检测限量标准要求的不断提高,迫切需要研发适合我国快速筛查、精确测定的检测手段。目前市面上快速检测黄曲霉毒素的方法存在灵敏度较低、变异较大、添加回收不稳定、假阳性等问题,检测的方法步骤还有待优化。本试验通过饲料、豆粕、玉米面、调料制品、食用油、调制乳、猪肉、牛肉、火腿肠等为检测样品,研究改进后的酶联免疫吸附技术(enzyme-linked immunosorbent assay,ELISA)检测黄曲霉毒素的方法是否具有可行性。
1 材料与方法
1.1 主要材料与试剂
康宁96孔酶标板(8孔/条×12条)、盖板膜、辣根过氧化物酶试剂盒:北京索莱宝科技有限公司;AFB1高浓度标准品:北京中科质检生物技术有限公司;酶标二抗、抗原(antigen,Ag)、抗体(antibody,Ab):维德维康生物技术有限公司;底物A、B液、氯化钾、磷酸二氢钾、氯化钠、磷酸二氢钠、乙酸乙酯、四甲基联苯胺、二甲基亚枫(分析纯):国药集团有限公司。各类待检样本、脱脂奶粉:市售。
1.2 仪器与设备
TTL-DC氮吹仪:北京同泰联科技发展有限公司;Multiskan-FC酶标仪:赛默飞世尔仪器有限公司;Thermo-Fisher落地式高速冷冻离心机:Thermo Electron公司;LPD2500多管漩涡混合仪:莱普特科学仪器有限公司;SH-2(A)SH微孔板脱水仪:北京双和盛源科技发展中心;KF-806L有机相去除器:上海共济科华实验仪器有限公司。
1.3 试验方法
1.3.1 黄曲霉毒素抗原、抗体的制备
抗原的制备过程:小分子物质AFB1本身无活性基团,没有免疫原性,需要通过引入羧基,采用活性酯法,与蛋白质的氨基偶联成完全抗原AFB1。
抗体制备过程:用磷酸盐缓冲液(phosphate buffered saline,PBS)将冷冻干燥后的抗原(AFB1)以液料比 10 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1(mL/g)分别溶解,充分乳化注射免疫小鼠,10 d后从眼眶取血,样本进行静置、凝固、离心等操作后取上层血清。选择阴性血清吸光度OD值接近0,经过检测效价可以达到较高的水平。抗体的效价越高则表明质量越好[4]。
1.3.2 抗原的包被与封闭
采取方阵法,使用96孔康宁酶标版,根据测定的OD值选择出抗原的饱和浓度。根据OD值在1.0左右时所对应的抗体稀释倍数,作为最佳的稀释倍数[5]。
在包被液中加入最佳抗原浓度包被酶标板,稀释5×103倍,磁力搅拌 1 h,静置 30 min,湿度 30%,温度25℃,在每个酶标板孔中加入120 μL含有抗原的包被液,盖上盖板膜,4℃的环境下放置20 h,甩去包被液,洗涤两次,30 s/次,放入脱水仪中甩干。采用与包被时相同的加液方式,每孔加入240 μL含有牛血清蛋白的封闭液,轻轻振荡10 s,盖上盖板膜,放置在37℃的电热恒温培养箱中,温育1.5 h,甩出封闭液,洗涤1次,振荡10 s,静置1 min,在脱水仪中甩干,37℃干燥4 h,真空密封酶标板。
1.3.3 标准溶液的制备
用AFB1标准品缓冲液稀释浓度为10 μg/mL的高浓度标准品基准溶液[6],配制浓度分别为0、0.03、0.09、0.27、0.81、2.43 μg/L 的标准品梯度溶液,在酶标板中滴加反应,以空白对照,测定时标准品梯度溶液为每孔50 μL,以浓度为横坐标,抑制率为纵坐标绘制标准曲线。得出抑制率(y)与浓度(x)的线性方程为y=-18.059lnx+16.355,相关系数 R2=0.991 26,拐点数为2,最低检测浓度为0.03 μg/L,线性系数范围0.03 μg/L~2.43 μg/L,IC50为 0.084 μg/L。
1.3.4 抗体与酶标二抗的准备
将抗体用专用稀释液稀释2×105倍,振荡5 min,25℃静置1 h后放置4℃保存。在酶标二抗的棕色玻璃瓶中依次加入1.2 mL超纯水和0.8 mL丙三醇溶剂。将酶标二抗专用酶稀释液稀释850倍,配制成酶标二抗工作液,4℃放置保存。检测时酶标二抗和抗体的添加量均为 50 μL。
1.3.5 样品前处理
本试验通过对饲料、豆粕、玉米面、调料制品、食用油、调制乳、猪肉、牛肉、火腿肠等样品进行检测,根据不同稀释倍数,称取一定量均质后的样品于离心管中,添加高标作阴性、阳性对照,加入样本提取液,进行涡动和离心(2 500 r/min转速下涡动60 s、4 700 r/min离心5 min)后具体操作步骤如下[7-8]。
饲料、豆粕、玉米面:样品稀释30倍。准确称取1 g均质后的样本于50 mL离心管中,每个管加入5 mL样本提取液,进行涡动和离心,取出分层的试样,吸取上层清液100 μL,加入到新的2 mL离心管中,然后用移液枪将每个小管加入400 μL超纯水,2 000 r/min涡动40 s,取 50 μL 进行点板检测。
食用油类:样品稀释30倍。取0.1mL食用油样品置入4 mL离心管里,每个管中加入1 mL正己烷和1 mL的样品稀释液,涡动和离心后去除分层试剂,用有机相去除器吸掉分层后的上层正己烷以及中间的杂质,取50 μL进行项目检测。
调料制品:样品稀释30倍。称取1 g的样品置入离心管中,加入5 mL乙腈后涡动离心,分层后取出100 μL上层清液,加入到新的2 mL离心管中,加正己烷1 mL,再加入400 μL的超纯水,之后进行同样的涡动操作和离心。分层液用去除器吸掉分层后的上层和中间层杂质,取50 μL进行项目检测。
调制乳:样品稀释2倍。每管取2 mL样品,加入相应的高浓度标准品作添加回收,按照顺序加入0.4 mL的ZnSO4溶液与6 mL乙酸乙酯与二氯甲烷的混合液,涡动和离心后取上层液1.5 mL到新的4 mL离心管中(使用氮吹仪在60℃水浴中吹干离心管),之后加2 mL正己烷和1 mL样品稀释液,充分高速涡动40 s,同样离心5 min。除去中间层以上的物质,移液枪吸取50 μL 点板检测。
1.3.6 洗板与显色终止
待标准品或样本反应30 min后将酶标板中的反应液甩掉,每孔添加量为260 μL洗涤液,静置20 s洗涤3次。洗涤完成后甩干酶标板,每孔添加量为100 μL底物A、B液和氧化剂的混合液,显色10 min~15 min呈现出蓝色后加入50 μL终止液迅速变黄色,立刻在双波长为450 nm和630 nm的酶标仪上进行检测分析。
2 结果与分析
2.1 抗原不同包被时间对检测结果的影响
在 4 ℃温度下分别包被抗原 10、15、20、25、30 h,添加配制好的标准品、抗体工作液、酶标二抗各50 μL,反应时间为30 min,底物显色15 min。检测结果见表1和图1所示。
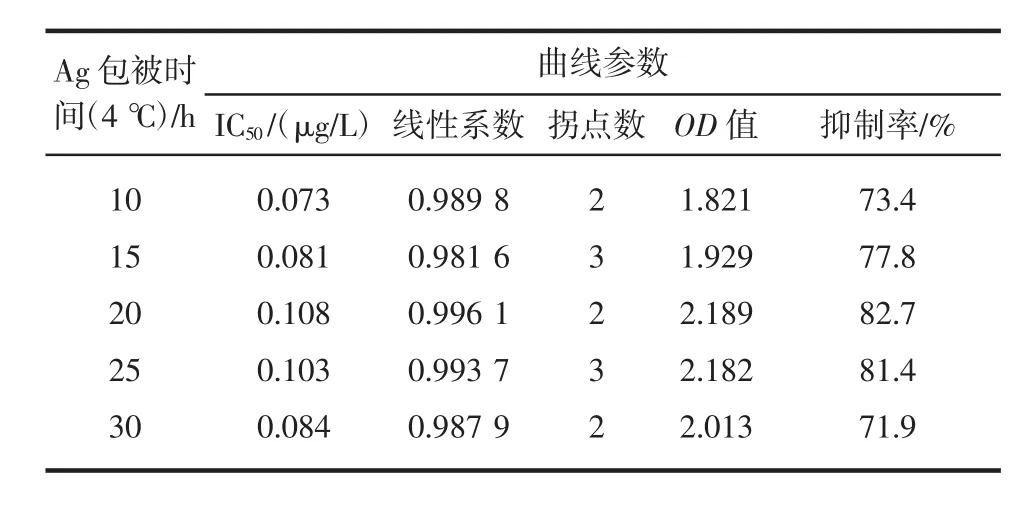
表1 抗原不同包被时间检测结果Table 1 Detection datas under different packet time
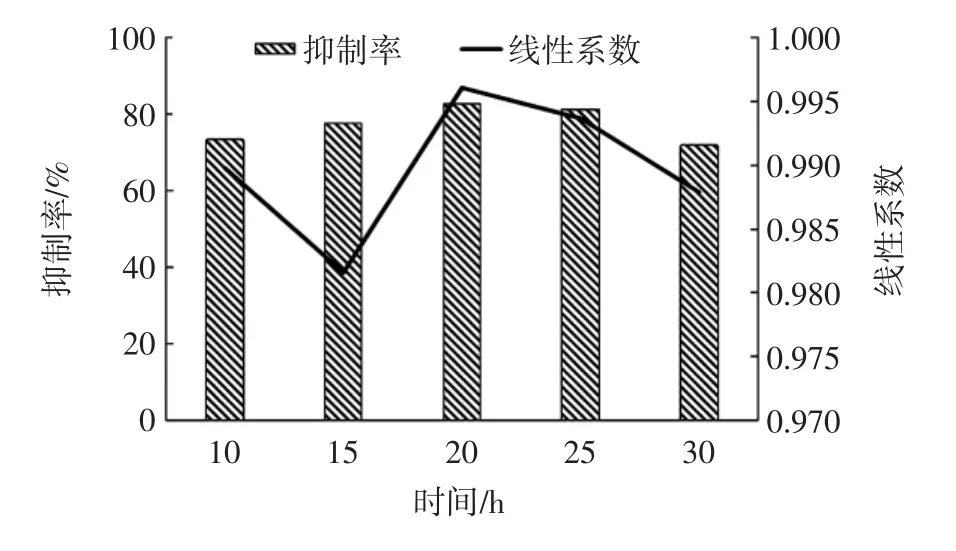
图1 包被不同时间对抑制率及线性系数的影响Fig.1 Effect of coating time on inhibition rate and linear coefficient
由表1和图1可以得出,抗原4℃下包被的最佳包被时间为20 h,此时,抑制率达到82.7%,线性系数为 0.996 1,IC50浓度达到 0.108 μg/L,OD 值达到2.189。
2.2 不同反应温度对检测结果的影响
待酶标板恢复至室温(25℃)后添加样本、抗体工作液、酶标二抗各 50 μL,分别在 16、20、24、28、32 ℃下进行反应30 min,显色15 min之后添加终止液,在酶标仪上采用双波长检测分析,结果如表2和图2所示。
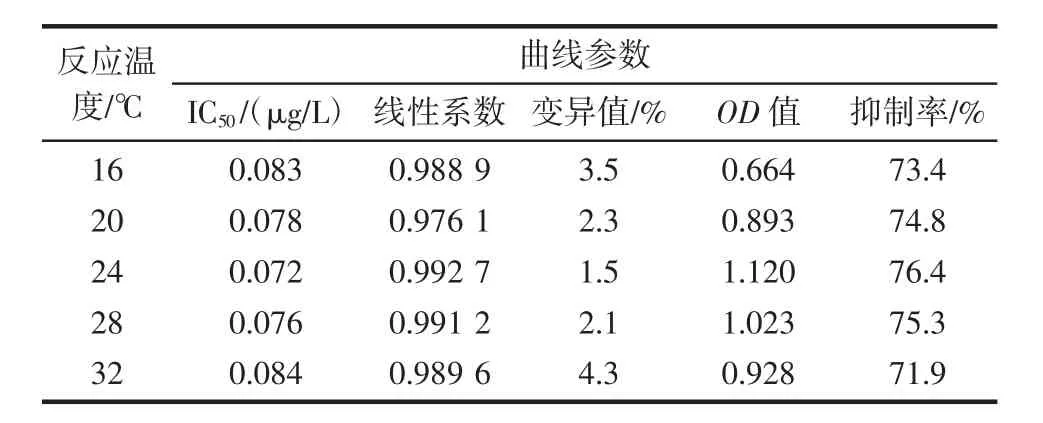
表2 不同反应温度的检测结果Table 2 Detection datas under different reaction temperatures
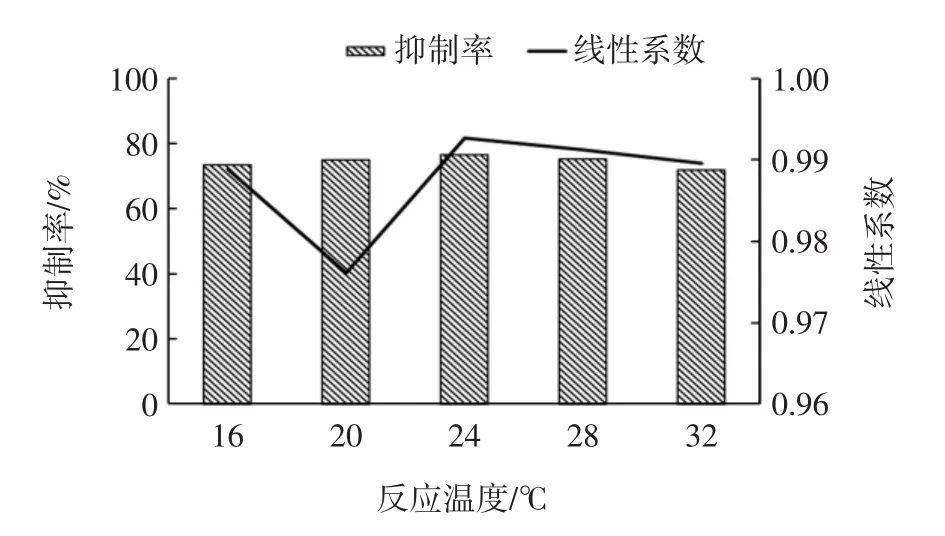
图2 不同反应温度对抑制率及线性系数的影响Fig.2 Effect of different reaction temperature on inhibition rate and linear coefficient
由表2、图2看出,随着温度升高,曲线OD值先升高后下降,但IC50较为稳定,抑制率会有10%以内的浮动,变异值均在5.0%以内。最佳反应温度为24℃,此时抑制率为76.4%,OD值1.120,线性系数为0.992 7,IC50为 0.072 μg/L。
2.3 酶标二抗作用时间对检测结果的影响
在酶标板中添加样本、抗体工作液、酶标二抗各50 μL,设置不同酶标抗体作用时间 15、20、25、30、35、40 min,之后加入底物显色,室温(25℃)下分别检测分析,结果见表3和图3。

表3 酶标二抗不同作用时间的检测结果Table 3 The results of enzyme mark II anti-action in different time

图3 酶标二抗不同作用时间对抑制率及线性系数的影响Fig.3 Effect of different time on inhibition rate and linear coefficient of enzyme-labeled double-antibody
如表3和图3所示,随着酶标二抗作用时间变化,IC50有一定的浮动,在酶标二抗反应30 min时,经过显色,在双波长下检测分析得出的曲线OD值最好,抑制率基本稳定,线性系数达最大值0.995 5。
2.4 不同显色时间对检测结果的影响
在已包被抗原的酶标板中添加标准品或样本、抗体工作液、酶标二抗各50 μL,反应30 min,加入底物和氧化剂 1 ∶1(体积比)混合液 100 μL,分别显色 6、9、12、15、18、21 min,室温(25 ℃)条件下采用双波长测定不同显色时间的OD值,各指标结果见表4和图4。
从表4、图4中可以看出,随着显色时间的延长,OD值在一定范围内呈线性趋势升高,但是拐点和线性会有变化。IC50在0.08 μg/L左右时抑制率有所升高,综合各因素考量得出最佳的显色时间为15 min。
2.5 优化条件后样本检测验证
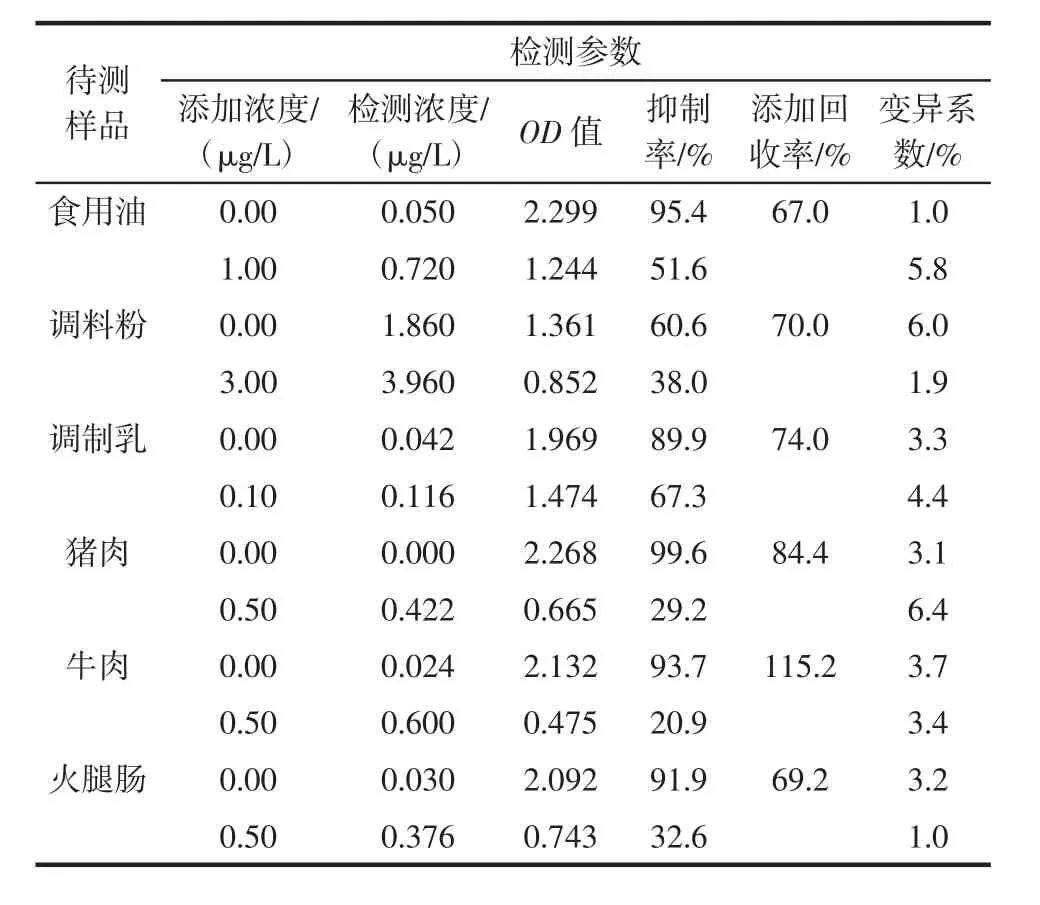
通过各变量之间的取舍,酶联免疫方法检测黄曲霉毒素的优化流程为:将包被黄曲霉毒素抗原的酶标板进行点板,25℃下加入样品及标准品、抗体液、酶标二抗各50 μL,反应30 min后加入260 μL洗涤液洗板3次,每次30 s,脱水仪甩干后立刻加入底物A、B混合溶液100 μL,显色15 min后加入50 μL终止液。在双波长450 nm和630 nm酶标仪检测分析。采用该流程对豆粕、玉米面、调料制品、食用油、调制乳、猪肉、牛肉、火腿肠等11种样本检测验证,数据如表5所示。对检测样本的抑制率、回收率及OD值进行比较,结果如图5所示。

表4 不同显色时间的检测结果Table 4 Test results of different color developing time
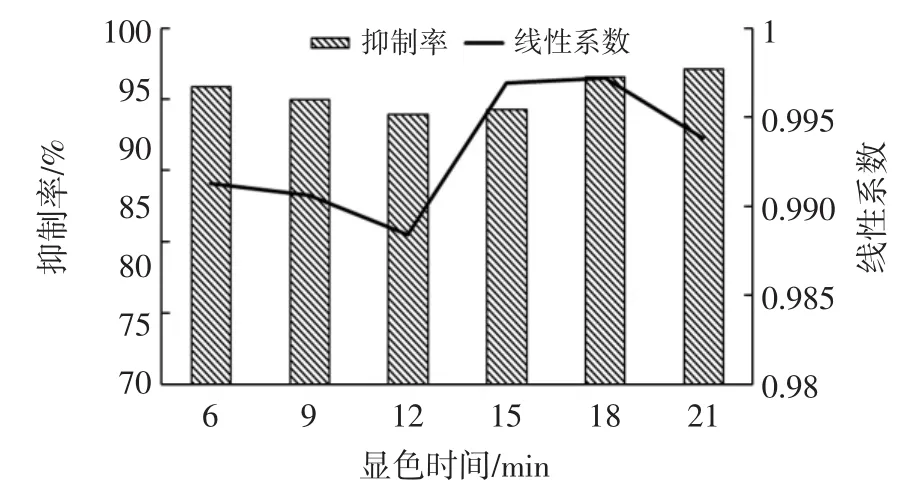
图4 不同显色时间对抑制率及线性系数的影响Fig.4 Comparison of the parameters in different time of the second anti-action of enzyme mark

表5 各类样本检测结果Table 5 Test results of different types of samples
续表5 各类样本检测结果Continue table 5 Test results of different types of samples

图5 检测比较各类样本抑制率、回收率及OD值的结果Fig.5 Comparison with various samples of inhibition rate,recovery rate and OD value
由表5、图5可知,检测各类样本的抑制率在20.9%~67.3%之间,添加回收率在67%~116%之间。其中,调制乳的OD值和抑制率最高,但回收率偏低;饲料和牛肉的OD值不高,但是回收率超过100%;其它样本的回收率在67.0%~90.4%。综合来看,添加回收效果表现良好。
3 结论
通过对黄曲霉毒素抗原和抗体的制备提纯,利用方阵棋盘法确定抗原的最适包被稀释倍数为5×103,抗体的稀释倍数为2×105。而抗原包被时间、反应温度、酶标二抗作用时间、底物显色时间等是造成OD值变化的主要因素。采用ELISA的间接竞争方法确定最佳抗原包被时间为20 h、反应温度为24℃左右、酶标二抗作用时间为30 min、底物显色时间为15 min。
通过对饲料等11种样品的检测,在方法经过改进优化后计算得出:添加回收率在67%~116%之间,操作的变异系数在0.3%~6.4%之间,线性系数基本在0.99以上,IC50基本在0.1μg/L以下,板内变异在5%以内,板间变异在10%以内,各项检测参数符合要求,表明改进后的ELISA检测黄曲霉毒素的试验方法具有可行性。
本试验方法可在50 min~100 min完成检测,缩短反应时间,提高检测效率,结合其性能稳定、特异性强、操作便捷、灵敏度高的优点。可以作为检测大批量样本中黄曲霉毒素的一种可行性的方法。

