液液萃取–气相色谱–质谱法测定水中19 种苯胺类化合物
李婧,高翔宇,高文旭,康文贵,张利
(西安西北有色地质研究院有限公司,西安 710054)
苯胺类化合物属于半挥发性有机污染物,是重要的化工中间体,广泛应用于化工、制药和印染等工业[1-2]。苯胺及其衍生物具有特殊的气味,毒性较大,可通过呼吸道、消化道进入人体,也可通过皮肤被人体迅速吸收,部分苯胺类物质对人体有致癌、致畸、致细胞突变作用[3-5],目前苯胺类物质已被列入我国14 类环境优先污染物黑名单中。因此,建立一种准确高效、环境友好的苯胺类有机污染物测定方法,对其分布监测以及后续治理都具有重要的意义。
水样中苯胺类化合物的测定方法主要有分光光度法[6]、气相色谱法[7-9]、气相色谱-质谱法[10]、高效液相色谱法[11-12]、高效液相色谱-质谱法[13]等。其中分光光度法仅能测定苯胺及其芳香苯胺类化合物的总量,不能对每一个苯胺类物质进行准确定性定量测量,且容易受被测水样色度、共存离子等影响,灵敏度较低;高效液相色谱法选择性差,流动相成本较高,且水体中酚类化合物会对测定结果有干扰;高效液相色谱-质谱法价格昂贵,在环境监测系统种应用很少;气相色谱-质谱法灵敏度较高,选择性好,能对水样中低浓度的苯胺类物质进行准确的定性定量分析。目前,已有文献报道采用气相色谱-质谱法测定水中苯胺类化合物,但回收率都较低,且可检测的苯胺类化合物种类较少[14-15]。因此笔者选择气相色谱-质谱法,通过对液液萃取条件和色谱分析条件进行比较和筛选,针对回收率较低设计光化学反应实验,模拟天然水体中苯胺类化合物的光降解,大大提高了苯胺类化合物的回收率,建立了测定水中19 种苯胺类化合物的方法。
1 实验部分
1.1 主要仪器与试剂
气相色谱-质谱仪:Agilent 5977-7890B 型,配自动进样器,美国安捷伦科技有限公司。
平行浓缩仪:Multi Vap-10 型,北京莱伯泰科仪器股份有限公司。
全自动高通道量柱式固相萃取仪:SPE1000-3型,北京莱伯泰科仪器股份有限公司。
电子天平:SQP 型,感量为0.1 mg,赛多利斯科学仪器(北京)有限公司。
19 种苯胺类化合物(苯胺、2-氯苯胺、3-氯苯胺、4-氯苯胺、4-溴苯胺、2-硝基苯胺、2,4,6-三氯苯胺、3,4-二氯苯胺、3-硝基苯胺、2,4,5-三氯苯胺、4-氯-2-硝基苯胺、4-硝基苯胺、2-氯-4-硝基苯胺、2,6-二氯-4-硝基苯胺、2-溴-6-氯-4-硝基苯胺、2-氯-4,6-二硝基苯胺、2,6-二溴-4-硝基苯胺、2,4-二硝基苯胺、2-溴-4,6-二硝基苯胺)标准溶液:质量浓度均为1 000 μg/mL,编号为F3030010,溶剂为二氯甲烷,上海ANPEL 公司;
苯胺-d5 替代物标准溶液:质量浓度为2 000 μg/mL,编号为380199,溶剂为二氯甲烷,美国o2 si 公司。
1,2-二氯苯-d4 内标溶液:质量浓度为2 000 μg/mL,编号为C2320015,溶剂为二氯甲烷,上海ANPEL 公司。
菲-d10 内标溶液:质量浓度为500 μg/mL,编号为C2320015,溶剂为二氯甲烷,上海ANPEL 公司。
二氯甲烷、异丙醇、正己烷:均为色谱级,成都科隆化学品有限公司。
甲醇:农残级,德国CNW 公司。
无水硫酸钠、氯化钠:均为优级纯,400 ℃烘烤4 h,保存于干燥器中,天津市科密欧化学试剂有限公司。
氢氧化钠:优级纯,成都市科隆化学品有限公司。
实验用水为超纯水(不含有机物)。
1.2 溶液配制
苯胺-d5 替代物储备液:20 μg/mL,准确移取0.10 mL 苯胺-d5 替代物标准溶液于10.0 mL 棕色容量瓶中,用二氯甲烷定容至标线,摇匀。
内标物标准储备液:10 μg/mL,分别准确移取0.05 mL 1,2-二 氯 苯-d4 内 标 溶 液 和0.20 mL菲-d10 内标溶液于10.0 mL 棕色容量瓶中,用二氯甲烷定容至标线,摇匀。
19 种苯胺类标准储备液(含替代物):20 μg/mL,分别准确移取0.20 mL 19 种苯胺类化合物标准溶液和0.10 mL 苯胺-d5 替代物标准溶液于10.0 mL棕色容量瓶中,用二氯甲烷定容至标线,摇匀。
19 种苯胺类标准工作液:分别准确移取0.40、1.00、2.50 mL 19 种苯胺类化合物标准储备液(含替代物)和1.00 mL 内标物标准储备液于3 只10.0 mL棕色容量瓶中,用二氯甲烷定容至标线,摇匀,制备成质量浓度分别为0.4、1.0、2.5 μg/mL 标准工作液。
系列混合标准工作液(含替代物):分别移取19 种苯胺类标准储备液(含替代物)0.10、0.25、0.50、1.00、1.50、2.50 mL 置于6 只10.0 mL 棕色容量瓶中,再分别加入1.00 mL 10 μg/mL 内标物标准储备液,用二氯甲烷定容至标线,配制成19 种苯胺类化合物质量浓度均分别为0.2、0.5、1.0、2.0、3.0、5.0 mg/L 的系列混合标准工作溶液(含替代物)。
1.3 样品采集与保存
按照GB 17378、HJ/T 91、HJ/T 164 的相关规定进行水样采集,样品贮存于棕色玻璃瓶中并充满样品瓶,不留空隙。样品采集后立即加入氢氧化钠溶液或硫酸溶液,调节pH 6~8,于4 ℃冷藏保存。如水样中有余氯,每1 000 mL 样品中加入80 mg 硫代硫酸钠溶液。水样中的苯胺类化合物易降解,应尽快测定,若不能及时测定,应将样品保存于4 ℃冰箱中。采集的样品应在24 h 内萃取,萃取后的样品在40 d 内分析。
1.4 样品预处理
中性萃取:准确量取1 000 mL 水样于分液漏斗中,加入30 g 氯化钠,轻轻振摇至氯化钠溶解,调节pH 7~8,加入100.0 μL 20.0 mg/L 苯胺-d5 替代物工作液作为回收指示物,混合均匀,加入60 mL二氯甲烷,振摇萃取10 min,静置5 min,两相分层,收集有机相至三角烧瓶。继续加入60 mL 二氯甲烷至水相,重复萃取2 次,有机相合并至三角烧瓶中,用适量(大于3 g)无水硫酸钠过滤脱水,上氮吹仪浓缩,加入0.1 mL 10 μg/mL 内标物标准储备液,用二氯甲烷定容至1 mL,待测。
碱性萃取:准确量取1 000 mL 水样于分液漏斗中,加入30 g 氯化钠,轻轻振摇至氯化钠溶解,用pH 剂调节pH 大于11,加入100.0 μL 20.0 mg/L苯胺-d5 替代物工作液(回收指示物),混合均匀,加入60 ml 二氯甲烷,振摇萃取10 min,静置5 min,两相分层,收集有机相至三角烧瓶。继续加入60 mL 二氯甲烷至水相,重复萃取2 次,有机相合并至三角烧瓶中,用适量(大于3 g)无水硫酸钠过滤脱水,上氮吹仪浓缩,加入0.1 mL 10 μg/mL 内标物标准储备液,用二氯甲烷定容至1 mL 待测。
1.5 仪器工作条件
1.5.1 气相色谱条件
色谱柱:DB-5MS 型色谱柱(30 m×0.32 mm,0.25 μm,美国安捷伦科技有限公司);进样口温度:260 ℃;进样方式:无分流进样;进样量1.0 μL;载气:氦气;流量:1.00 mL/min;设置程序升温:初始温度为40 ℃,保持2 min,以5 ℃/min 的速率升温至100 ℃,再以10 ℃/min 的速率升温至200 ℃,保持8 min,最后以35 ℃/min 的速率升温至280 ℃。
1.5.2 质谱条件
离子源:EI 源;离子源温度:230 ℃;离子化能量:70 ev。接口温度:260 ℃。扫描范围:m/z 35~500 amu;溶剂延迟时间:9.0 min;采用质谱图结合保留时间定性,选择离子定量。
2 结果与讨论
2.1 萃取剂的选择
苯胺类化合物属半挥发极性分子,可选择疏水性溶剂做液液萃取法的萃取剂,利用被测组分在溶剂与水之间的溶解度差异进行萃取。二氯甲烷对非极性到极性范围的化合物都有较高的萃取能力,沸点低,萃取后易于浓缩,密度比水大,分液操作容易,且不易燃,适用于多组分同时分析。因此,本研究选择二氯甲烷作为前处理萃取剂。
2.2 色谱条件的选择
2.2.1 升温程序
通过改变升温速率和初始柱温探究升温程序对分离效果的影响,设计4 种条件进行试验。
(a):初始温度为40 ℃,保持1 min,以10 ℃/min的速率升至100 ℃,再以30 ℃/min 的速率升至280 ℃,保持5 min[5]。
(b):初始温度为40 ℃,保持5 min,以5 ℃/min的速率升温至100 ℃,再以10 ℃/min 的速率升温至200 ℃,保持8 min,最后以30 ℃/min 的速率升温至280 ℃[16]。
(c):初始温度为60 ℃,保持5 min,以5 ℃/min的速率升温至100 ℃,再以10 ℃/min 的速率升温至200 ℃,保持8 min,最后以30 ℃/min 的速率升温至280 ℃。
(d):初始温度为40 ℃,保持2 min,以5 ℃/min的速率升温至100 ℃,再以10 ℃/min 的速率升温至200 ℃,保持8 min,最后以35 ℃/min 的速率升温至280 ℃。
试验发现,条件(a)中11 min 后升温速率过快,部分苯胺类物质色谱峰重叠,无法分离,因此需降低升温速率;采用条件(b),除过苯胺-d5 与苯胺以及4-氯-2 硝基苯胺与4-硝基苯胺分离不完全,其余物质均完全分离;为尽量缩短分离时间,考察条件(c),在初始柱温为60 ℃的条件下,3-氯苯胺和4-氯苯胺峰形有重叠,分离效果较差;考察条件(d),除过苯胺-d5 与苯胺以及4-氯-2 硝基苯胺与4-硝基苯胺分离不完全,其余物质均完全分离,且分离时间较条件(b)短,适用于实际样品的分析检测。因此本实验采用条件(d)作为升温程序。
2.2.2 色谱柱的选择
选择美国安捷伦科技有限公司DB-5MS 型 (30 m×0.25mm,0.25 μm,5%二苯基-95%二甲基聚硅氧烷石英毛细色谱柱)和DB-35MS 型[30 m×0.25 mm,0.25 μm,(35%苯基)-甲基聚硅氧烷石英毛细色谱柱]两种色谱柱对1.2 中1.0 μg/mL 19 种苯胺类标准工作液的22 种化合物(包括19 种苯胺类目标物、1 种替代物和2 种内标物)进行分离检测。试验结果表明优化色谱条件后DB-5MS 柱可以达到预期的分离效果,缺点是苯胺-d5 与苯胺以及4-氯-2 硝基苯胺与4-硝基苯胺分离不完全,但可以通过定量离子进行定量分析;DB-35MS 柱对19 种苯胺类目标物完全分离,但通用性不强。因此最终采用DB-5MS 柱,总离子流色谱图如图1 所示。
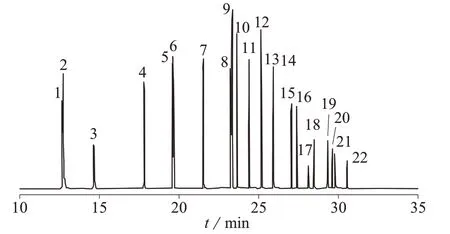
图1 苯胺类化合物的总离子流色谱图
2.2.3 pH 对回收率的影响
苯胺类化合物属于碱性物质,在酸性条件下可形成稳定的苯胺盐,具有较强的亲水性,用有机溶剂萃取时萃取效率较低,且其中部分化合物属于弱盐基性。参考EPA 8270 中“在pH 6~8 时进行萃取”,取6 份1.2 中1.0 μg/mL 19 种苯胺类标准工作液,分3 组,分别在中性、碱性、先中性后碱性的条件下进行萃取,后进样分析,考察回收率和pH 的关系,结果列于表1。由表1 可知,在先中性后碱性条件下19 种苯胺类化合物回收率最高,萃取效率好。
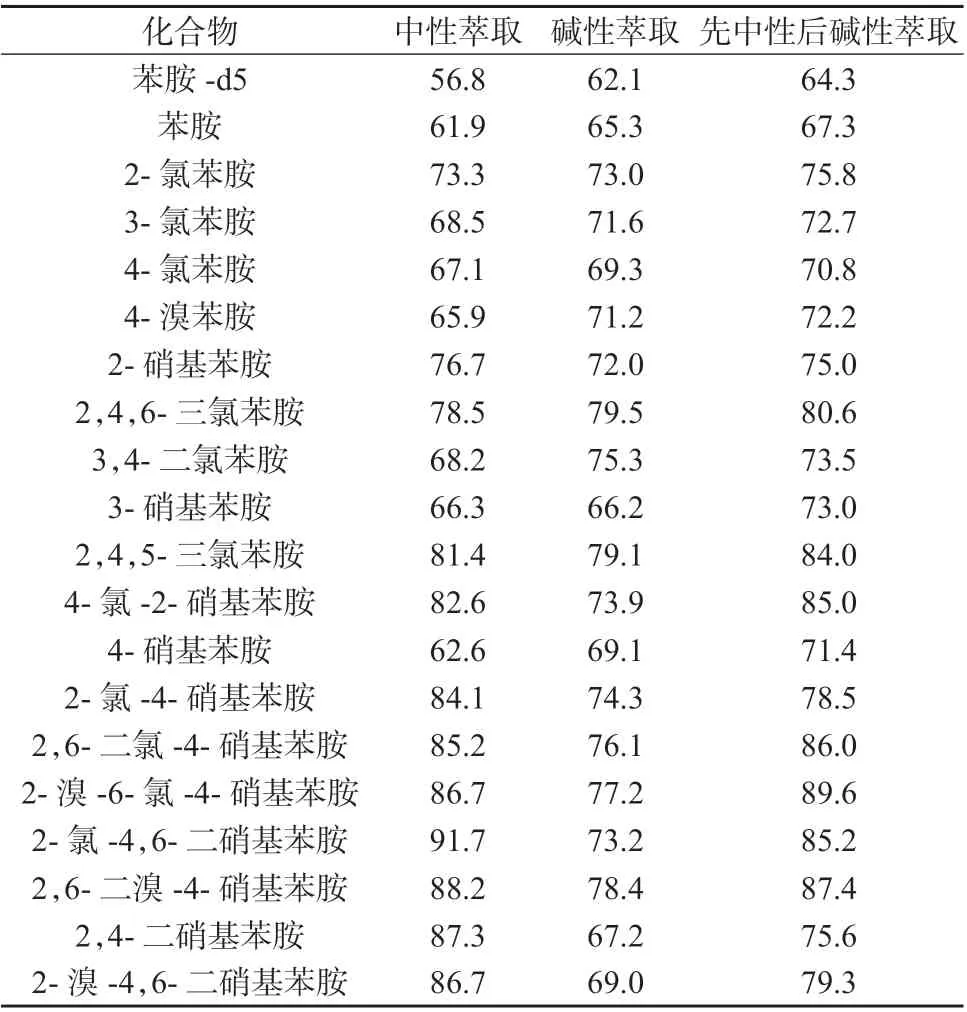
表1 不同pH 萃取条件下的回收率 %
2.2.4 光降解对回收率的影响
苯胺类化合物在分析检测中回收率不高,查阅其在天然水体环境中滞留、迁移、转化等行为的相关资料,设计模拟天然水体中苯胺类化合物光降解试验。分别取1.2 中0.4、1.0、2.5 μg/mL 的苯胺类标准工作溶液,每个浓度各6 份,分3 组。在避光5 h,以及同一光照条件下放置1、3、5 h 后进样分析,测定响应值,结果列于表2。

表2 不同质量浓度苯胺类标准溶液在不同光氧化降解条件下的响应值
由表2 可知,避光时苯胺类化合物测试响应值高,降解较缓慢,有光时部分苯胺类化合物在水中的降解加速,说明水中存在光敏物质,在光照射下产生氧化性更强的活泼基团,从而促进了有机污染物的降解,与相关研究得到结果类似[17-18]。因此,本研究选择在避光环境中进行样品的前处理实验。
2.2.5 浓缩条件对回收率的影响
苯胺类化合物具有一定挥发性,浓缩时间不易过长,浓缩温度不易过高,否则会降低苯胺类化合物的回收率;且氮气流量要适中,以溶液不形成回旋为宜,氮气流速太快也会造成低沸点苯胺类物质的损失。因此,为优化浓缩条件,设计正交试验,考察浓缩过程中温度和氮气流量对苯胺类化合物回收率的影响。正交试验表见表3,正交试验设计见表4,不同条件下的回收率试验结果列于表5。

表3 实验因素和水平
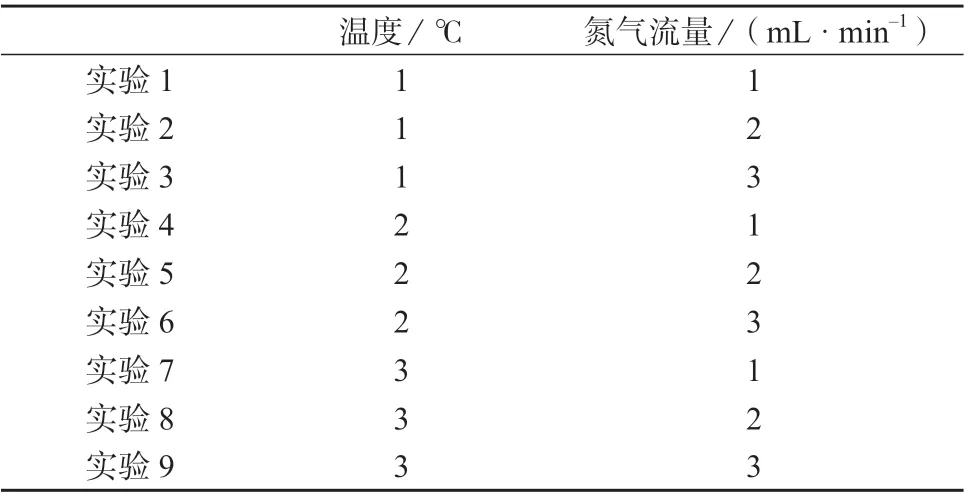
表4 正交试验设计

表5 不同温度和氮气流量下的回收率试验结果 %
由表5 可知,在水温30~35 ℃、氮气流量控制在3.0~4.0 mL/min 时,19 种目标化合物的回收率最好,综合考虑浓缩时间和19 种苯胺类化合物的浓缩效果,本试验选择水温30 ℃、氮气流量4.0 mL/min作为浓缩条件。
2.2.6 线性关系及检出限
在优化的色谱条件下对1.2 中的系列混合标准工作溶液进行测定。以各物质的质量浓度(x)为横坐标,色谱峰面积(y)为纵坐标进行线性回归,计算线性方程和相关系数。连续分析7 个质量浓度为1.0 μg/mL 的空白加标样品,计算标准偏差s。按MDL =t(n-1,0.99)×s 计算方法检出限,式中:n 为重复样品数;t(n-1,0.99)为置信度99%、自由度(n-1)时的t 值,当n=7 时,t 值取3.143[19]。苯胺类化合物的线性方程、相关系数、方法检出限列于表6。由表11 可知,所有组分在质量浓度为0.2~5.0 mg/L的范围内与色谱峰面积线性关系良好,相关系数R2均大于0.995,检出限为0.013~0.051 μg/L。
2.2.7 加标回收与精密度试验
于1 L 空白水样中加入1.0 mg/L 苯胺类混合标准溶液,按优化的实验条件萃取浓缩水样后上机进行检测,平行测定6 份,根据测定结果计算方法的加标回收率及精密度,结果见表7。由表7 可知,实际样品平均加标回收率为80.44%~98.79%,相对标准偏差为4.20%~9.41%。
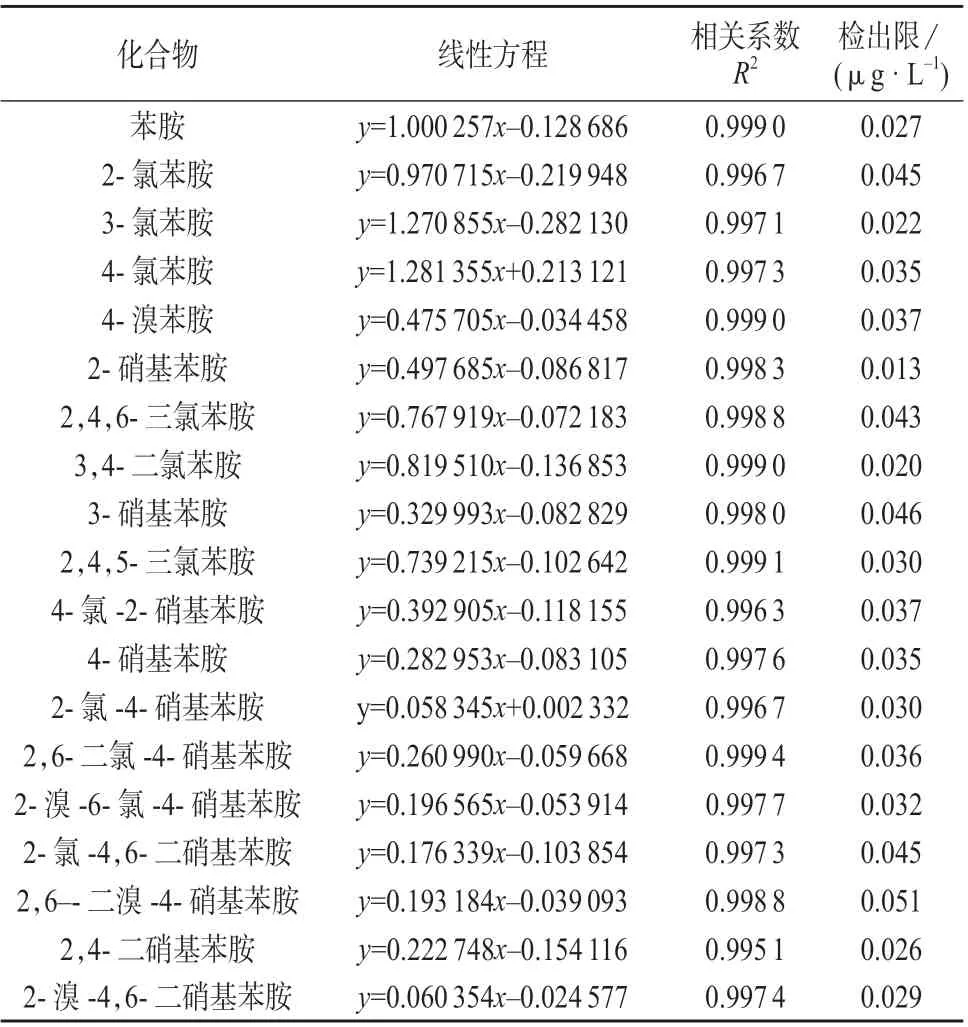
表6 苯胺类化合物线性方程、相关系数、检出限
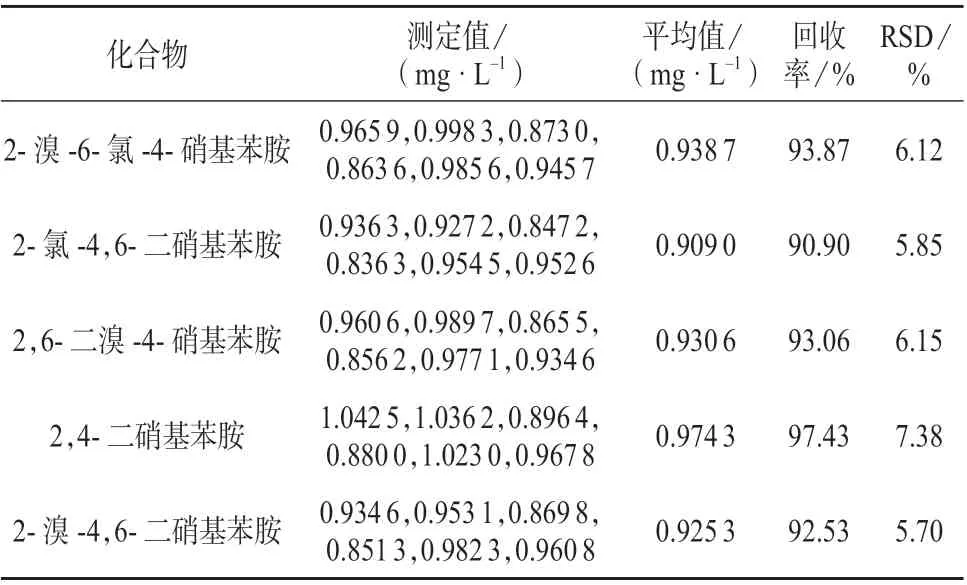
续表7
3 结语
建立了液液萃取-气相色谱-质谱法测定水中19 种苯胺类化合物的分析方法。19 种苯胺类化合物均在0.2~5.0 mg/L 范围内呈现良好的线性关系,检出限为0.013~0.051 μg/L。实际样品平均加标回收率为80.44%~98.79%,与文献报道相比有所提高。可能的原因是萃取过程采用避光手段降低了目标物的降解速率,同时,对样品pH、浓缩条件的优化选择,使苯胺类化合物的回收率有所提高,证明该方法可用于水中苯胺类化合物的准确测定。

