细菌β-内酰胺酶和氨基糖苷磷酸转移酶耐药基因可视化LAMP检测方法的建立和初步应用
王 豪,郭苗苗,刘昕雨,左 瑶,李 宁,孙 薇,张 涛,王 令
(陕西理工大学生物科学与工程学院,陕西汉中 723001)
抗生素具有广泛和高效的抑菌或杀菌作用,被大量用于临床和畜牧业,预防或治疗病原菌感染导致的疾病。由于抗生素的过量使用和在环境中的残余,加快了微生物抵抗抗生素的进化速率。其中,携带分解抗生素的抗性基因是微生物抵抗抗生素的主要途径之一,抗性基因编码的特殊酶将抗生素分解成无毒性的物质,从而赋予微生物抗性[1-2]。
在自然界中,微生物通过基因融合、转导、转化等方式转移或重排获得抗性基因,造成耐药性大幅上升[3]。β-内酰胺酶基因(beta-lactamase,bla)是氨苄青霉素抗性基因,其编码的β-内酰胺酶被细菌分泌至胞外,抑制转肽反应并催化β-内酰胺环的水解,从而解除氨苄青霉素对细菌的毒性[4]。氨基糖苷磷酸转移酶(aminoglycoside phosphotransferase,Aph)利用ATP作用于特定的游离羟基使其磷酸化,抑制卡那霉素与核糖体结合,从而失去抗菌活力,表现为卡那霉素耐药性[5]。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是日本学者Notomi建立的一种新型核酸检测技术[6]。其核心是针对目标基因设计多对特异性引物,在链置换DNA聚合酶的作用下,60 ℃~65 ℃进行恒温扩增,1 h的时间即可实现109~1010倍的核酸扩增。此技术与PCR相比,对仪器要求较低,反应时间大大缩短,具有高特异性、高敏感性、实时定量和可视化检测等优势[7-9]。所以,LAMP技术广泛应用于各种核酸检测,特别是病原微生物的检测,如致病性细菌、真菌和病毒等[10-11]。
本研究针对bla基因和Aph基因,建立特异的LAMP扩增体系,以羟基萘酚蓝[12](HNB)作为指示剂,优化HNB浓度,检测反应灵敏度,验证该LAMP方法,成功实现环境微生物中抗性基因的可视化检测。
1 材料与方法
1.1 材料
1.1.1 试剂 大肠埃希氏菌E.coliTOP10,含bla基因的质粒pET-32a,含有Aph基因的pET-28a质粒,陕西理工大学功能基因组实验室制备保存;Bst2.0 WarmStart DNA聚合酶,美国NEB公司产品;羟基萘酚蓝,上海生化科技有限公司产品产品;细菌基因组DNA快速抽提试剂盒,生工生物工程(上海)股份有限公司产品。
1.1.2 主要仪器 Alliance Chroma紫外凝胶成像分析系统,英国UVItec公司产品;Nanodrop-2000微量核酸蛋白检测仪,美国Thermo scientific公司产品。
1.1.3 水样 利用50 mL EP管,分别于汉江采集河水样品,汉中本地2个养殖场采集污水样品,将采集的水样置于冰盒,送回实验室,4 ℃保存备用。
1.2 方法
1.2.1 引物设计 根据NCBI公布的抗性基因bla和Aph的DNA序列,使用在线引物设计软件Pri-mer Explorer V4(http ://primerexplorer.jp/e/),遵循LAMP引物的设计原则,获得针对目标基因的2条外引物(F3和B3)和2条内引物(FIP和BIP)(表1),引物送至通用生物系统(安徽)有限公司合成。

表1 LAMP引物信息
1.2.2 LAMP反应体系 基于LAMP技术扩增目标基因的原理,设计扩增bla基因和Aph基因的LAMP反应体系。LAMP扩增体系中加入模板DNA 1 μL(10 ng/μL),10×buffer 2.5 μL,dNTP 4 μL,MgSO41.5 μL,引物FIP和BIP各2 μL (10 μmol/L),引物F3和B3各0.5 μL (10 μmol/L),1 μLBstDNA聚合酶(8 000 U/mL),ddH2O 补齐至25 μL。将上述体系置于95 ℃水浴保持5 min,然后65 ℃保持1 h, 80 ℃灭活20 min终止反应。扩增结果可利用20 g/L琼脂糖凝胶电泳检测或直接加入HNB可视化检测。
1.2.3 HNB浓度优化 LAMP体系中加入HNB,反应前呈现紫罗兰色,基因扩增反应后呈天蓝色,合适的HNB浓度能准确指示阳性结果。我们设置0、50、100、120、150、200、250 μmol/L的HNB浓度梯度,分别配制LAMP扩增反应体系;同时设置相应浓度的阴性对照。通过观察对比试验组与对照组的颜色差异,筛选出HNB最佳浓度。
1.2.4 反应体系灵敏度检测 梯度稀释质粒DNA浓度102、101、100、10-1、10-2、10-3、10-4ng/μL,将1μL不同浓度的质粒DNA加入25 μL LAMP扩增反应体系,并加入HNB颜色指示剂。反应后观察不同DNA浓度体系的颜色变化,确定反应体系检测目标基因的灵敏度。
1.2.5 水体样品中抗性基因快速检测 分别采集汉江河水,本地A和B养殖场污水样品,应用LAMP反应体系检测不同样品微生物是否携带bla基因和Aph基因。取采集获得的水样1 mL,8 000 r/min离心1 min收集水体中微生物,然后加入1 mL灭菌PBS,重悬微生物,离心后弃PBS。利用细菌基因组DNA快速抽提试剂盒提取样品中DNA,利用构建的LAMP反应体系,可视化检测3种水样中抗生素抗性基因。
2 结果
2.1 可视化LAMP检测方法的建立
为了验证设计引物的特异性和可视化检测扩增结果,分别在LAMP扩增体系中加入含抗性基因的质粒DNA和相应的引物为试验组,以灭菌水为模板作为阴性对照。扩增产物经20 g/L琼脂糖凝胶电泳检测,试验组中均有明显的梯状条带,而对照组中无扩增条带(图1)。此外,在扩增体系中加入HNB(终浓度120 μmol/L),试验组颜色由紫罗兰色变成天蓝色,而阴性对照呈现紫罗兰色(图1)。上述结果说明LAMP能扩增相应抗性基因,HNB能实现扩增结果可视化检测。
2.2 HNB浓度优化
合适的HNB浓度能准确显示扩增结果,试验分别设置了0~250 μmol/L HNB浓度梯度的LMAP体系,以筛选最佳HNB浓度,优化可视化检测。在检测bla基因的LAMP体系中,与水为模板的对照组比较,加入HNB的试验组的体系颜色均为天蓝色,当HNB浓度达到200 μmol/L时,阴性对照体系亦呈天蓝色,与试验组颜色差异较小。HNB的浓度为100、120、150 μmol/L时,试验组与对照组颜色差异明显,尤其在浓度为100 μmol/L时颜色差异最为显著,故选择100 μmol/L的HNB为检测bla的最佳浓度。检测Aph的LAMP体系HNB最适浓度与其一致。
2.3 LAMP方法的灵敏性检测
分别梯度稀释携带抗性基因的质粒DNA,设置模板浓度分别依次为102、101、100、10-1、10-2、10-3、10-4ng/μL的LAMP扩增体系。图3结果表明,检测bla的LAMP体系中,模板浓度为10-3ng/μL的体系呈天蓝色,表现为阳性,而模板为10-4ng/μL时颜色呈紫罗兰色,表现为阴性,表明LAMP反应体系检测bla基因的下限为10-3ng/μL;检测Aph基因的LAMP体系灵敏度检测下限为1 ng/μL。

M.DNA 标准DL 2 000;bla+.bla基因阳性反应体系;bla-.bla基因阴性对照;Aph+.Aph基因阳性反应体系;Aph-.Aph基因阴性对照
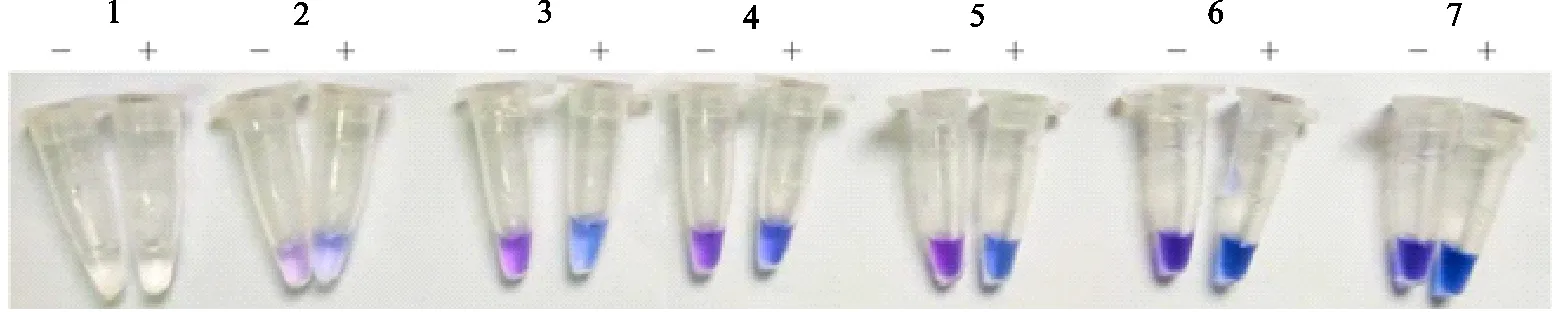
-.阴性对照;+.试验组;1~7.0~250 μmol/L HNB

1-7.102 ng/μL~10-4 ng/μL
2.4 LAMP检测方法的应用
选取环境中水体样本,应用建立的LAMP可视化检测不同样本微生物中是否携带目标抗生素抗性基因。分别来自汉江水、养殖场A和养殖场B污水的3个样本中,只在养殖场B污水中检测到bla基因,3个样本中均未发现Aph基因。

S1.汉江水;S2.养殖场A污水;S3.养殖场B污水
3 讨论
在畜禽养殖过程中,抗生素的使用能有效预防饲养动物被病原菌感染,以控制疾病的发生[13]。由于抗生素的大量使用及残余抗生素排放至环境,加快环境微生物产生耐药性的速率以增强其生存能力。其中,携带分解抗生素的抗性基因是环境微生物产生耐药性的主要方式。同时,含抗生素的环境淘汰无耐药性微生物,利于耐药微生物增殖,耐药基因在细菌间转移,甚至产生具有多种抗生素耐药性的超级细菌。因此,检测环境微生物耐药基因是评估环境质量的重要方面之一。
常规PCR和荧光定量PCR是检测目标基因的重要分子生物学技术,但是这些技术需要基因扩增仪,且只有专业技术人员才能判读结果,导致其成本高,检测周期长。LAMP是一种特殊基因扩增技术,其利用链置换DNA聚合酶作用和特异引物对,在等温条件下扩增基因片段, 1 h内实现目标基因109倍增加,其不需要特殊仪器设备,具有成本低,反应快,灵敏性高等优势。此外,在LAMP反应体系中加入颜色指示剂,通过观察颜色变化,直接判读结果,不需要打开反应管,从而进一步减少了交叉污染和气溶胶产生污染的机会,使结果更准确[14]。
鲁曦等[15]利用LAMP技术检测出水产品和海产品中红霉素、四环素和氯霉素等多种抗生素耐药基因。冯世文等[16]建立了可视化检测氟苯尼考耐药基因floR的LAMP检测方法。本研究针对常用抗生素氨苄青霉素和卡那霉素,其抗性基因分别是bla基因和Aph基因,建立可视化检测这2种抗性基因的可视化LAMP体系,通过凝胶电泳检测反应扩增结果,验证引物的特异性。加入HNB颜色指示剂,反应前体系呈紫罗兰色,发生基因扩增后呈天蓝色,表现为阳性。
合适的HNB浓度能准确反映扩增结果,所以筛选HNB最适浓度是可视化检测的关键。Goto M等[12]发现120 μmol/L HNB能明显区分阴性和阳性反应结果,张侃等[17]筛选150 μmol/L HNB为检测伪狂犬病病毒的最佳浓度。本研究设置多个浓度HNB梯度,其中100、120、150 μmol/L HNB颜色变化均能有效区分阴性和阳性结果。当HNB浓度达到200 μmol/L时,阴性和阳性体系颜色差异较小,我们选择100 μmol/L HNB作为最优浓度。
LAMP技术检测目标基因的灵敏度远高于常规PCR技术,与荧光定量PCR技术相当[18]。王毅超等[19]比较发现LAMP技术检测解脲脲原体的灵敏度比普通PCR高1 000倍。邓鹏程等[20]建立了检测日本血吸虫感染性钉螺的LAMP方法,其敏感度为1 pg/μL。谢晶等[21]用LAMP检测鸡传染性喉气管炎病毒,最低浓度达到0.06 pg/μL,其灵敏度是普通PCR方法的100倍,可以适用临床上的快速检测和诊断。本研究建立的LAMP方法检测bla基因的灵敏度为1 pg/μL,而检测Aph基因的下限仅为1 ng/μL。利用该LAMP方法检测3个不同来源水体微生物的抗性基因,结果显示B养殖场污水中微生物携带bla基因,未发现Aph基因,可能与其检测灵敏度相对较低有关。后续将进一步优化检测Aph基因的LAMP体系,增强检测灵敏度。
本研究建立的检测抗性基因bla和Aph可视化LAMP技术,可实现抗性基因高效快速检测,反应结果可直接判读,避免打开反应管而引起气溶胶污染,可为检测抗生素耐药微生物提供新的技术支撑。

