基因Ⅶ型新城疫病毒分离鉴定及免疫原性研究
薛景景,侯瑞卿,王婉冰,张盼涛,袁 月,郭丽霞,张 哲,田 辉,刘武杰*,田克恭*
(1.国家兽用药品工程技术研究中心,河南洛阳 471000; 2.普莱柯生物工程股份有限公司,河南洛阳 471000;3.河北省动物卫生监督所,河北石家庄 050000)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的以呼吸道症状、消化道症状、神经症状等为特征的烈性传染病,是严重危害世界和我国养鸡业的重要疫病之一,每年造成巨大的经济损失[1-3]。NDV亦被称为禽Ⅰ型副黏病毒(Avian paramyxovirus type 1,APMV-1),属于副黏病毒科(Paramyxoviridae)禽腮腺炎病毒属(Avulavirus)[4],基因组由一条单股不分节段的负链RNA分子组成,分别编码包括核衣壳蛋白(NP)、磷蛋白(P)、膜蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶蛋白(HN)、大分子聚合酶蛋白(L)在内的6种结构蛋白,其中F蛋白在NDV致病性中起重要作用[5]。根据NDV感染后的临床表现,可将其分为缓发型、中发型和速发型3种,而根据基因组的大小和遗传进化距离,将NDV分为ClassⅠ和ClassⅡ,ClassⅠ NDV毒力通常较弱;ClassⅡ NDV包含致病力强的毒株,分为21个亚型[6-7]。
在我国,ND为优先防控的16种动物疫病之一,养殖场也高度重视ND免疫预防工作,但随着NDV流行特点的变化,各地依旧发生高抗体水平鸡群感染NDV的情况[8-9]。现被广泛应用于ND防疫的La Sota疫苗株分离于1946年,属于ClassⅡ基因Ⅱ型,而我国目前流行的强毒株则主要为基因Ⅶ型[10]。虽然NDV只有一个血清型,但近几年分离的Ⅶ型强毒株与La Sota株基因组同源性越来越低,出现能够逃避La Sota株免疫保护的强毒株[11]。
本研究分离鉴定了4株NDV流行毒株,并设计引物扩增其F基因高变区序列,通过遗传进化分析确定分离株均为基因Ⅶ型。根据分离株致病指数筛选出毒力最强的PLK-N-06株,研究其与当前疫苗株的抗原性差异,通过攻毒保护试验评价现用疫苗株的免疫保护效果,为新型新城疫疫苗的研发提供可用的生物材料。
1 材料与方法
1.1 材料
1.1.1 病料 2008年-2009年从江苏、河南和山东等省份的发病鸡场,采集病鸡气管、肺、脑、心脏及脾脏等组织病料。
1.1.2 SPF鸡胚及实验动物 10日龄SPF鸡胚及1日龄SPF鸡,购自北京勃林格殷格翰维通生物技术有限公司的种蛋自行孵化;30日龄和6周龄SPF鸡,北京勃林格殷格翰维通生物技术有限公司提供。
1.1.3 标准抗原、阳性血清及毒株 NDV(基因Ⅶ型)血凝抑制试验(HI)抗原(PLK-N-06抗原)、PLK-N-06株高免血清和LaSota株高免血清,国家兽用药品工程技术研究中心病毒Ⅱ实验室自制;NDV HI抗原(基因Ⅱ型La Sota抗原)及阳性血清、鸡产蛋下降综合征病毒(Egg drop syndrome virus,EDSV)阳性血清及阴性血清,中国兽医药品监察所产品;禽流感病毒(Avian influenza virus,AIV)H5亚型、H7亚型和H9亚型阳性血清,哈尔滨维科生物技术有限公司产品;La Sota毒株由国家兽用药品工程技术研究中心保存。
1.1.4 主要试剂 病毒核酸提取试剂盒(Viral Nucleic Acid Extraction Kit Ⅱ),Geneaid公司产品;One-Step RT-PCR SuperMix,大连TRANS公司产品;DNA标准DL 2 000,宝生物工程(大连)有限公司产品;AGAROSE琼脂糖,广州美津生物有限公司产品;1%鸡红细胞和无菌PBS,国家兽用药品工程技术研究中心病毒Ⅱ实验室自制。
1.1.5 疫苗 NDV PLK-N-06株和La Sota株油乳剂灭活苗,国家兽用药品工程技术研究中心病毒Ⅱ实验室按现有的生产工艺制备。
1.1.6 主要仪器设备 台式高速冷冻离心机(CT15RT),上海天美科学仪器有限公司产品;PCR仪(C1000 Touch)和凝胶成像系统(GeL Doc TMXR),美国Bio-Rad公司产品;电泳仪(DYY-2C),北京六一生物科技有限公司产品;生物安全柜(BHC-1300 Ⅱ A/B3),上海苏净实业有限公司产品。
1.2 方法
1.2.1 病毒的分离与鉴定 取发病鸡气管、脾脏和肺脏等病变组织,按1∶3比例加入含双抗(最终浓度为青霉素2 000 U/mL、链霉素2 000 μg/mL)的无菌PBS充分研磨,反复冻融3次,4 ℃作用4 h,然后经3 000 r/min离心5 min,取上清液经尿囊腔接种10日龄SPF鸡胚,0.2 mL/枚,37 ℃孵育72 h,收获24 h~72 h死亡及存活的鸡胚尿囊液,测定血凝效价,效价≥4 log2的尿囊液分别与NDV和EDSV阳性血清,AIV H5、H7和H9阳性血清及阴性血清进行HI试验,血凝效价阴性的尿囊液在SPF鸡胚上盲传2代。鉴定后,将毒株用有限稀释法连续纯化3代,分别命名为PLK-N-02株、PLK-N-03株、PLK-N-06株和PLK-N-07株。
1.2.2 F基因高变区序列的测定和遗传进化分析 对比分析GenBank中多株鸡源NDV基因,针对F基因保守区域设计扩增高变区序列的特异性引物,所设计引物送苏州金唯智生物科技有限公司合成。引物序列为NDV-F:5'-CAAGATGGGCTCCAGACCTT-3';NDV-R:5'-GGAGGAATGTTGGCAGCATT-3',预期扩增目的片段大小为460 bp。按照试剂盒说明书提取分离株鸡胚尿囊液总核酸,RT-PCR扩增F基因高变区片段,反应程序为:45 ℃反转录25 min;94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃ 10 min。取RT-PCR产物5 μL,用10 g/L琼脂糖凝胶电泳检测结果,取扩增片段大小正确的RT-PCR产物送苏州金唯智生物科技有限公司进行核苷酸序列测定。
测序结果用DNA Star软件分析其F蛋白裂解位点的氨基酸序列。用MegAlign软件比较测序结果和常用疫苗株F基因高变区序列的同源性。用MEGA 6.0软件对比分离株与GenBank中公布的NDV经典毒株基因序列,绘制系统进化树并确定基因型。NDV主要参考毒株登录号在表1中列出。
1.2.3 病毒致病指数测定 按照世界动物卫生组织(OIE)操作规程进行最小致死量鸡胚平均死亡时间(MDT)、1日龄雏鸡脑内致病指数(ICPI)及6周龄SPF鸡静脉接种致病指数(IVPI)测定。
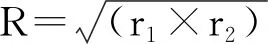
1.2.5 攻毒保护试验 取30日龄SPF鸡25只,随机分为3组,第1组10只腿部肌肉注射免疫PLK-N-06灭活苗20 μL/只,第2组10只腿部肌肉注射免疫La Sota灭活苗20 μL/只,第3组5只,注射等量生理盐水作为攻毒对照组。免疫后21 d各组分别采血,分离血清,用PLK-N-06抗原和La Sota抗原测定NDV HI抗体。采血后各组鸡分别肌肉注射105.0ELD50的PLK-N-06株病毒液,攻毒后连续观察14 d,记录攻毒鸡的发病和死亡情况,攻毒后5 d分别采集泄殖腔拭子进行病毒分离。

表1 系统进化树中NDV F基因参考序列的GenBank登录号
2 结果
2.1 病毒的分离与鉴定
4份病料处理的上清液接种10日龄SPF鸡胚,在24 h~48 h全部死亡,死亡鸡胚的胚体全身出血,头、腹、背和腿有明显出血点。收获鸡胚尿囊液均能凝集1%鸡红细胞,效价为7log2~9log2。HI试验表明分离株可以被NDV阳性血清抑制,而不能被EDSV和AIV(H5、H7、H9)阳性血清抑制,表明分离到的4株病毒为NDV,经鸡胚有限稀释法连续纯化3代,分别命名为PLK-N-02株、PLK-N-03株、PLK-N-06株和PLK-N-07株。
2.2 F基因高变区序列的测定和遗传进化分析
提取病毒的核酸,用特异性引物扩增PLK-N-02株、PLK-N-03株、PLK-N-06株和PLK-N-07株F基因的高变区序列,获得大小约500 bp与预期结果一致的目的条带(图1)。
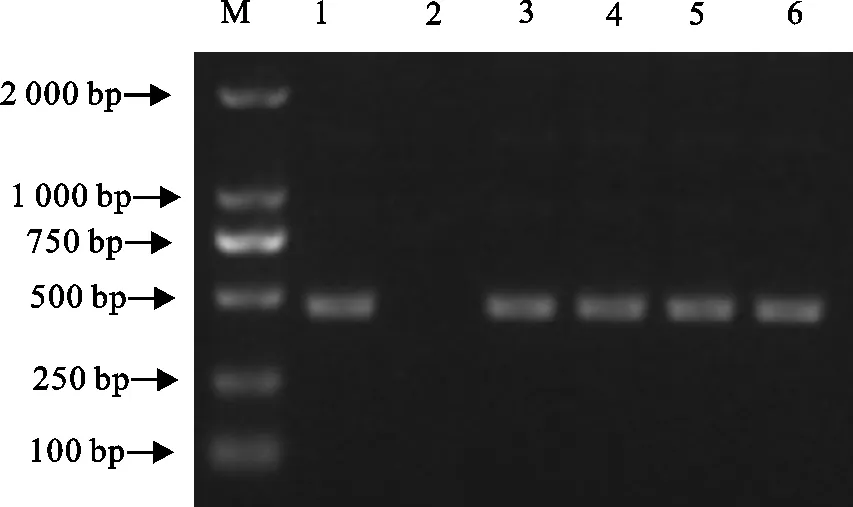
分析序列测定结果显示,4株毒株F蛋白裂解位点均为112R-R-Q-K-R-F117,有多个碱性氨基酸的插入,符合强毒株裂解位点的典型分子特征。用MEGA 6.0软件,对比分析4株分离株与GenBank收录的各基因型毒株的F基因高变区(47 bp~421 bp)核苷酸序列,以此绘制系统进化树(图2)。结果表明,4株分离株均属于基因Ⅶd亚型,PLK-N-06株和PLK-N-07株位于同一个分支,与Chicken/Kyrgyzstan/2016/1-16(MK423875)和Chicken/EG-QU/NRC/2015(MF418019)遗传距离最近,与同属另一分支的分离株PLK-N-02和PLK-N-03亲缘关系相对较远,分离株相互之间的核苷酸同源性为93.3 %~98.4 %,而与La Sota等传统疫苗株核苷酸同源性仅为78.9 %~82.6 %,说明分离株与传统疫苗株在分子水平上具有一定差异。
M.DNA 标准DL 2 000;1.NDV阳性对照;2.阴性对照;3.PLK-N-02;4.PLK-N-03;5.PLK-N-06;6:PLK-N-07
■.NDV分离株;●.常用疫苗株
2.3 分离株致病指数的测定
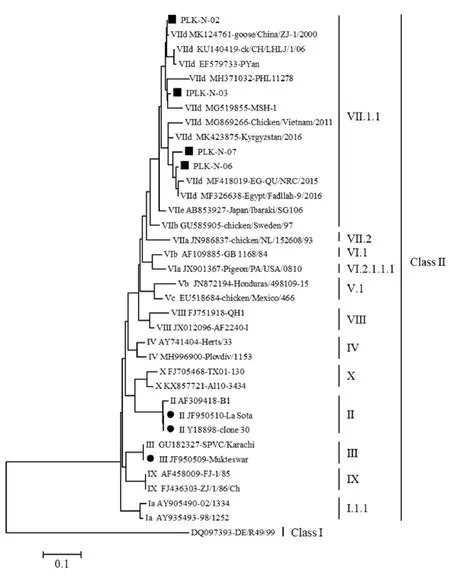
测定PLK-N-02株、PLK-N-03株、PLK-N-06株和PLK-N-07株的MDT、ICPI和IVPI(表2)。按照OIE[15]公布的毒力判定标准,4株分离株的MDT均小于60.0 h 、ICPI大于1.60,IVPI大于2.0,由此可判定分离的NDV均属速发型强毒力毒株。PLK-N-06株拥有相比其他3株NDV更小的MDT值和更大的ICPI值与IVPI值。因此,选择毒力更强的PLK-N-06株进行后续试验研究。
2.4 鸡胚交叉中和试验结果
将PLK-N-06株、La Sota株和相应的高免血清进行鸡胚交叉中和试验,计算中和效价(表3)。根据中和效价得分离株PLK-N-06与La Sota疫苗株的抗原相关性R值为0.45,表明PLK-N-06株与La Sota株间存在显著抗原性差异。
表2 不同毒株致病指数测定结果

表3 两种血清对不同病毒的中和效价
2.5 攻毒保护试验
2.5.1 免疫后抗体水平检测结果 将制备的PLK-N-06株和La Sota株油乳剂灭活疫苗免疫接种30日龄SPF鸡,免后21 d以基因Ⅶ型PLK-N-06株和基因Ⅱ型La Sota株为抗原检测血清HI抗体效价(表4)。结果表明,PLK-N-06株免疫组使用基因Ⅶ型抗原检测效价高于基因Ⅱ型抗原检测结果,且PLK-N-06灭活苗免疫组以PLK-N-06抗原检测的抗体水平明显高于基因Ⅱ型La Sota株免疫组以La Sota抗原检测的抗体水平,说明基因Ⅶ型PLK-N-06株的免疫原性更好。
2.5.2 免疫后攻毒保护效果 PLK-N-06灭活苗和La Sota灭活苗免疫后21 d,连同攻毒对照组鸡分别感染PLK-N-06株,攻毒后每天观察各组试验鸡的精神、采食、发病及死亡情况。对照组5 d内5/5死亡,PLK-N-06株灭活苗和La Sota株灭活苗免疫组均未见明显的临床症状,但攻毒后5 d,采集泄殖腔棉拭子的病毒分离结果显示(表5),La Sota株灭活苗免疫组4/10病毒分离阳性,PLK-N-06灭活苗免疫组0/10病毒分离阳性。

表4 免后21 d各组对应试验鸡的HI抗体

表5 各免疫组对PLK-N-06株的保护效果
3 讨论
NDV是自然界鸟类群体中常见的病原体,主要侵害鸡、鸭和鹅等家禽以及赛鸽、鹦鹉和鸵鸟等特种经济禽类,已报道该病毒可感染的禽类品种超过250种[6]。OIE将ND列为必须报告的动物疫病,而我国也将其列为一类动物疫病[16]。NDV基因组编码的F蛋白位于病毒囊膜的表面,其必须在一些蛋白水解酶的作用下,从F0惰性前体状态裂解成F1和F2片段,才可发挥介导病毒囊膜和宿主细胞融合的作用[17]。强毒株F蛋白裂解位点的氨基酸为112R/K-R-Q-R/K-R-F117,因为包含多个R/K碱性氨基酸,可被宿主全身细胞的蛋白酶识别,而弱毒株的F蛋白裂解位点有两处碱性氨基酸被替换为中性氨基酸,变成112E-R-Q-G/E-R-L117,导致其F蛋白只能在呼吸道和消化道的细胞中被裂解,引起局部感染[18-19]。分离的4株NDV 测定F基因高变区序列,推断其裂解位点氨基酸序列均为112R-R-Q-K-R-F117,与ND强毒株的分子特征一致,显示4株分离株可能为强毒株。
因为不同NDV之间毒力差异显著,所以OIE严格规定,只有NDV的ICPI≥0.7,且F蛋白拥有强毒株裂解位点特征,才判定发生ND疫情[15]。根据致病性的不同,NDV分为速发型(强毒株)、中发型(中等毒力毒株)和缓发型(弱毒株),分类依据为MDT、ICPI和IVPI 3个毒力指标[20]。经测定4株分离株MDT≤51 h,ICPI≥1.61,IVPI≥2.55,均符合新城疫强毒株的标准,该结果与F蛋白裂解位点特征相符合。PLK-N-06株的MDT=42 h, ICPI=1.70,IVPI=2.69,毒力强于另外3株分离株,更具有免疫原性研究和疫苗研发的潜在价值。
虽然NDV只有一个血清型,但却在抗原性、基因组结构和遗传进化等方面存在差异。在遗传性上,NDV分为ClassⅠ和ClassⅡ,ClassⅡ又划分为多个基因型,世界范围内广泛流行的NDV为基因Ⅴ型和Ⅶ型[21]。对分离株F基因高变区的遗传进化分析显示4株分离株属于Ⅶd亚型,与国内近年的研究报道一致,属于目前流行的优势基因型[22]。鸡胚交叉中和试验表明PLK-N-06株与La Sota疫苗株抗原相关性R值<0.5,说明两者之间存在显著的抗原性差异,这一结论与秦卓明[23]的研究结果相符合。
报道显示La Sota疫苗株对基因Ⅶ型毒株有一定的保护作用[11,24]。赵明等[11]分离鉴定一株Ⅶ b亚型NDV,用此毒株感染免疫La Sota株灭活疫苗的鸡,不出现临床症状但可检测到排毒。Mahmoud N K[24]研究基因Ⅱ型La Sota株灭活疫苗对基因Ⅶ型毒株保护效果时也观察到相同的现象。本研究攻毒保护试验结果显示,La Sota株疫苗免疫后,在HI抗体效价几何平均值为6.1 log2的情况下,感染PLK-N-06分离株,虽不表现临床症状,却在攻毒后5 d出现4/10排毒,说明不同基因型毒株之间交叉保护作用有限。目前我国使用最多的疫苗基因型为Ⅱ型,其在遗传进化和抗原性上与现在流行的基因Ⅶ型毒株存在显著的差异,导致传统疫苗在对抗流行毒株感染时,虽能保护鸡只不出现临床症状,但不能有效避免感染及排毒[25]。开发与流行毒株基因型匹配的新型疫苗对防控ND具有重要的意义,而PLK-N-06株的分离为上述疫苗的研制奠定了基础。

