猪流行性腹泻病毒分离鉴定及其灭活疫苗的研制
郭振刚,胡江锋,王 婷,王晶钰*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.杨凌绿方生物工程有限公司,陕西杨凌 712100)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种感染猪以呕吐、腹泻、脱水、厌食和迅速消瘦为主要特征的高度接触性肠道传染病[1]。在自然条件下,PEDV通过口鼻途径进入猪体内,各种年龄和品种的猪都有易感性,但对哺乳仔猪和育肥猪的危害更大,尤其对哺乳仔猪危害最为严重,发病率可达100%,病死率为30%~80%[2-3]。1971年,PEDV在英国首次被鉴定并确定为猪流行性腹泻的致病因子[4],PED呈世界范围性流行。自1984年证明我国存在PEDV开始,该病在国内流行面逐渐扩大,并在2010年末以后在我国大部分地区呈暴发流行[5]。PED多与猪传染性胃肠炎病毒、轮状病毒等其他肠道病原混合感染,给养猪业造成严重经济损失[6-10]。
因饲养管理水平的差异,单次疫苗接种并不能完全保证免疫后产生有效的中和抗体[10]。PED现有疫苗在不同地区的免疫保护力存在一定差异,可能是PEDV流行多年出现变异,以致于疫苗株与流行毒株的基因同源性较低以及关键免疫位点发生突变有关。大量PEDV分子流行病学研究显示,2010年-2016年间的PEDV流行毒株与CV777等疫苗株的同源性较低,尤其在毒力决定基因S上存在较多突变[11-14]。因此,迫切需要能保护仔猪免受PEDV流行毒株感染的安全高效且廉价的疫苗。
本研究从甘肃某地暴发腹泻的猪场中,采集因腹泻病死的7日龄内仔猪的小肠组织及内容物,经过病毒分离、鉴定和培养,获得PEDV分离株,以该毒株制备全病毒灭活疫苗并开展了免疫效力研究。
1 材料与方法
1.1 材料
1.1.1 组织病料 从甘肃某地暴发仔猪腹泻的猪场中,采集病死猪的小肠组织及其内容物42份。
1.1.2 细胞及血清 Vero细胞、PEDV特异性阳性血清、猪流行性腹泻病毒阴性血清,均由西北农林科技大学动物医学院预防兽医系兽医公共卫生与畜禽产品安全实验室保存。
1.1.3 试验用动物 PEDV中和抗体不高于1∶4的产前6周的妊娠母猪,由陕西省渭南市大荔县生态养猪场提供。
1.1.4 主要试剂 MEM培养基,HyClone公司产品;胎牛血清,Gibco公司产品;病毒基因组RNA提取试剂盒,Omega公司产品;反转录酶、dNTP、随机引物、DNA标准DL 2 000,宝生物工程(大连)有限公司产品;油包水佐剂ISA 61VG和水包油包水佐剂赛彼科 ISA 206,赛彼科(上海)特殊化学品有限公司产品;甲醛,国药集团化学试剂有限公司产品。
1.1.5 主要仪器 微量移液器,Eppendorf公司产品;普通细菌摇床,上海南荣实验室设备有限公司产品;台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司产品;超净工作台,北京亚泰科隆实验科技开发中心产品;PCR仪,杭州朗基科学仪器有限公司产品;凝胶成像系统,Bio-Rad公司产品;核酸电泳仪,北京君意东方电泳设备有限公司产品。
1.2 方法
1.2.1 病毒分离 从甘肃某地暴发腹泻的猪场中,采集病死猪的小肠组织及其内容物42份。用pH 7.2~7.4的PBS按1∶10(W/V)研磨,反复冻融3次,8 000 r/min离心10 min,无菌吸取上清液,用0.22 μm滤器过滤后接种于生长良好的单层Vero细胞,吸附1 h后,弃去病毒液,PBS(pH 7.2)清洗3次后,加入细胞维持液,置37 ℃、体积分数为5%的CO2培养箱中培养7 d,观察是否出现细胞病变,如此盲传至细胞出现病变,反复冻融细胞,离心收集细胞培养液即病毒液,置-70 ℃保存。
1.2.2 病毒鉴定
1.2.2.1 RT-PCR检测 按照试剂盒说明书提取RNA,用PEDV特异性引物(PEDV-F:5’-AACGGTTCTATTCCCGTTGATG-3’;PEDV-R:5’-TAAATGAAGCACTTTCTCACTATC-3’)进行鉴定,预期扩增片段大小为645 bp,以商品化疫苗毒CV777核酸作为阳性对照,引物由北京奥科鼎盛生物公司合成。PCR产物经10 g/L琼脂糖凝胶电泳鉴定。
1.2.2.2 病毒中和试验 将病毒稀释成200 TCID50/0.1 mL,与等量的PEDV特异性阳性血清混合,置37 ℃作用60 min,接种到长成良好单层的Vero细胞96孔细胞培养板上,接种4孔,100 μL/孔,置37 ℃、体积分数为5%的CO2的培养箱中培养7 d,同时设阴性血清对照、正常细胞对照组和未中和病毒对照组,每日观察各组细胞病变情况。
1.2.3 病毒培养条件优化
1.2.3.1 Vero细胞转瓶培养 从液氮罐中取出冻存的Vero细胞,置37 ℃水浴中解冻,1 000 r/min离心15 min,弃掉上清,分别用含60、80、100、120 mL/L胎牛血清的MEM培养基重悬接种25 cm2细胞瓶,置37 ℃、体积分数为5%的CO2培养箱中培养至细胞长成致密单层,记录不同时间细胞瓶内细胞的生长比例,确定最佳血清使用含量。用2.5 mg/mL胰酶消化后,按1∶3~1∶5传代,扩大培养。
1.2.3.2 病毒转瓶培养、收获及毒价测定 将175 cm2培养瓶中已长成良好单层的Vero细胞,弃去细胞培养液,按0.1%、0.2%、0.5%(V/V)的比例加入毒种,并加入30 mL MEM培养基,置37 ℃、体积分数为5%的CO2培养箱中培养,每天观察细胞形态变化,记录不同稀释度病毒产生的细胞病变孔数,5 d~7 d后按Reed-Muench法计算TCID50。
1.2.4 病毒灭活条件优化
1.2.4.1 病毒灭活 取病毒液3瓶(500 mL/瓶),分别加入终浓度分别为0.5、0.7、1 mg/mL的甲醛溶液,2 ℃~8 ℃放置72 h进行病毒灭活,在灭活24、48、60、72 h时取样,进行灭活检验和无菌检验。
1.2.4.2 病毒灭活检验 将灭活好的病毒液接种至已长成良好单层的Vero细胞(25 cm2细胞瓶),每瓶1 mL,吸附1 h后弃液,加入MEM培养基5 mL,置37 ℃、体积分数为5%的CO2培养箱中培养3 d后,置-15 ℃以下冻融细胞,将上一代的细胞冻融液接种至下一代细胞瓶中,如此进行,将细胞液再盲传2代。观察并记录是否出现细胞病变。
1.2.4.3 无菌检验 将灭活检验合格的病毒液按2015版《中国兽药典》附录[15]进行无菌检验。
1.2.5 疫苗制备 将抗原与水包油包水佐剂赛彼科佐剂ISA 206(质量比1∶1)、油包水佐剂赛彼科ISA 61 VG(质量比1∶1)按照下面方法配制疫苗。
1.2.5.1 油包水佐剂赛彼科 ISA 61 VG疫苗的制备 将赛彼科 ISA 61 VG佐剂加入烧杯,将均质机的均质头连同常用的栅格放入佐剂中,缓缓加入,逐渐加大搅拌速度至14 000 r/min,搅拌头置于液体一半高度的位置。室温条件下乳化3 min,室温静置24 h。
1.2.5.2 水包油包水佐剂赛彼科疫苗的制备 取制备的灭活PEDV毒液和赛彼科 ISA 206,分别加热至30 ℃±2 ℃,将佐剂倒入烧杯中,并将温度保持在30 ℃,以200 r/min搅拌并逐渐将病毒液缓慢加入。待病毒液全部加入后,提高搅拌速度至300 r/min,30 ℃持续搅拌20 min~30 min。将容器冷却至15 ℃以下,并在冷却过程中持续搅拌,最后将乳液在15 ℃静置24 h。
1.2.6 疫苗检验
1.2.6.1 稳定性检验 取上述制备的疫苗各10 mL置离心管中,3 000 r/min离心15 min,观察这两种疫苗的水相析出量。
1.2.6.2 黏度检验 将两种疫苗均按2015版《中国兽药典》附录[15]进行检验。
1.2.6.3 安全性 取3日龄~5日龄仔猪15头,分为3组,每组5头,2组为试验组,1组为对照组。每种疫苗颈部肌肉注射接种一组猪,2.0 mL/头,对照组以相同方式注射生理盐水2.0 mL/头。免疫后14 d内,每天测定各组猪体温,观察各组猪采食、饮水、精神是否正常,有无不良临床反应,疫苗的吸收情况及注射部位是否有异常反应。
1.2.6.4 效力检验 取3日龄~5日龄健康仔猪15头,分为3组,每组5头,其中1组为对照组,其他2组为试验组。每种疫苗颈部肌肉注射一组试验猪,1.0 mL/头,免疫后14 d按相同方式与剂量进行二次免疫,对照组接种1.0 mL灭菌生理盐水。二次免疫后7 d,各组猪分别采血,测定PEDV中和抗体。
1.2.7 猪流行性腹泻灭活疫苗临床安全性试验 安全性试验按照表1进行,在产前6周每头母猪颈部肌肉注射疫苗4 mL,产前3周按照同样的剂量和方法进行二次免疫。共免疫母猪30头,同时设不免疫母猪30头作为对照组。观察免疫后采食、饮水、精神状况及不良临床反应,统计母猪流产、早产、异常胎儿及产仔数情况。

表1 母猪安全性试验时间表
1.2.8 猪流行性腹泻灭活疫苗临床免疫试验 在产前6周每头母猪颈部肌肉注射疫苗2 mL,产前3周按照同样的剂量和方法进行二次免疫。共免疫接种母猪30头。观察免疫接种后采食、饮水、精神状况及不良临床反应,统计母猪流产、早产、异常胎儿及产仔数情况。有效性试验按照表2进行,

表2 母猪疫苗免疫试验时间表
1.2.9 免疫效果试验 免疫效果试验使用20头PEDV阳性母猪,分2组,每组10头,其中1组为对照组。在产前40 d每头母猪颈部肌肉注射疫苗2 mL,产前20 d按照同样的剂量和方法进行二次免疫。对照组接种2 mL灭菌生理盐水。统计产仔数量,仔猪情况和仔猪16日龄存活数量。
2 结果
2.1 病毒分离
病料接种Vero细胞后,盲传F5代,培养96 h后,产生细胞病变,表现为合胞体、细胞呈灶状脱落等(图1)。再继续传至第F10代,收获培养物,标记为PEDV GS株F10代,置-70 ℃以下保存。
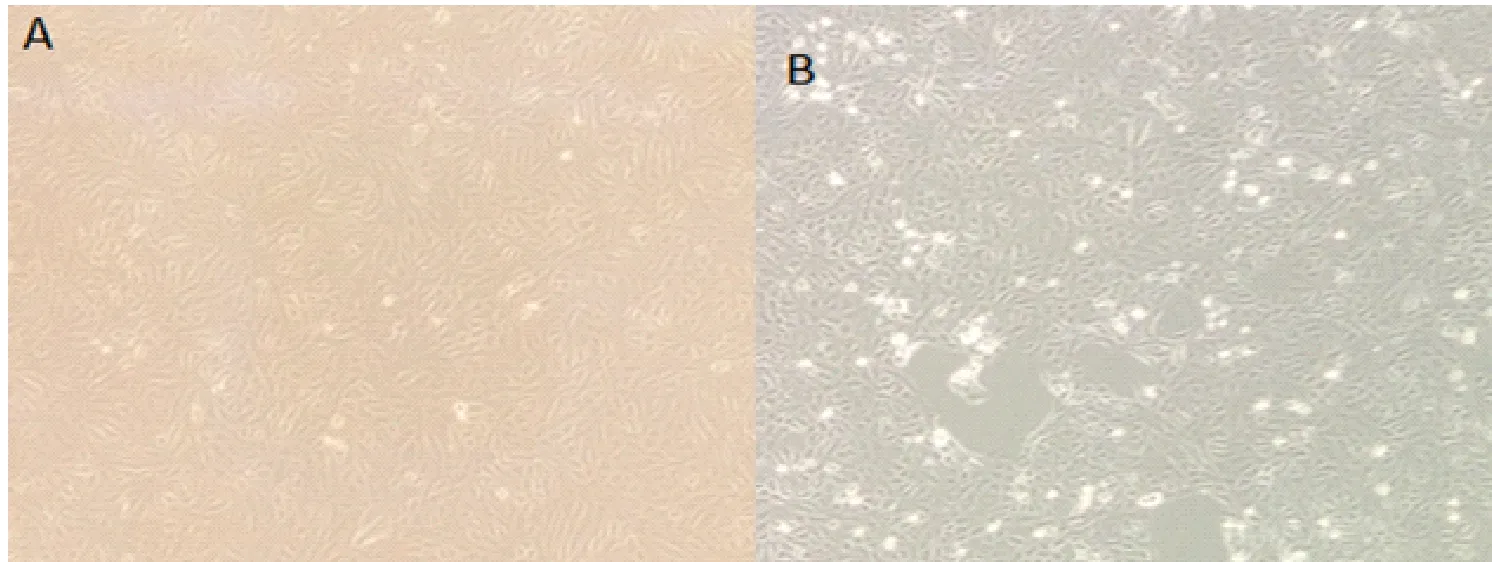
A.对照Vero细胞;B.接种PEDV后病变的Vero细胞
2.2 病毒鉴定
2.2.1 RT-PCR检测 提取细胞培养物总RNA,进行RT-PCR检测,PCR产物经10 g/L琼脂糖凝胶电泳,得到大小约为645 bp的目的条带(图2)。结果表明分离毒株为PEDV。
2.2.2 病毒中和试验 将PEDV-GS株与特异性阳性血清孵育60 min后,接种Vero细胞。结果显示,病毒中和组及正常细胞对照组均不产生细胞病变,阴性血清对照组、未中和病毒对照组产生细胞病变,说明分离株能够被PEDV特异性阳性血清完全中和。
2.3 病毒培养条件优化
将复苏的Vero细胞分别用不同含量新生牛血清的培养基培养至致密单层,记录不同时间细胞瓶内细胞的生长比例。结果表明,以80 mL/L含量添加新生牛血清进行细胞培养,能达到最佳细胞传代所需的生长状态(表3)。将PEDV-GS株按照不同比例接种Vero细胞,接种后不同时间收获病毒液,测定病毒含量。结果表明,以5 mL/L的比例接种后培养48 h~72 h,病毒含量达到高峰(表4)。因此,将PEDV-GS株的最佳培养条件确定为以80 mL/L含量添加新生牛血清进行细胞培养,5 mL/L的比例接种Vero细胞,培养48 h~72 h收获病毒。
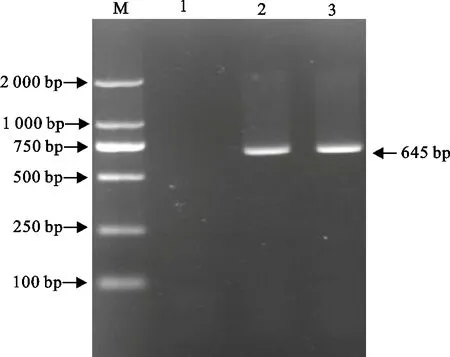
1.阴性对照;2.PEDV GS F10;3.阳性对照

表3 Vero细胞在不同含量血清的MEM 培养基中不同时间生长情况观察
2.4 病毒灭活条件优化
2.4.1 灭活条件的确定 将病毒液中加入不同浓度的甲醛,灭活不同时间取样,进行灭活检验。结果显示,当甲醛终浓度不低于0.7 mg/mL时,灭活时间不少于48 h,病毒可被完全灭活(表5)。
2.5 疫苗检验
2.5.1 稳定性 取配制的2种疫苗各10 mL于离心管中,以3 000 r/min离心15 min,2种疫苗水相析出均不大于0.2 mL,表明2种疫苗的稳定性良好。
2.5.2 黏度检验 将2种疫苗按2015版《中国兽药典》附录[15]进行检验,2种疫苗黏度均小于200 cP(表7),符合标准。
表4 不同比例接种后培养不同时间病毒 含量测定结果(TCID50/mL)

表5 不同浓度甲醛灭活不同时间后病毒灭活检验结果
2.4.2 无菌检验 将灭活检验合格的病毒液进行无菌检验。结果表明,灭活检验合格的病毒液均无菌生长(表6)。

表6 灭活后病毒无菌检验结果
2.5.3 安全性 将2种疫苗分别以2.0 mL/头的剂量免疫试验猪,并在免疫前1 d和免疫当天及免疫后14 d内每天测定各组试验猪体温。结果表明,2种疫苗免疫组猪及对照组猪体温均正常(表8)。此外,免疫后14 d内,2种疫苗免疫猪采食、饮水、精神状况均正常,均无不良临床反应,疫苗吸收良好,注射部位均无红肿、硬块等局部异常反应,与对照组无明显差异。

表7 疫苗黏度检验结果

表8 疫苗接种试验猪体温测定结果
2.5.4 抗体检测 免疫后不同时间测定各组试验猪PEDV中和抗体。二次免疫后7 d,ISA 61 VG免疫组PEDV中和抗体均不低于1∶32,ISA 206免疫组和Merckinade SDA 25免疫组PEDV中和抗体均不低于1∶16,对照组PEDV中和抗体均<1∶4(表9)。
用同一批次灭活检验合格后的病毒(灭活前病毒含量为107.0TCID50/mL)根据佐剂使用说明书配制疫苗,ISA 61 VG佐剂疫苗抗原含量与ISA 206佐剂疫苗抗原含量相当。用同样剂量免疫接种仔猪后,ISA 61 VG佐剂疫苗的中和抗体高于ISA 206佐剂疫苗组。根据上述试验结果,确定在猪流行性腹泻灭活疫苗(GS株)生产中使用赛彼科ISA 61 VG佐剂。
2.6 临床试验
2.6.1 安全性试验 免疫妊娠母猪后,免疫组和对照组采食、饮水、精神状况均正常,没有出现不良临床反应。免疫组共产仔434头,其中有3头弱胎,无早产和流产现象;对照组共产仔422头,其中有4头弱胎、1头早产,无流产现象。免疫组和对照组没有明显差异(表10)。
2.6.2 仔猪免疫效果试验 仔猪的母源中和抗体检测:疫苗免疫妊娠母猪后,其所产7日龄仔猪的母源抗体中和效价在1∶128~1∶256之间,所产14日龄仔猪的中和抗体在1∶64~1∶128之间,所产21日龄、28日龄的中和抗体均在1∶32~1∶64之间(表11和图3)。
综上所述,在大荔生态养猪场对妊娠母猪进行安全性试验和免疫效果试验,结果表明猪流行性腹泻灭活疫苗(GS株)对妊娠母猪是安全有效的,其被动免疫抗体至少持续至仔猪产后28 d。
2.6.3 免疫效果试验 免疫组共产仔125头,其中有2头弱胎,1头死胎,16日龄存活62头;对照组共产仔118头,其中有1头弱胎,1头死胎,16日龄存活29头。免疫组的仔猪存活率显著高于对照组(表12)。
综上所述,在猪场对妊娠母猪进行安全性试验、有效性试验和免疫效果试验,结果表明猪流行性腹泻灭活疫苗对妊娠母猪是安全有效的,对于仔猪有显著的保护力,其被动免疫抗体至少持续至仔猪产后28 d。

表9 各试验组免疫后PEDV中和抗体检测结果
表10 母猪安全性试验结果

表11 仔猪母源抗体检测结果
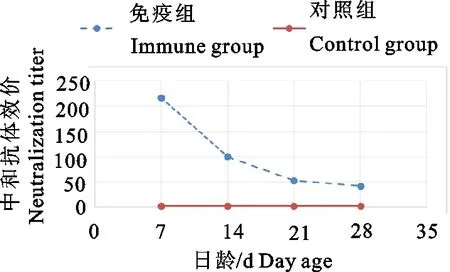
图3 被动免疫中和抗体检测
3 讨论
自2010年10月起,我国大范围暴发了数次猪流行性腹泻疫情,引起了100多万仔猪病亡,给我国的养猪业造成了巨大的经济损失。截止到2018年,国内PEDV疫苗获得新兽药证书5个,共有18个企业的6种PEDV疫苗获得有效批准文号23个[16]。但在不同地区,现有疫苗的免疫效果存在一定差异,这可能和疫苗株与流行毒株的基因同源性较低,以及流行毒株关键免疫位点的突变有关,大量分子流行病学研究报道显示,2010年-2016年间的PEDV流行毒株与CV777等疫苗株的同源性较低,尤其在毒力决定基因S上存在较多突变[17-18]。
本试验从甘肃某地暴发腹泻的猪场中,取病死的7日龄内的仔猪的小肠组织及内容物,用在Vero细胞培养基中添加10 μg/mL胰酶进行培养,病毒盲传到第5代后,出现了明显的细胞病变,经过RT-PCR检测、病毒中和试验等鉴定,确定分离出1株PEDV,将其传代至F10代,作为候选疫苗株。甲醛是常用的灭活剂,其原理是通过对病毒蛋白羧基端发生作用,从而使病毒失活,丧失感染性[19]。本试验对甲醛的最小使用量进行了研究,确定了其最小使用剂量为终浓度0.7 mg/mL,在中国兽药典规定范围之内,保证了疫苗的安全性。
在研制疫苗的过程中对佐剂筛选进行了研究,ISA 61 VG油包水佐剂疫苗抗原含量与ISA 206水包油包水佐剂疫苗抗原含量相当,但用同样剂量免疫仔猪后,油包水佐剂疫苗的中和抗体高于水包油包水佐剂疫苗组,所以最终选择了中和抗体较高的赛彼科ISA 61 VG油包水佐剂作为本疫苗的佐剂,研制了猪流行性腹泻灭活疫苗。

表12 免疫效果试验结果
疫苗作为外源物,尤其妊娠母猪对于应激反应更为敏感,所以,疫苗的安全性需要重点讨论。猪流行性腹泻主要是危害7日龄以内的仔猪,在这个时间段仔猪的抗体,主要来自母源抗体,在临床使用过程中,被动免疫就显得尤为重要[20]。因此,在临床试验中,主要进行了疫苗安全性试验、有效性试验和免疫效果试验,试验结果显示,免疫接种两次疫苗的妊娠母猪没有异常的应激反应,所产仔猪有理想的母源抗体,且在28日龄的中和抗体均维持在1∶32~1∶64之间;相对于不免疫的PEDV阳性母猪来说,免疫接种了的母猪所产仔猪,成活率提高了25%,说明该疫苗是安全且有效的。

