725例胶质瘤的临床特点和组织病理特征*
罗克莲,高勤,李木子
(贵州医科大学 临床医学院 病理学教研室,贵州 贵阳 550004)
胶质瘤是中枢神经系统最常见的原发性肿瘤,约占成人原发性恶性脑肿瘤的75%[1]。根据肿瘤在中枢神经系统实质内是否浸润,胶质瘤可分为弥漫性胶质瘤和局限性胶质瘤[2],而弥漫性胶质瘤是最常见的原发性恶性脑肿瘤[3-4]。胶质瘤组织学分类较多、且肿瘤组织的形态学复杂多样,这给胶质瘤的临床病理诊断及鉴别诊断带来困难。本研究回顾性分析725例胶质瘤手术切除标本的组织形态特点,结合免疫组织化学染色进行观察,分析不同类型胶质瘤的病理特征,为胶质瘤的临床病理诊断及鉴别诊断提供一定的依据。
1 材料与方法
1.1 材料
1.1.1标本来源 收集本院病理科2008年1月—2019年12月胶质瘤手术切除标本作为研究对象,并按WHO进行分级[5],即细胞核的异型性、核分裂象、微血管增生和坏死等四项指标。共纳入725例胶质瘤患者,男414例、女311例,年龄5~81岁、中位年龄42岁,脑组织690例、脊髓组织35例。
1.1.2主要试剂与仪器 神经胶质纤维酸性蛋白(glial fibrilary acidic protein,GFAP)、中枢神经特异蛋白(soluble protein,S-100)、波形蛋白(Vimentin)、少突胶质细胞因子-2(oligodendrocyte transcription factor2,Olig-2)、肿瘤蛋白53(tumor protein 53,P53)及增殖指数(proliferation index,Ki67)均购自上海基因科技有限公司。免疫组织化学试剂盒、乙二氨四乙酸二纳修复液(ethylenediaminetetraacetic acid disodium salt antigen retrieval solutio,EDTA)、二氨联苯胺显色试剂盒(3,3-N-diaminobenzidine tertrahydrochloride,DAB)及磷酸盐缓冲溶液(phosphate buffer saline,PBS)均购自北京中杉金桥。AxioLab.A1高清显微镜、HM325轮转式切片机、GeminiAS全自动染色机及ClearVue自动封片机购自美国Thermo公司。RHYⅢ病理组织漂烘仪(中威),ZYTEST-Ⅰ-40L超纯水机购自卓越公司,101-1AB电热鼓风恒温干燥箱购自泰斯特公司。
1.2 方法
1.2.1苏木精-伊红染色法(hematoxylin-eosinstaining,HE)对胶质瘤进行诊断及病理分级 石蜡样本3 μm厚的组织切片,65 ℃烤片30 min,二甲苯脱蜡3次、5 min/次,梯度酒精后水洗,经苏木精染液染色8 min,水洗,1%盐酸酒精分化30 s,水洗,碳酸锂饱和液返蓝2 min,水洗,95%酒精脱水后放入伊红(醇溶性)染色液中染色1 min,梯度酒精后无水乙醇2次、2 min/次,二甲苯透明2次、5 min/次,自动封片机封片。显微镜下观察细胞核被苏木精染成蓝色,细胞浆被伊红染成深浅不同的粉红色至桃红色。HE切片组织形态分级标准,WHOⅠ级:细胞核无异型性,细胞增生不活跃,无核分裂,无血管内皮细胞增生和坏死;WHOⅡ级:细胞核异型性较明显,细胞增生较活跃,偶见核分裂,无血管内皮细胞增生和坏死;WHOⅢ级:细胞密度增高,细胞核异型性明显,细胞增生活跃,可见较多核分裂象,无血管内皮增生及坏死;WHOIV级:细胞密度及核异型性显著增加,可见较多核分裂及病理性核分裂,出现明显的血管内皮增生及坏死。另外,少突胶质细胞肿瘤和室管膜肿瘤最高级别为WHOⅢ级,在前述WHOⅢ级的基础上可出现血管内皮细胞增生和坏死。
1.2.2免疫组织化学染色检测GFAP、S-100、Vimentin、Olig-2、P53及Ki67的表达 部分病例蜡块切3 μm组织切片,60 ℃烤片1 h,采用EnVision两步法染色,即二甲苯3次、5 min/次,无水乙醇2次、5 min/次,梯度酒精后水洗,EDTA煮沸高压修复法进行抗原修复,3%过氧化氢去除切片的非特异性染色,按说明书将现配好的一抗滴加在切片上,4 ℃冰箱过夜,PBS 3次、3 min/次,滴加二抗放置于37 ℃水浴箱孵育1 h,PBS 3次、3 min/次,DAB显色5~10 min,显色时间以显微镜下观察到棕黄色或棕褐色为宜,自来水终止显色,苏木精复染、分化及返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.3 统计学分析
采用SPSS 23.0软件对数据进行分析,计数资料以频数或率表示,数据比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各类胶质瘤WHO分级
725例胶质瘤中胶质母细胞瘤的检出最高,约占1/3,其次为弥漫型星形细胞瘤和间变型星形细胞瘤。见表1。
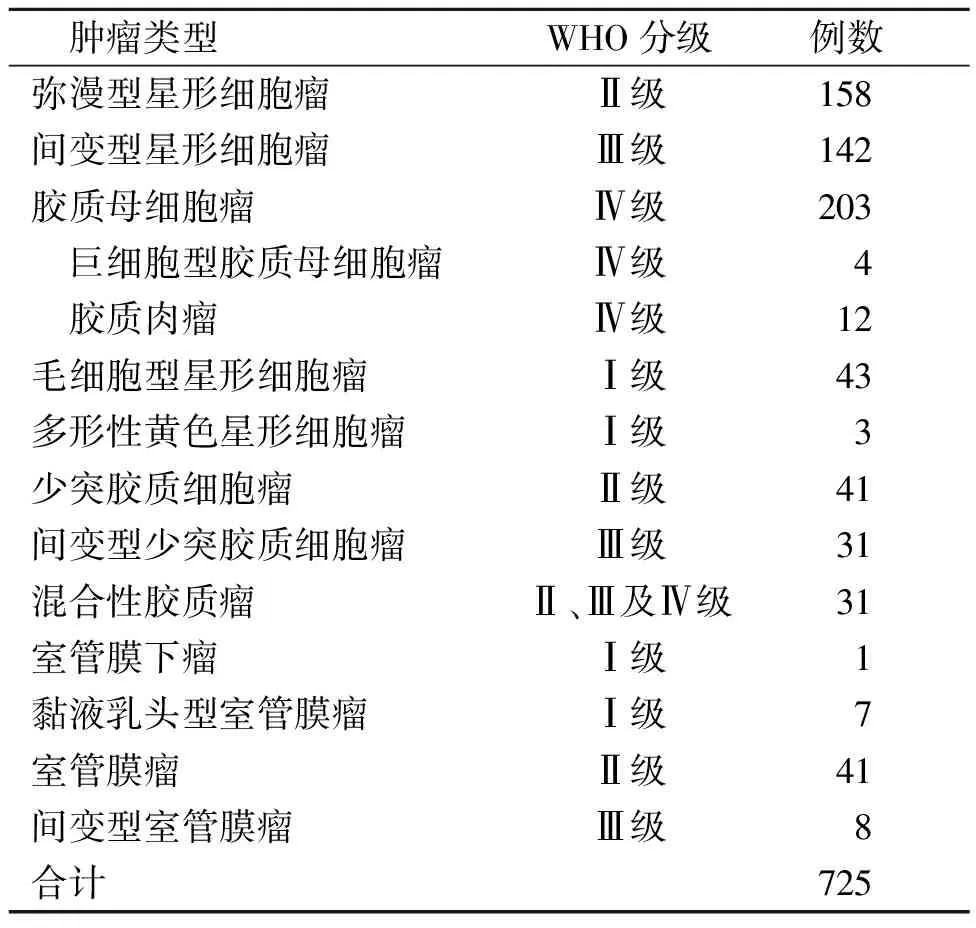
表1 725例胶质瘤患者肿瘤组织的WHO分级
2.2 胶质瘤患者的年龄和性别特点
除了间变型少突胶质细胞瘤和室管膜下瘤是女性略多于男性,其他各类胶质瘤均好发于男性;毛细胞型星形细胞瘤和多形性黄色星形细胞瘤好发于儿童和年轻人,平均年龄分别为23岁和24岁,而其他类型的胶质瘤好发于成年人。见表2。

表2 725例胶质瘤患者年龄和性别的分布情况(n)
2.3 各类胶质瘤患者的发病部位
毛细胞型星形细胞瘤好发于小脑和脑室,室管膜下瘤、黏液乳头型室管膜瘤和室管膜瘤常见于髓内;弥漫浸润型星形细胞瘤常见于额叶、颞叶以及多部位,如额顶叶、额颞顶枕叶、额叶、胼胝体、小脑、脑干、脑室前角、丘脑以及颞叶等。见表3。

表3 725例胶质瘤患者肿瘤的发病部位(n)
2.4 HE染色
725例胶质瘤中星形细胞肿瘤565例,其组织形态特征为星形胶质细胞样细胞增生伴异型性,弥漫型星形胶质细胞瘤密度轻度增加伴轻度异型性,核分裂象少见,其中肥胖型星形细胞瘤胞浆嗜酸染色,核偏位或居中,可见小核仁图1A。间变型星形细胞瘤细胞密度中度增加,异型性明显,可见病理性核分裂象图1B。胶质母细胞瘤细胞密度明显增加伴重度异型性,可伴有坏死和/或微血管增生,有多个亚型:(1)小细胞胶质母细胞瘤细胞小,可见假栅栏状坏死图1C;(2)巨细胞胶质母细胞瘤可见大量奇异形巨细胞图1D;(3)胶质肉瘤,具有胶质瘤和肉瘤成分的肿瘤组织,肉瘤区具有一些致密的长梭形细胞,胶质瘤区细胞密度中等图1E;(4)毛细胞型星形细胞瘤细胞密度轻度增加,具有双相性,可见Rosenthal纤维图1F。少突胶质细胞肿瘤72例,其组织特点为少突胶质样细胞密度增加,形态单一,核圆,核周有空晕,呈“蜂窝样”排列图1G,可有分枝状毛细血管网;而间变型少突胶质细胞异型性明显,可伴有微血管增生和病理性核分裂象。室管膜肿瘤57例,其组织形态不一。室管膜下瘤细胞形态大小一致,呈分叶状和簇状核,伴大量纤维间质图1H;黏液乳头型室管膜瘤呈乳头状结构图1I,被覆立方或柱状上皮伴黏液样变;室管膜瘤细胞排列呈Homer-wright菊形团和室管膜菊形团图1J;而间变型室管膜瘤的的细胞具有间变的特点,可伴有微血管的增生图1K。混合性胶质瘤31例,其组织形态特征要根据混合胶质瘤成分来定,包括两种或更多的胶质瘤成分,图示为少突胶质细胞瘤和室管膜瘤成分的混合性胶质瘤图1L。
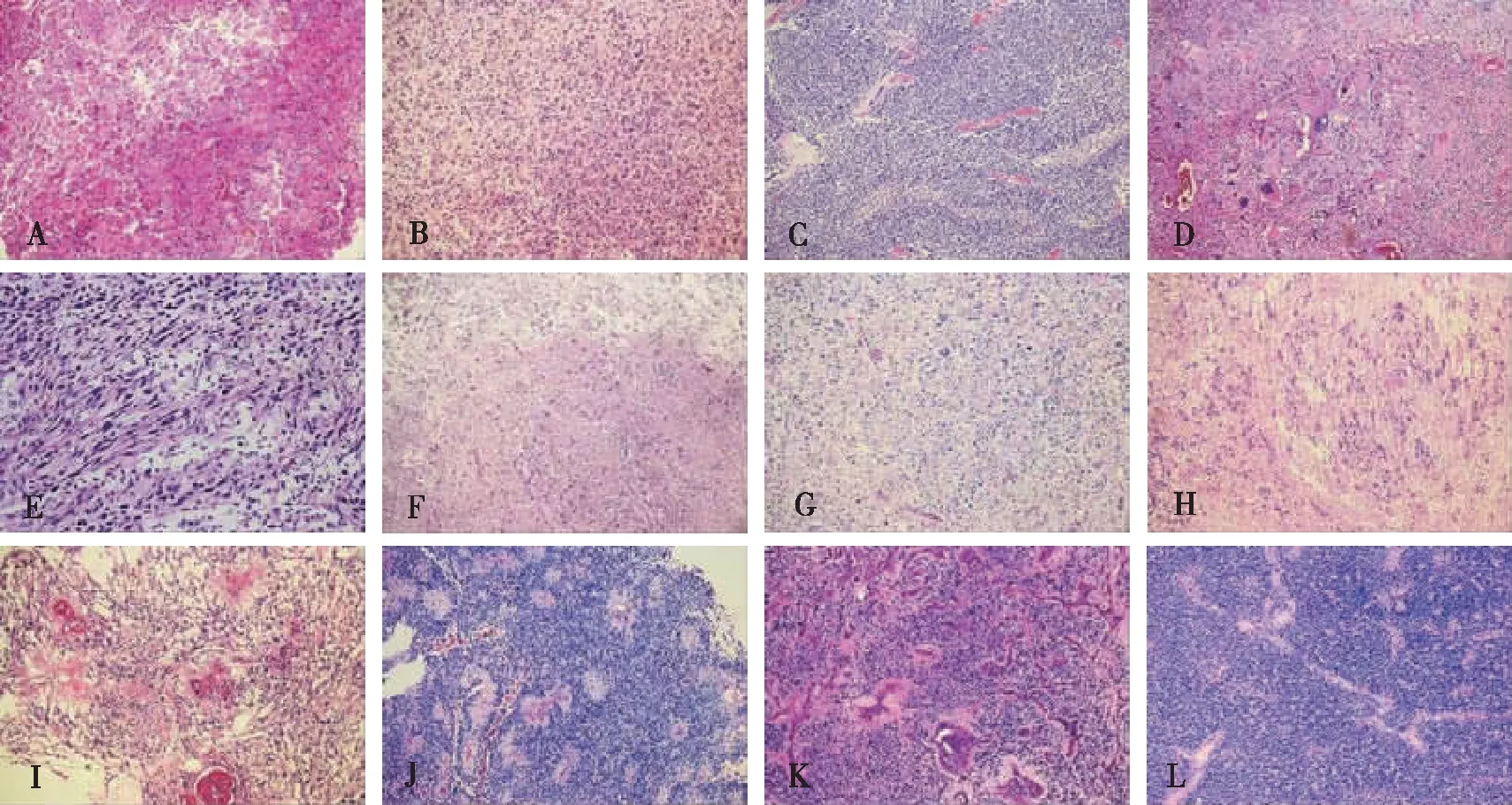
注:A~D分别为肥胖细胞型星形、间变型星形、小细胞胶质及巨细胞胶质母细胞瘤;E~H分别为胶质肉瘤、毛细胞型星形细胞瘤、少突胶质细胞瘤及室管膜下瘤;I~L分别为黏液乳头型室管膜瘤、室管膜瘤、间变型室管膜瘤及混合性胶质瘤。
2.5 免疫组织化学染色
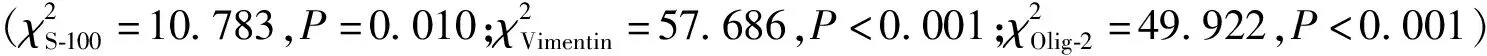

表4 725例胶质瘤标本免疫组织化学染色的阳性表达[n(%)]
3 讨论
胶质瘤占原发性中枢神经系统恶性肿瘤的80%,包括星形细胞肿瘤、少突胶质细胞肿瘤、室管膜肿瘤和混合性胶质瘤,本研究中星形细胞肿瘤约占78%,各年龄段均有发生,以额叶、颞叶和多部位发病多见,这与文献报道一致[6]。弥漫浸润型星形细胞瘤是最常见的星形细胞肿瘤,包括弥漫型星形细胞瘤、间变型星形细胞瘤和胶质母细胞瘤,其中胶质母细胞瘤是最常见的胶质瘤,约占30%,多见于30~50岁成年人,其恶性程度高,5年生存率仅5%[1,7-9],其可从低级别发展而来,年轻人多见;也可发生于老年人,无临床或组织学证据表明恶性程度较低的胶质瘤[10-12],称为原发性胶质母细胞瘤。胶质母细胞瘤好发于额叶及颞叶,但本研究中脑室9例、小脑3例及脊髓1例。毛细胞型星形细胞瘤儿童和青少年最常见,而本研究中多见于10~30岁,男女发病率基本相同,好发于小脑和脑室,文献报道其可以发生在大脑的任何部位,但以小脑、脊髓和视神经通路最常见,Rosenthal纤维是其特征之一[13]。多形性黄色星形细胞瘤是一种少见的肿瘤,多发生于儿童和年轻人,几乎位于幕上,颞叶是一个好发的部位[14],本研究中共3例,其中颞叶2例、脑室1例,发病年龄21~30岁,平均年龄24岁,2例男性,1例女性,以囊性成分和广泛的软脑膜受累为主要表现。本研究中少突胶质细胞肿瘤仅占胶质瘤的1%,是一种弥漫浸润的成人胶质瘤,儿童少见,男 ∶女为1 ∶1,其中少突胶质细胞瘤细胞密度中等,核小到中等大小、圆形、均匀,核周有空晕,病理性核分裂活跃、显著微血管增生和/或坏死表明肿瘤进展为间变性少突胶质细胞瘤。室管膜肿瘤较小的一部分被诊断为室管膜下瘤或粘液乳头型室管膜瘤。室管膜下瘤是一种生长缓慢的肿瘤,好发于侧脑室或第四脑室,约占中枢神经系统肿瘤的0.2%~0.7%,本研究中仅有1例45岁女性患者,发生于髓内,室管膜下瘤最常见于中老年患者,偶尔有家族史。生长缓慢,是脑室内或脊髓内界限清楚的肿瘤,组织学上表现为丰富的、少细胞的、纤维基质中的单形核簇,可伴微囊形成,可有核多形性,但不具有预后意义,该病通常手术是可以治愈的,因此预后良好[15]。黏液乳头状室管膜瘤缺乏室管膜瘤典型的管腔和胞浆内点状上皮膜抗原(epithelial membrane antigen,EMA)染色,尤其是在不完全切除术后,粘液乳头状室管膜瘤的临床表现可能比室管膜下瘤更具侵袭性[16]。总的来说预后很好,有些病人切除后是可以治愈的,然而也可能会复发和转移[17]。室管膜瘤任何年龄均有发生,男女比例略相等,后颅窝是儿童更常见的部位[18],成人好发于脑室和髓内,其特征是肿瘤细胞形成血管周围假菊形团、室管膜菊形团和室管膜腔隙,该肿瘤界限清楚也是诊断的要点[19]。间变型室管膜瘤好发于年轻人,室管膜肿瘤的分子分类现在对于诊断是至关重要的,已有多项研究表明,分子定义的亚群,而不是组织定义的亚群与预后和其他临床参数有更好的相关性[20]。混合性胶质瘤男女比例约为2 ∶1,核分裂少,常见微小钙化和微囊形成,有时很难区分混合性胶质瘤和弥漫性胶质瘤,最常见的是少突星形细胞瘤,常同时具有星形细胞瘤和少突胶质瘤的组织学特征,31例中1例为星形细胞瘤伴室管膜瘤的混合性胶质瘤,这种肿瘤很少见。
免疫组织化学标记有助于胶质瘤的诊断和鉴别诊断,并非所有的胶质瘤都恒定表达[21]。GFAP是识别胶质分化的一个关键标志物[22],胶质瘤细胞GFAP染色有助于胶质瘤的诊断,本研究中353例GFAP标记中有3例阴性,但阴性也不能排除胶质瘤的诊断。几乎所有的胶质瘤都表达S-100蛋白,使其成为敏感标记物[2]。然而,由于该蛋白也表达在多种其他细胞中,因此S-100表达是一种相对非特异性的胶质瘤标记物。46例少突胶质细胞肿瘤中只有17例Vimentin阳性表达,而另外三类胶质瘤基本上阳性表达,这可为胶质瘤的鉴别诊断提供帮助。52例少突胶质细胞肿瘤中Olig-2均阳性表达,星形细胞肿瘤及混合性胶质瘤少数病例阴性表达,而室管膜肿瘤中室管膜下瘤及黏液乳头型室管膜瘤均未表达,室管膜瘤少数病例阳性。有研究表明Olig-2是少突胶质细胞瘤的特征性标记物[23],在胶质母细胞瘤中的表达差异大,高表达预后好[24],说明该标记物有助于鉴别星形细胞瘤和少突胶质细胞瘤与室管膜瘤,因为后者的Olig-2染色通常有限或不存在[25]。Ki-67是一个核抗原标记,其比例反映了细胞增殖活性的水平[26]。有文献报道弥漫性胶质瘤的Ki-67标记指数通常随着恶性程度的增加而增加,低级别弥漫性胶质瘤的Ki-67标记指数<5%,间变性胶质瘤的Ki-67标记指数为5%~10%,胶质母细胞瘤的Ki-67标记指数>10%,可作为星形细胞肿瘤恶性程度和预后的参考指标[27]。
综上所述,胶质瘤是中枢神经系统最常见的原发性肿瘤,男性多见于女性,有弥漫性胶质瘤和非扩散性胶质瘤两种,根据分类的不同,好发年龄也不同,免疫表型的阳性程度为胶质瘤的诊断和鉴别诊断提供一定的依据。

