苜蓿幼苗对铝胁迫的生理响应及综合评价
孙文君, 杨蔚, 许文花, 任健, 韩博, 张冉, 马向丽
苜蓿幼苗对铝胁迫的生理响应及综合评价
孙文君1, 杨蔚2, 许文花1, 任健1, 韩博1, 张冉1, 马向丽1
(1. 云南农业大学动物科学技术学院, 昆明 650201; 2. 红云红河集团昆明卷烟厂, 昆明 650202)
为探讨铝胁迫对苜蓿()幼苗生长和生理特性的影响,对铝胁迫下苜蓿地上和地下生物量、光合色素及根尖胼胝质含量进行测定,并对根尖结构进行观察,最后采用隶属函数分析法对苜蓿耐铝性进行评价。结果表明,随着铝胁迫的增加,苜蓿地上、地下部分生物量呈降低趋势,低浓度和高浓度铝胁迫使苜蓿生物量显著下降(<0.05);苜蓿的叶绿素含量呈下降趋势,胼胝质积累量增多;中、高浓度铝胁迫使根尖胼胝质含量显著上升。随铝胁迫浓度升高,根尖横切面细胞发生较大变化,尤其在高浓度时,细胞干瘪且排列紊乱。隶属函数分析结果表明,No. 12和No. 18苜蓿材料的耐铝性较好,可在南方酸性富铝化土壤中推广应用。
苜蓿;铝胁迫;生物量;叶绿素;幼苗;生理
酸性土壤已覆盖我国长江以南15个省区,总面积约占全国总耕地面积的21%[1],红黄壤土地面积大,具脱硅富铝化成土过程,致使铝毒害日益严重[2]。铝毒害作为酸性土壤中植物生长发育的主要限制因子[3],主要以铝的氧化物或铝硅酸盐等固定态铝的形式存在于自然条件下,可供生物利用价值较小[4]。酸性土壤中铝毒对植物的危害首先作用于根部,反映于根部形态和生理特征[5]:破坏植物根尖结构,阻碍植物根系对营养元素的吸收,进而使植株地上茎、叶生长发育受抑制,最终致使产量和品质下降或停止生长[6–11]。
苜蓿()是世界上栽培面积最大、栽植最早、经济价值最高的牧草,有改良土壤、保持水土等作用,因而有“牧草之王”之美誉[12]。苜蓿作为全球最重要的优良豆科牧草,对生态环境的改善起着重要作用,对于牲畜而言,优良的苜蓿干草胜过一切优质的粗饲料[13],但由于其抗酸铝能力差,极大地限制了在我国南方地区的种植[5]。
目前,国内外关于铝对麦类[9]植物、大豆()和水稻()[14]等农作物的毒害和耐铝毒机理等方面的研究已有较多报道,但对苜蓿耐铝性研究相对较少;且由于苜蓿材料和耐铝性评价体系不同,仍未见报道强耐铝苜蓿资源。因此,研究酸铝胁迫下苜蓿幼苗生长状况,筛选耐铝性品种便显得十分重要。本研究测定了8份苜蓿属种质材料在铝胁迫下的地上和地下部分生物量、叶片光合色素和根尖胼胝质含量,并观察苜蓿根尖细胞对铝毒的敏感度,最后采用隶属函数分析法进行耐铝性综合评价,为开展苜蓿耐铝性研究奠定基础,亦为后期筛选耐铝性较强的苜蓿品种提供理论依据。
1 材料和方法
1.1 材料来源
前期课题组于云南省各地州进行苜蓿资源调查,收集到云南野生和逸生苜蓿()种质资源30份。通过栽种和生产性能的评价鉴定,筛选出生长状况良好、且采集地pH值和生存环境差异性较大的8份材料(表1),并进行繁殖收种,用作耐铝性鉴定[15]。
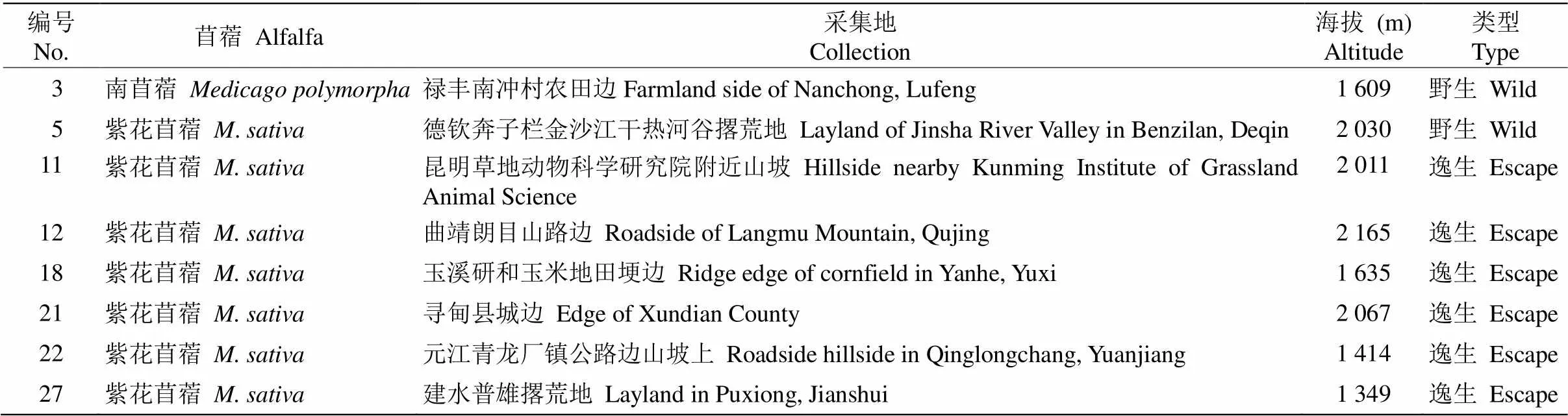
表1 云南8份野生和逸生苜蓿材料的采集地点
1.2 培养和处理
在人工智能温室中,采用12孔育苗盘、珍珠岩育苗,发芽后浇Hoagland完全营养液培育10 d,然后开始铝胁迫处理;将营养液pH调至4.5,用AlCl3配置成浓度为0、50、100、200、500mol/L的铝溶液,胁迫处理10 d。试验期间,隔3 d更换1次营养液。铝胁迫处理后进行指标测定。
1.3 方法
生物量 随机选取20株,用滤纸吸干根、茎、叶的水分,置于分析天平分别称量地上、地下部分鲜质量。
光合色素含量 随机剪取20株苜蓿新鲜叶片,参照王爱玉等[16]的方法,取0.1 g叶片于95%乙醇中避光浸泡96 h后用分光光度计在470、649、665 nm波长下测定吸光值,计算叶片叶绿素(Chl) a、Chl b、Chl a+b和类胡萝卜素(Car)的含量,重复3次。
根尖胼胝质含量 参考Kohle等[17]的方法,随机剪取5株根尖5 mm的根段,经研磨、提取、高温(80℃)水浴、冷却后加入苯胺蓝显色液,并吸取上清液与空白液混匀,采用荧光分光光度法测定,计算胼胝质含量,重复3次。
根尖切片的显微观察 随机切取10株苜蓿1 cm长根尖,用200 mL蒸馏水浸泡15 min,再用50 mL 0.2%苏木精溶液染色20 min,在根尖0~3 mm处切薄片,置于显微镜200×物镜下观察根尖细胞形态并拍照。
综合评价 采用隶属函数法进行。与耐铝性呈正相关的指标(叶绿素、生物量)用(X)=(X–Xmin)/(Xmax–Xmin)计算隶属函数值; 与耐铝性呈负相关的指标(胼胝质含量)用(X)=1–(X–Xmin)/ (Xmax–Xmin)计算隶属函数值; 用(X)=SX/计算某胁迫浓度下苜蓿各指标的隶属函数值,式中,(X)为处理指标的耐铝隶属函数值;X为处理指标的测定值;Xmax为最大值;Xmin为最小值;X为处理的耐铝隶属函数值的平均值;为指标数。
1.4 数据分析
用Excel 2010和SPSS 20.0进行数据统计及作图,并进行单因素方差分析。
2 结果和分析
2.1 对苜蓿地上、地下生物量的影响
铝胁迫抑制苜蓿地上生物量的积累(表2),随着铝胁迫浓度的增加,苜蓿地上部分生物量均显著降低(<0.05),以500mol/L铝浓度时最低。其中, No. 11和No. 21苜蓿在铝浓度为500mol/L时表现较迟钝,地上生物量降低幅度有所减缓,与200mol/L的差异不显著(>0.05)。
从表3可见,随着铝胁迫浓度的增加,苜蓿的地下部分生物量也呈下降趋势。低浓度(50mol/L)铝胁迫时,地下部分生物量比对照显著下降(< 0.05)。No. 11、No. 18和No. 21苜蓿在≤100mol/L铝处理时,地下部分生物量显著降低(<0.05),而当胁迫浓度为200mol/L时,其地下部分生物量虽有下降,但差异不显著(>0.05),这表明3份苜蓿在中、高浓度铝胁迫下产生了一定抗性。但随胁迫浓度继续升高,地下部分的耐受力减弱,所有苜蓿地下部分生物量均呈显著下降趋势(<0.05)。
2.2 对叶片叶绿素含量的影响
叶绿素a含量 由图1可看出,铝处理抑制苜蓿叶绿素(Chl) a的合成,但不同苜蓿对胁迫的敏感性不同。当铝浓度为50mol/L时,所有苜蓿叶片的Chl a含量比对照显著减少(<0.05),说明苜蓿遭受逆境胁迫能立即响应;随着铝浓度的增加,所有苜蓿叶片的Chl a含量与对照间的差异均达显著水平(<0.05),且当铝浓度增至500mol/L时,Chl a含量降至最低;其中,No. 11、No. 12、No. 22和No. 27苜蓿在中、高浓度(100、200mol/L)铝胁迫时,Chl a含量均无显著变化(>0.05)。
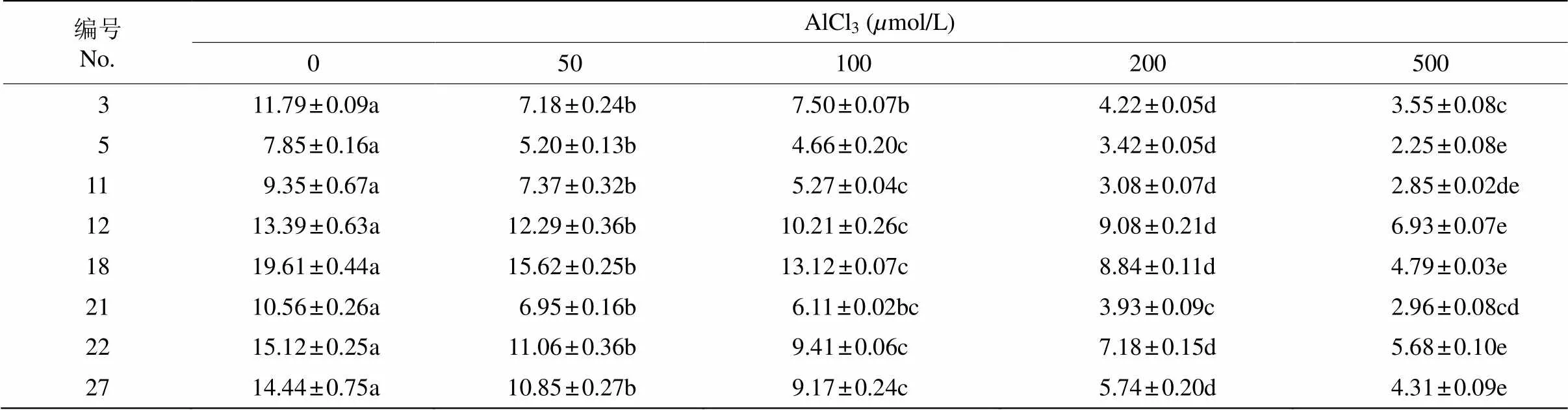
表2 铝胁迫对苜蓿地上部分生物量(g)的影响
同行数据后不同字母表示差异显著(<0.05)。编号见表1。下表同。
Data followed different letters in the same line indicate significant difference at 0.05 level. No. see Table 1. The same is following Tables.
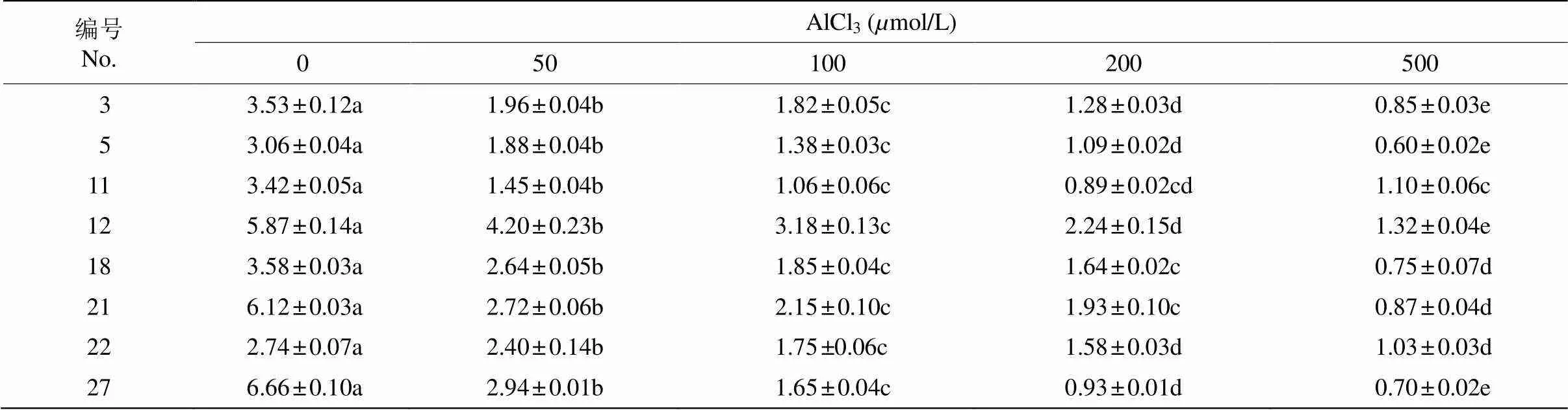
表3 铝胁迫对苜蓿地下部分生物量(g)的影响
Chl b含量 由图1可见,随着铝胁迫浓度的增加,苜蓿叶片中Chl b含量均有不同程度的下降,但较Chl a含量变化平缓。其中,低浓度(50mol/L)铝胁迫对No. 3和No. 5苜蓿的Chl b含量有促进作用,比对照升高,但随胁迫的增强, Chl b含量显著下降(<0.05);No. 11和No. 27苜蓿在100mol/L铝胁迫时,Chl b含量虽有下降,但与50mol/L铝胁迫的差异不显著(>0.05); No. 12和No. 21苜蓿受铝胁迫的Chl b含量均比对照显著下降,但各胁迫处理间的Chl b含量差异不显著。
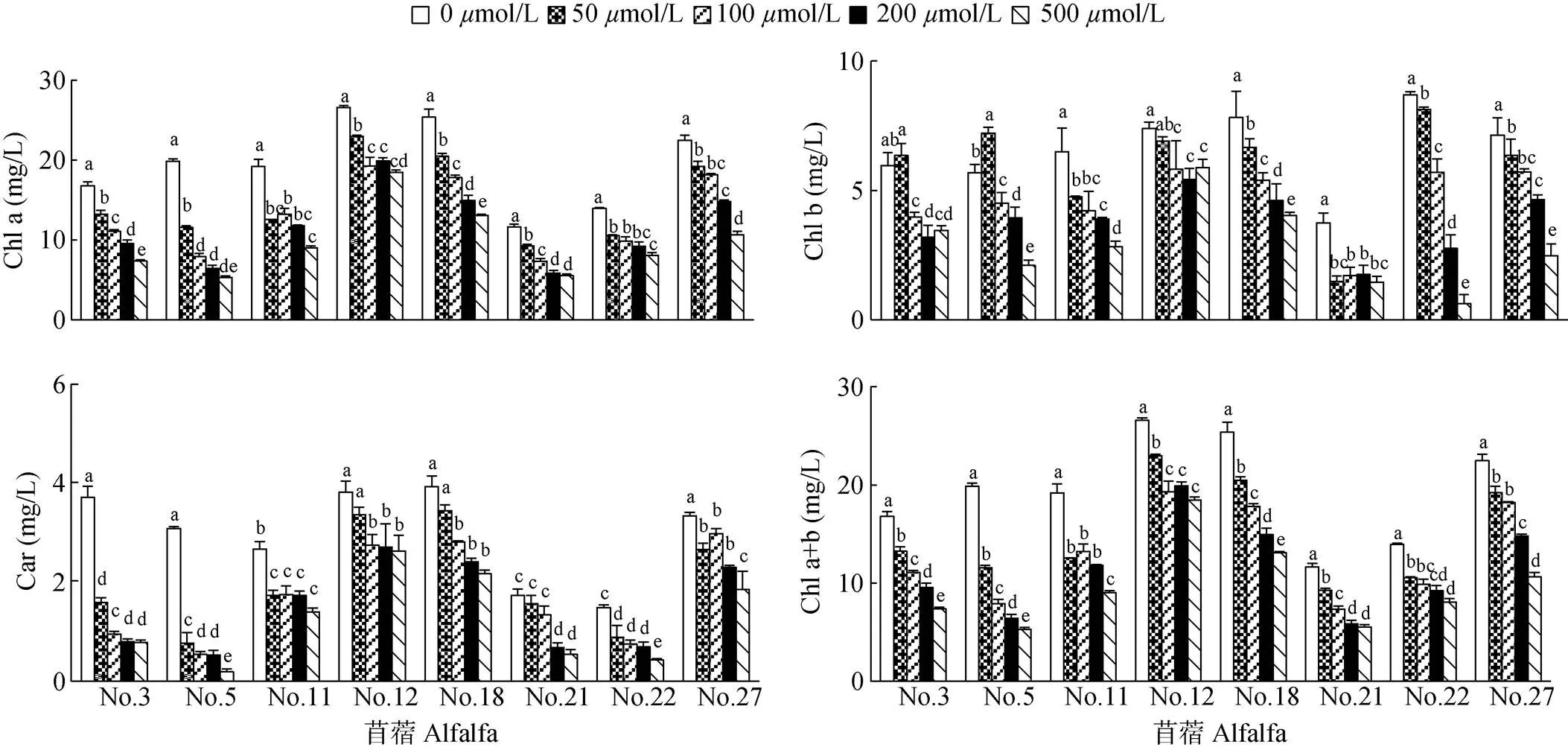
图1 铝胁迫对苜蓿光合色素含量的影响。柱上不同字母表示差异显著(P<0.05)。
类胡萝卜素含量 从图1可见,苜蓿叶片的类胡萝卜素(Car)含量随铝胁迫浓度的增加呈下降趋势。No. 11、No. 22、No. 27苜蓿叶片的Car含量在50~200mol/L铝胁迫时下降,但未达显著差异;No. 12苜蓿受中、高浓度(100~500mol/L)铝胁迫时,Car含量变化不显著,说明其对铝胁迫敏感度较低,存在一定耐受性。
Chl a+b含量 由图1可知,铝处理抑制苜蓿叶绿素的合成,铝胁迫浓度为500mol/L时Chl a+b含量最低,各处理间的差异显著(<0.05)。但不同材料对不同胁迫浓度的反应敏感性不同,其中,No. 22苜蓿的Chl a+b含量在50~500mol/L铝胁迫下的差异不显著(>0.05), No. 11的Chl a+b含量在50~200mol/L铝胁迫下的差异不显著(> 0.05),当胁迫浓度达500mol/L时显著下降;而No. 12苜蓿叶片Chl a+b含量受≥200mol/L铝胁迫时的变化不显著。
2.3 对根尖胼胝质含量的影响
从图2可见,随着铝胁迫浓度升高,苜蓿根尖的胼胝质含量逐渐升高。No. 3、No. 21和No. 22苜蓿的根尖胼胝质含量在中、高浓度(200、500mol/L)铝胁迫时虽有升高,但差异不显著(>0.05),可能是对铝胁迫产生了一定的适应性。
2.4 根尖的显微观察
苜蓿经铝胁迫处理后,根尖横切面的细胞变化明显(图3)。对照(0mol/L)的苜蓿根尖细胞排列规则且均匀饱满,各组织结构清晰可辨。经铝胁迫处理后,细胞排列紊乱,表层细胞大量脱落,且随胁迫浓度增加而更加明显。在500mol/L铝胁迫下,细胞排列不规则且干瘪,皮层薄壁组织细胞的细胞壁形态异常。
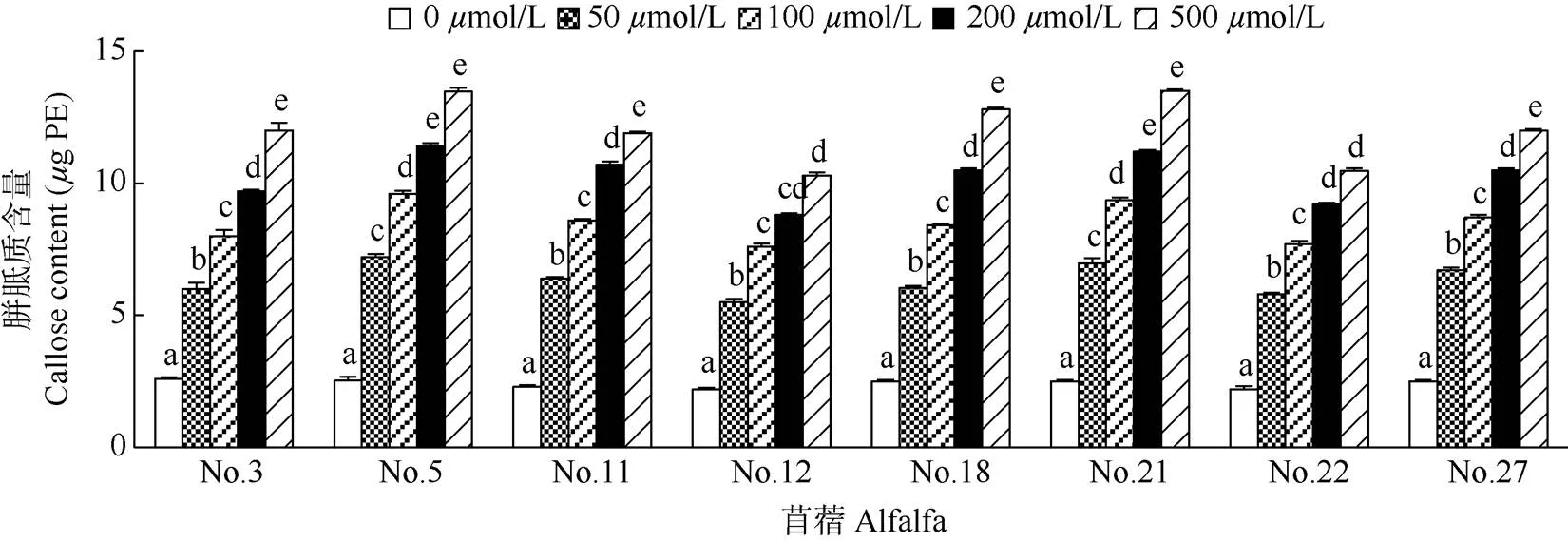
图2 铝胁迫对根尖胼胝质含量的影响
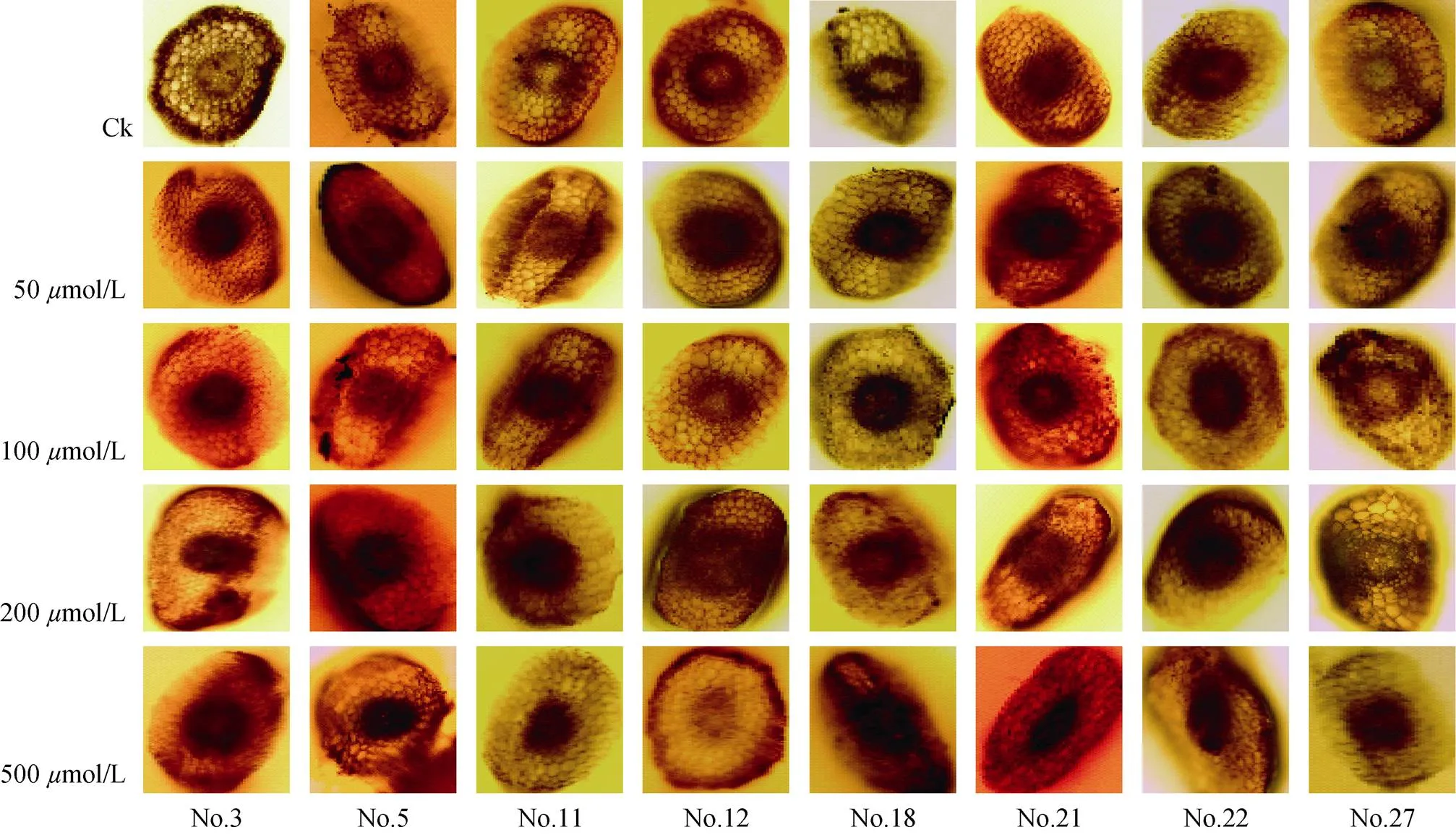
图3 根尖横切片(200×)
2.5 综合评价
采用隶属函数分析法对8份苜蓿材料的耐铝性进行评价(表4), 结果表明,在铝浓度为50mol/L时,苜蓿耐铝性的排序为: No. 12>No. 18>No. 27>No. 22> No. 3>No. 11>No. 5>No. 21;当浓度为100mol/L时,排序为: No. 12>No. 18>No. 27>No. 22>No.3> No. 11>No. 5>No. 21;当浓度为200mol/L时,排序为: No. 12>No. 18>No. 27>No. 22>No. 3>No. 11> No. 21>No. 5; 当浓度为500mol/L时, 排序为: No. 12>No. 18>No. 22>No. 27>No. 11>No. 3>No. 21> No. 5。可见,No. 12和No. 18苜蓿的表现较好,No. 21和No. 5苜蓿的表现较差。
3 结论和讨论
3.1 铝胁迫抑制苜蓿生长发育
生物量是植株生长状况的直观反应,可作为筛选耐性品种的重要依据指标[18]。本研究结果表明,随铝胁迫浓度增加,苜蓿生长受到抑制,耐受性减弱,地上、地下部分生物量减少。但胁迫浓度在一定范围内,生物量的变化趋于平缓,No. 3、No. 21苜蓿在100mol/L浓度胁迫时地上部分生物量的下降幅度比50mol/L的小(表2);No. 11、No. 18苜蓿在200mol/L胁迫时的地上部分生物量的下降幅度比100mol/L的小(表3)。逆境环境下,植物可通过改变生理适应机制及其形态策略来应对胁迫[19],其生长受抑制程度会趋于平缓,但当超过该限度时,便会影响植物正常代谢和生长发育进程。严重铝胁迫会阻碍植物代谢,从而影响植物正常生长,减少生物量的累积,这与前人[20–22]的研究结果一致。
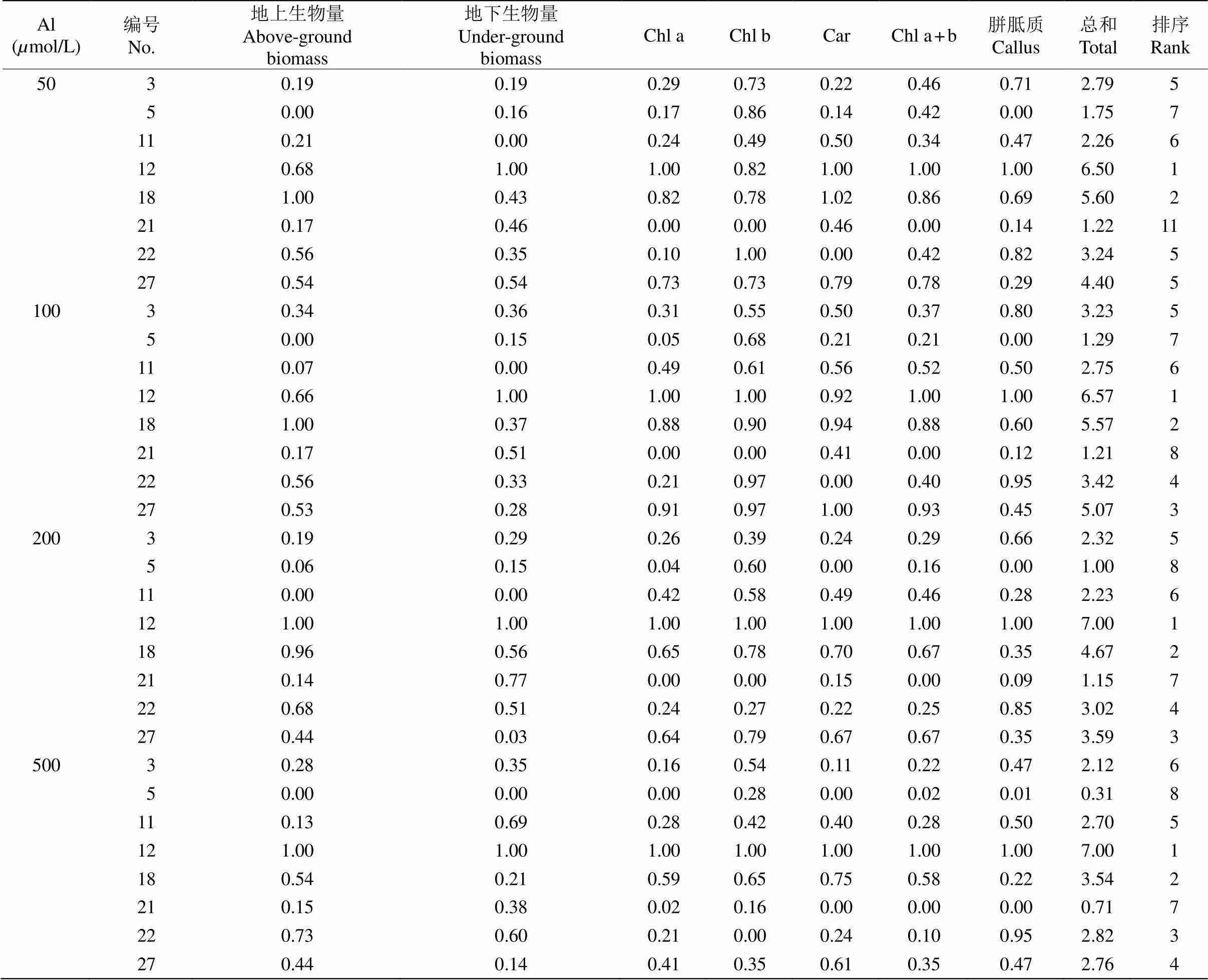
表4 苜蓿耐铝毒性的隶属值
3.2 铝胁迫降低光合色素含量
本试验中,铝胁迫下8份苜蓿材料叶片的Chl和Car含量均比对照下降,且Chl a含量比Chl b含量减少得更多。肖祥希等[23]对铝胁迫下龙眼()生长影响的研究也有相同结论。Al3+会破坏苜蓿叶片的光合色素系统,使光合色素合成受阻或加速降解,导致光合色素含量降低,但不同苜蓿对Al3+的耐受性存在差异,因而对不同浓度的铝胁迫敏感性不同。No. 3、No. 5苜蓿叶片的Chl b含量呈先升后降的变化(图1),这与李贞霞等[24]报道辣椒()对铝胁迫响应结果一致,低浓度铝胁迫可能促进Chl b的合成,或者是物种对低浓度铝胁迫反应不敏感,然而随胁迫浓度加大,则表现出不耐受反应。植物叶片中Car能猝灭不稳定的三线态叶绿素的功能,并具有强氧化作用,对光合膜有潜在作用的单线态氧,从而达到保护受光激发的叶绿素免遭光氧化破坏的效果,以减少光合膜受单线态氧的损伤[23]。有研究表明[19,25–26],当植物处于逆境胁迫环境时,会使体内的Car含量升高。一般认为,抗逆性较好的植物叶片的Car含量普遍较高。但在本试验中,铝胁迫下8份苜蓿材料的Car含量均比对照下降,这与张永锋等[26]的研究结果不一致,这可能是由于植物的抗氧化保护系统的抵抗修复能力存在一定阈值[27],如果逆境胁迫超过该阈值,其抗氧化保护系统也会降低或丧失保护功能,因此铝胁迫将导致苜蓿抗逆性的降低。
3.3 铝毒害诱导苜蓿根尖胼胝质形成
铝作为一种酸性土壤中较为常见的矿质逆境元素,对植物的毒害在外观上主要表现为根系伸长受抑制[28],质外体和细胞壁作为植物最早与铝接触的部位,铝可被表皮或皮层细胞的细胞壁强烈吸附[29],因此,铝毒害会影响纤维素的合成,继而诱导胼胝质的形成[30–31],并且随着铝胁迫浓度的升高,胼胝质含量也增加。这已在多种植物中报道,如燕麦()[32]、小麦()[28,33]、大麦()[30]、玉米()[34–35]、烟草()[36]、菜豆()[37]和挪威云杉()[38]。本研究中,苜蓿材料均在遭受低浓度铝胁迫时迅速在根尖累积胼胝质,并随着铝胁迫浓度升高,胼胝质含量逐渐增高,也有部分苜蓿材料在高浓度铝胁迫时,根尖胼胝质含量变化不显著(>0.05)。有研究表明[39–41],植物在受到机械损伤、生理逆境或病菌感染时,胼胝质合酶催化大量合成胼胝质;并且,铝诱导胼胝质的形成是一个迅速而又敏感的生理反应[42],这与本试验结果一致。铝诱导根尖胼胝质的形成比根伸长的研究更可靠,因此被广泛应用在植物耐铝性机制的研究中。
3.4 铝胁迫导致苜蓿根尖细胞排列紊乱
一般认为,根尖是铝毒害的最初作用部位,于外表现在根尖形态的变化,于内则表现为细胞结构的破坏。本试验中,8份苜蓿材料根尖细胞随铝胁迫浓度增加而变化明显,细胞排列紊乱且表皮细胞受损严重,这与Delhaize等[29]对小麦铝耐性研究结果一致,植物对铝毒的敏感程度与根系中的铝含量呈正相关。由于Al3+在根尖细胞壁中大量积累造成破坏,使得细胞结构、排列发生改变。
综合分析表明,No. 12和No. 18苜蓿在铝胁迫处理中的表现均较好,有较高的耐受性;其次为No. 27、No. 22、No. 3和No. 11;No. 21和No. 5苜蓿,耐受性较低。
[1] XU F F, HU H Y, WANG A B. Effect of aluminum stress on chloro- phyll content and fluorescence parameters of kudzu [J]. Mol Plant Breed, 2019, 17(8): 2681–2684. doi: 10.13271/j.mpb.017.002681. 徐芬芬, 胡海瑶, 王爱斌. 铝胁迫对野葛叶绿素含量和叶绿素荧光参数的影响 [J]. 分子植物育种, 2019, 17(8): 2681–2684. doi: 10. 13271/j.mpb.017.002681.
[2] SUN W J, TANG M, REN J, et al. The physiological tolerance response of 8 alfalfa species in Yunnan to aluminum stress [J]. Acta Agrest Sin, 2018, 26(5): 1190–1197. doi:10.11733/j.issn.1007-0435.2018.05.001. 孙文君, 唐敏, 任健, 等. 8份云南苜蓿属优异种质资源对铝胁迫的生理耐受响应研究 [J]. 草地学报, 2018, 26(5): 1190–1197. doi:10. 11733/j.issn.1007-0435.2018.05.001.
[3] HU X H, LI Y, ZOU T C. Studies on physiological responses to aluminum stress of[J]. J Trop Subtrop Bot, 2014, 22(5): 495–501. doi: 10.3969/j.issn.1005-3395.2014.05.011.胡雪华, 李蕴, 邹天才. 车前对铝胁迫生理响应的研究 [J]. 热带亚热带植物学报, 2014, 22(5): 495–501. doi: 10.3969/j.issn.1005-3395. 2014.05.011.
[4] KONG F X, SANG W L, JIANG X, et al. Aluminum toxicity and tolerance in plants [J]. Acta Ecol Sin, 2000, 20(5): 855–862. doi: 10. 3321/j.issn:1000-0933.2000.05.023.
[4]孔繁翔, 桑伟莲, 蒋新, 等. 铝对植物毒害及植物抗铝作用机理 [J]. 生态学报, 2000, 20(5): 855–862. doi: 10.3321/j.issn:1000-0933.2000. 05.023.
[5] XIONG J B, LIU Y, CAI H, et al. Study on aluminum acid resistance of alfalfa [J]. Hubei J Anim Vet Sci, 2014, 35(11): 74–78. doi: 10.3969/ j.issn.1007-273X.2014.11.046.熊军波, 刘洋, 蔡化, 等. 紫花苜蓿耐酸铝研究 [J]. 湖北畜牧兽医, 2014, 35(11): 74–78. doi: 10.3969/j.issn.1007-273X.2014.11.046.
[6] MA L, YANG S C. Effect of al on physiological characters ofseedlings [J]. Acta Hydrobiol Sin, 2011, 35(1): 145–152. doi: 10.3724/SP.J.1035.2011.00145. 马丽, 杨盛昌. 铝对秋茄幼苗生理特性的影响 [J]. 水生生物学报, 2011, 35(1): 145–152. doi: 10.3724/SP.J.1035.2011.00145.
[7] SHEN R F. Behavior of Aluminum in Soil-plant and the Adaptation Mechanism of Plants [M]. Beijing: Science Press, 2008: 1–22.沈仁芳. 铝在土壤-植物中的行为及植物的适应机制 [M]. 北京: 科学出版社, 2008: 1–22.
[8] YAN J, LIU J X. Advance in studies on aluminum tolerance of grass [J]. Acta Pratac Sin, 2008, 17(6): 148–155. doi: 10.3321/j.issn:1004-5759. 2008.06.021. 阎君, 刘建秀. 草类植物耐铝性的研究进展 [J]. 草业学报, 2008, 17(6): 148–155. doi: 10.3321/j.issn:1004-5759.2008.06.021.
[9] YANG Y, WANG W, LIU H, et al. Effects of aluminum stress on root elongation of different aluminum tolerance wheat cultivars [J]. Plant Nutri Fert Sci, 2010, 16(3): 584–590. doi: 10.11674/zwyf.2010.0310. 杨野, 王伟, 刘辉, 等. 铝胁迫对不同耐铝小麦品种根伸长生长影响的研究 [J]. 植物营养与肥料学报, 2010, 16(3): 584–590. doi: 10. 11674/zwyf.2010.0310.
[10] DENG X M. The influence of insoluble phosphorus on the growth, inorganic phosphorus and antioxidant enzymes activities of ectomy- corrhizal fungi under acid aluminum stress [D]. Chongqing: Southwest University, 2017: 1–9.邓雪梅. 酸铝胁迫下难溶性磷对外生菌根真菌生长、无机磷形态及抗氧化酶活性的影响 [D]. 重庆: 西南大学, 2017: 1–9.
[11] WU L F, WEI X M, ZHANG L F, et al. Analysis on acid-aluminum stress response of two wild alfalfa resources in Yunnan [J]. Chin J Trop Crops, 2020, 41(3): 482–488. doi: 10.3969/j.issn.1000-2561.2020.03.009.吴丽芳, 魏晓梅, 张丽芳, 等. 云南2种野生苜蓿资源对酸铝胁迫的响应分析 [J]. 热带作物学报, 2020, 41(3): 482–488. doi: 10.3969/j. issn.1000-2561.2020.03.009.
[12] MAO X P, LIU Y, ZHAO G L, et al. Effect of drip irrigation on different varieties of alfalfa in Xinjiang [J]. Pratac Sci, 2017, 34(5): 1049–1056. doi: 10.11829/j.issn.1001-0629.2016-0352. 毛新平, 刘彦, 赵国良, 等. 13个紫花苜蓿品种对滴灌模式的适应性 [J]. 草业科学, 2017, 34(5): 1049–1056. doi: 10.11829/j.issn.1001- 0629.2016-0352.
[13] HUANG H B. Role of alfalfa diet in dairy cattle production [J]. J Anim Husb Vet Med, 2004(11): 61. doi: 10.3969/j.issn.1671-6027.200411. 051. 黄宏波. 苜蓿型饲粮在奶牛生产中发挥的作用 [J]. 畜牧兽医科技信息, 2004(11): 61. doi: 10.3969/j.issn.1671-6027.2004.11.051.
[14] HARTWELL B L, PEMBER F R. The presence of aluminum as a reason for the difference in the effects of so-called acid soil on barley and rye [J]. Soil Sci, 1918, 6(4): 259–280. doi: 10.1097/00010694-191 810000-0000.
[15] MA X L. Study on genetic diversity of wild and local alfalfa resources in Yunnan and identification of acid-aluminum resistance [D]. Kun- ming: Yunnan Agricultural University, 2010: 1–22. 马向丽. 云南野生和逸生苜蓿资源遗传多样性研究及耐酸铝性鉴定[D]. 昆明: 云南农业大学, 2010: 1–22.
[16] WANG A Y, ZHANG C Q, WU C L, et al. Study on a fast method of testing chlorophyll content in maize [J]. J Maize Sci, 2008, 16(2): 97– 100. 王爱玉, 张春庆, 吴承来, 等. 玉米叶绿素含量快速测定方法研究 [J]. 玉米科学, 2008, 16(2): 97–100.
[17] Köhle H, Jeblick W, Poten F, et al. Chitosan-elicited callose synthesis in soybean cells as a Ca2+-dependent process [J]. Plant Hysiol, 1985, 77(3): 544–551. doi: 10.1104/pp.77.3.544.
[18] HINSINGER P, PLASSARD C, TANG C X, et al. Origins of root- mediated pH changes in the rhizosphere and their responses to environ- mental constraints: A review [J]. Plant Soil, 2003, 248(1/2): 43–59. doi: 10.1023/A:1022371130939.
[19] ZOU Q, LI D Q, ZHENG G S, et al. Physiological and Ecological Research on Crop Drought Resistance [M]. Ji’nan: Shandong Science and Technology Press, 1994: 100–105.邹琦, 李德全, 郑国生, 等. 作物抗旱生理生态研究 [M]. 济南: 山东科学技术出版社, 1994: 100–105.
[20] ZHANG X Y, PAN Y S. Chemical mechanism on the toxicity of heavy metals [J]. Res Environ Sci, 1997, 10(2): 45–49. doi: 10.13198/j.res. 1997.02.48.zhangxy.010. 张笑一, 潘渝生. 重金属致毒的化学机理 [J]. 环境科学研究, 1997, 10(2): 45–49. doi: 10.13198/j.res.1997.02.48.zhangxy.010.
[21] LIN X Y, ZHANG Y S, LUO A C. Differences of aluminum tolerance on wheat genotypes and its screening techniques [J]. J Plant Nutri Fertil Sci, 2001, 7(1): 64–70. doi: 10.11674/zwyf.2001.0110. 林咸永, 章永松, 罗安程. 不同小麦基因型耐铝性的差异及筛选方法的研究 [J]. 植物营养与肥料学报, 2001, 7(1): 64–70. doi: 10. 11674/zwyf.2001.0110.
[22] LIU G L, HE S B, YANG H M. The responses and mechanisms of water use efficiency to different water stresses of three alfalfa varieties [J]. Acta Pratac Sin, 2009, 18(3): 207–213. doi: 10.3321/j.issn:1004- 5759.2009.03.029. 刘国利, 何树斌, 杨惠敏. 紫花苜蓿水分利用效率对水分胁迫的响应及其机理 [J]. 草业学报, 2009, 18(3): 207–213. doi: 10.3321/j.issn: 1004-5759.2009.03.029.
[23] XIAO X X, LIU X H, YANG Z W, et al. Effect of aluminum stress on the photosynthesis of longan seedlings [J]. Chin J Trop Crops, 2005, 16(1): 63–69. doi:10.3969/j.issn.1000-2561.2005.01.013. 肖祥希, 刘星辉, 杨宗武, 等. 铝胁迫对龙眼幼苗光合作用的影响 [J]. 热带作物学报, 2005, 26(1): 63–69. doi:10.3969/j.issn.1000-2561. 2005.01.013.
[24] LI Z X, LIN Z Y, FU Y X. Influence of aluminum stress on pepper nutrient solution and leaf [J]. N Hort, 2017(1): 1–5. doi: 10.11937/ bfyy.201701001. 李贞霞, 林紫玉, 傅咏贤. 铝胁迫对辣椒培养液及叶片的影响 [J]. 北方园艺, 2017(1): 1–5. doi: 10.11937/bfyy.201701001.
[25] HUO X M, HU T M, YANG P Z, et al. Effect of drought stress on three physiological indexes in alfalfa seedling [J]. Pratac Sci, 2010, 27(4): 89–92. 霍学敏, 呼天明, 杨培志, 等. 干旱胁迫对苗期紫花苜蓿3种生理指标的影响 [J]. 草业科学, 2010, 27(4): 89–92.
[26] ZHANG Y F, LIANG Z W, SUI L, et al. Effect on physiological characteristic of Medicago sativa under saline-alkali stress at seeding stage [J]. Acta Pratac Sin, 2009, 18(4): 230–235. doi: 10.3321/j.issn: 1004-5759.2009.04.033. 张永锋, 梁正伟, 隋丽, 等. 盐碱胁迫对苗期紫花苜蓿生理特性的影响 [J]. 草业学报, 2009, 18(4): 230–235. doi: 10.3321/j.issn:1004- 5759.2009.04.033.
[27] LIN J S, WANG G X. Effects of doubled CO2concentration on anti- oxidant enzymes and programmed cell death of wheat leaves under osmotic stress [J]. Acta Phytophysiol Sin, 2000, 26(5): 453–457. doi: 10.3321/j.issn:1671-3877.2000.05.016. 林久生, 王根轩. CO2倍增对渗透胁迫下小麦叶片抗氧化酶类及细胞程序性死亡的影响 [J]. 植物生理学报, 2000, 26(5): 453–457. doi: 10.3321/j.issn:1671-3877.2000.05.016.
[28] Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants [J]. Annu Rev Plant Physiol Plant Mol Biol, 1995, 46: 237–260. doi: 10.1146/annurev.pp.46.060195.001321.
[29] Delhaize E, Ryan P R, Randall P J. Aluminum tolerance in wheat (L.): II. Aluminum-stimulated excretion of malic acid from root apices [J]. Plant Physiol, 1993, 103(3): 695–702. doi: 10.1104/pp.103.3.695.
[30] Kaneko M, Yoshimura E, Nishizawa N K, et al. Time course study of aluminum-induced callose formation in barley roots as observed by digital microscopy and low-vacuum scanning electron microscopy [J]. Soil Sci Plant Nutri, 1999, 45(3): 701–712. doi: 10.1080/00380768. 1999.104158330.
[31] Teraoka T, Kaneko M, Mori S, et al. Aluminum rapidly inhibits cellulose synthesis in roots of barley and wheat seedlings [J]. J Plant Physiol, 2002, 159(1): 17–23. doi: 10.1078/0176-1617-00678.
[32] SchaeffeR H J, Walton J D. Aluminum ions induce oat proto- plasts to produce an extracellular (1→3)--d-glucan [J]. Plant Physiol, 1990, 94(1): 13–19. doi: 10.1104/pp.94.1.13.
[33] SCHREINER K A, HODDINOTT J, TAYLOR G J. Aluminum-induced deposition of (1,3)--glucans (callose) inL. [J]. Plant Soil, 1994, 162(2): 273–280. doi: 10.1007/BF01347714.
[34] Horst W J, Püschel A K, Schmohl N. Induction of callose formation is a sensitive marker for genotypic aluminium sensitivity in maize [J]. Plant Soil, 1997, 192(1): 23–30. doi: 10.1023/A:100420412 0863.
[35] Eticha D, ThéC, Welcker C, et al. Aluminium-induced callose formation in root apices: Inheritance and selection trait for adaptation of tropical maize to acid soils [J]. Field Crops Res, 2005, 93(2/3): 252– 263. doi: 10.1016/j.fcr.2004.10.004.
[36] CHANG Y C, YAMAMOTO Y, MATSUMOTO H. Enhancement of callose production by a combination of aluminum and iron in suspension- cultured tobacco() cells [J]. Soil Sci Plant Nutri, 1999, 45(2): 337–347. doi: 10.1080/00380768.1999.10409 348.
[37] Massot N, Llugany M, Poschenrieder C, et al. Callose production as indicator of aluminum toxicity in bean cultivars [J]. J Plant Nutri, 1999, 22(1): 1–10. doi:10.1080/01904169909365601.
[38] Wissemeier A H, Hahn G, Marschner H. Callose in roots of Norway spruce ((L.) Karst.) is a sensitive parameter for aluminium supply at a forest site (Höglwald) [J]. Plant Soil, 1998, 199 (1): 53–57. doi: 10.1023/A:1004212017912.
[39] DELMER D P. Cellulose biosynthesis [J]. Annu Rev Plant Physiol, 1987, 38: 259–290. doi: 10.1146/annurev.pp.38.060187.001355
[40] NAKASHIMA J, LAOSINCHAI W, CUI X J, et al. New insight into the mechanism of cellulose and callose biosynthesis: Proteases may regulate callose biosynthesis upon wounding [J]. Cellulose, 2003, 10(4): 369–389. doi: 10.1023/A:1027336605479.
[41] VOIGT C A. Callose-mediated resistance to pathogenic intruders in plant defense-related papillae [J]. Front Plant Sci, 2014, 5: 168. doi: 10. 3389/fpls.2014.00168.
[42] KOCHIAN L V, PENCE N S, LETHAM D L D, et al. Mechanisms of metal resistance in plants: Aluminum and heavy metals [J]. Plant Soil, 2002, 247(1): 109–119. doi: 10.1023/A:1021141212073.
Physiological Response and Comprehensive Evaluation of Alfalfa Seedlings to Aluminum Stress
SUN Wen-jun1, YANG Wei2, XU Wen-hua1, REN Jian1, HAN Bo1, ZHANG Ran1, MA Xiang-li1*
(1. College of Animal Science and Technology, Yunnan Agricultural University,Kunming 650201, China; 2. Kunming Cigarette Factory of Hongyunhonghe Group,Kunming 650202, China)
In order to understand the effects of aluminum on growth and physiological characteristics of alfalfa () seedlings, the above- and under-ground biomass, contents of leaf chlorophyll and callus in root tips were measured, the structure of root tips was observed, and the aluminum resistance of alfalfa was evaluated using membership function analysis. The results showed that with increment of aluminum concentration, the above- and under-ground biomass of alfalfa decreased, which significantly decreased under low and high aluminum concentrations (<0.05). With increment of aluminum stress, the chlorophyll content of alfalfas dropped, while the accumulation of calluses increased, particularly under middle and high aluminum stress. Under aluminum stress, the cells of root tip had a big changes, which collapsed and in disorder under high aluminum stress. According to comprehensive evaluation, the aluminum resistance of No. 12 and No. 18 was better than that of others, suggesting that they could be applied in acid aluminized soil in southern China.
; Aluminum stress; Biomass; Chlorophyll; Seedling; Physiology
10.11926/jtsb.4238
2020–04–23
2020–07–05
云南省基础研究计划面上项目(2019FB044); 云南省重点研发计划项目(2018BB001-03); 云南省重大科技专项-绿色食品国际合作研究中心项目(2019ZG009)资助
This work was supported by the General Program of Basic Research Plan in Yunnan (Grant No. 2019FB044); the Project of Key Research and Development Plan in Yunnan (Grant No. 2018BB001-03); and the Yunnan Eco-friendly Food International Cooperation Research Center Project of Yunnan Provincial Key Programs (Grant No. 2019ZG009).
孙文君(1992~ ), 女,在读博士,研究方向: 草地生态与环境。E-mail: 276384152@qq.com
E-mail: xfmaxiangli@126.com

