杭白菊花水提物的UHPLC-ESI-Orbitrap质谱联用分析
徐晓俞, 李程勋, 郑开斌, 李爱萍*
杭白菊花水提物的UHPLC-ESI-Orbitrap质谱联用分析
徐晓俞1, 李程勋1, 郑开斌2*, 李爱萍1*
(1. 福建省农业科学院作物研究所, 福州 350013; 2. 福建省农业科学院亚热带农业研究所, 福建 漳州 363005)
为阐明杭白菊花水提物的药效物质基础,采用超高压液相-高分辨质谱联用技术对杭白菊()花水提物的化学成分进行分析和鉴定。结果表明,从杭白菊花水提物中鉴定出376种化学成分,其中相对含量大于0.1%的成分有152种,相对含量较高的有绞股蓝皂苷XXVII、含羞草碱---葡萄糖苷、甲基--葡萄糖苷、d-1--甲基粘质肌醇、l(+)-甲基肌醇、过氧化苯甲酰、甲基--半乳糖苷、甲基--果糖苷、芒柄醇、松醇、()-2-己烯--阿拉伯糖-(1→2)--葡萄糖苷、米瑟毒苷等。杭白菊花水提物主要以黄酮类和生物碱类成分为主,分别有40和53种,相对含量分别为22.68%和26.57%,是杭白菊花发挥功效的主要物质基础。
杭白菊;花;水提物;化学成分;液质联用分析
杭白菊为菊科(Compositae)植物菊()的干燥头状花序,与毫菊、滁菊、贡菊并称为中国四大名菊。浙江桐乡是其主产地, 杭白菊是“浙八味”之一,也是卫生部批准的药食同源原料。杭白菊的花是清凉药,性微寒,味甘、苦,具有散风清热、明目平肝的功效。现代药理学研究表明,杭白菊具有抗菌、抗氧化、抗癌、降血压、降血脂、降血糖等多种药理活性[1]。有研究报道, 从杭白菊花中分离出倍半萜类[2–3]、黄酮类[4]、酚酸类[5]等成分,其中黄酮类化合物是主要活性成分[6], 具有抗氧化[7]、抗菌[1]、抗癌[1]等生理活性,如木犀草素-7---d-葡萄糖苷、芹菜素-7---d-葡萄糖苷、金合欢素-7---d-葡萄糖苷等作为评价指标, 用于杭白菊指纹图谱的建立[8–12]、药材鉴别和质量控制。
杭白菊精油在提取过程中产生大量的废弃液,如直接排放将对环境造成污染,而如果对其中的活性成分进行开发利用,则可实现废弃物资源的利用,提高杭白菊的附加值。但至目前为止,对于杭白菊的化学成分研究主要集中于挥发油上,而对提取液中的化学成分报道较少。因此,明确杭白菊花中非挥发性化学成分的组成,对阐明其生物功效具有指导意义。
电喷雾离子源质谱具有高灵敏性、操作简便、分子离子峰丰度高等优点,已应用于杭白菊成分的定性研究中。周莹[13]采用液质联用技术(HPLC- ESI-MSn)从杭白菊花序中鉴定出10个黄酮苷,分别是金合欢素、山奈素、芹菜素和木犀草素与芸香糖、葡萄糖、葡萄糖醛酸和新橙皮糖形成的氧取代的黄酮糖苷。杭白菊花中是否还有其他黄酮成分或其他类型成分还需进一步的探讨,这对检测技术提出了更高的要求。Q-Exactive四极杆-静电场轨道阱(Orbitrap)高分辨质谱仪可同时实现多级质谱碎裂和母、子离子的高分辨采集,为小分子化合物的鉴定提供了更多精确的信息,具有比离子阱质谱更高的灵敏度,在未知化合物鉴定[14]、农药残留检测等领域已经有十多年的应用历史。因此,本研究将其与高效液相色谱结合用于杭白菊花水提物中化学成分的鉴定,以阐明杭白菊花的药效物质基础,为其开发利用提供科学依据。
1 材料和方法
1.1 材料和仪器
杭白菊()鲜花于2017年11月30日采自福建省福州市埔垱试验基地。
Ultimate 3000 UHPLC液相色谱仪、Q-Exactive四极杆-静电场轨道阱高分辨质谱仪(美国Thermo公司);Allegra 64R型高速离心机(美国Beckman公司);半自动固相萃取机(美国Supelco公司);全自动氮吹浓缩仪(美国Capiler Life Sciences公司);PrimeHLB固相微萃取柱(美国Waters公司);Milli-Q纯水机(美国Millipore公司)。
甲醇、乙腈(色谱纯)为德国Merck公司生产; 甲酸为国药集团化学试剂有限公司产品。
1.2 样品处理
称取杭白菊鲜花5 kg,置于100 L蒸馏罐中, 按料液比为1∶4加入纯水,加热回流提取2 h,得杭白菊花水提物,备用。精密量取杭白菊花水提物5 mL,置于10 mL离心管中,在7 168×下离心15 min,吸取上清液转移至Prime HLB固相微萃取柱中,用5 mL纯水淋洗,再用5 mL甲醇洗脱,收集甲醇洗脱液于35℃下用N2吹干,加入1 mL 0.1%甲酸水-乙腈溶液(7∶3,/)溶解甲醇洗脱物,过0.22m微孔滤膜,得上机样品,待用。
1.3 液相-质谱分析
杭白菊花水提物样品,采用Q-Exactive高分辨质谱仪,在正离子和负离子两种模式下同时扫描, 获得杭白菊花水提物的代谢物总离子流图。
色谱条件 色谱柱:Waters HSS T3色谱柱(100 mm×2.1 mm,1.8m);柱温:50℃;流动相:0.1%甲酸水(A),甲醇(B);流速:1.0 mL/min。梯度洗脱程序:0~5 min,0% B~25% B;5~15 min, 25% B~100% B;15~20 min,100% B;20~25 min,100% B~0% B。进样体积:10L。
质谱条件 离子源(ESI)电压:3.5 kV; 扫描范围:/100~1 000 amu;扫描分辨率:17 500; 正负离子模式采集。采用数据依赖采集方法获得代谢物的二级质谱碎裂信息,扫描范围为/100~1 500 amu;碰撞能量(CE)为25、35和45 eV。
1.4 数据处理与分析
数据采用Compounds Discoverer (CD)软件进行处理,包括:峰提取、峰对齐、代谢物成分信息提取、代谢物成分结构预测、数据库检索。参数设定:质量偏差为5,峰对齐最大保留时间偏移为0.5 min, 信号强度最大偏差为30%,信噪比(/)为3,鉴定数据库为mzCloud (https://www.mzcloud.org/)、ChemSpider (http://www.chemspider.com/)。运用峰面积归一化法,求得各代谢物成分的相对含量。
2 结果和分析
本研究从杭白菊花水提物中鉴定出376种化学成分,其中相对含量在0.1%以上(以下同)的成分有152种(表1),相对含量较高的成分有绞股蓝皂苷XXVII (3.80%)、含羞草碱---葡萄糖苷(3.19%)、甲基--葡萄糖苷(2.51%)、d-1--甲基粘质肌醇(2.51%)、l(+)-甲基肌醇(2.51%)、过氧化苯甲酰(2.51%)、甲基--半乳糖苷(2.51%)、甲基--果糖苷(2.51%)、芒柄醇(2.51%)、松醇(2.51%)、()-2-己烯--阿拉伯糖-(1→2)--葡萄糖苷(2.34%)和米瑟毒苷(1.94%)等。
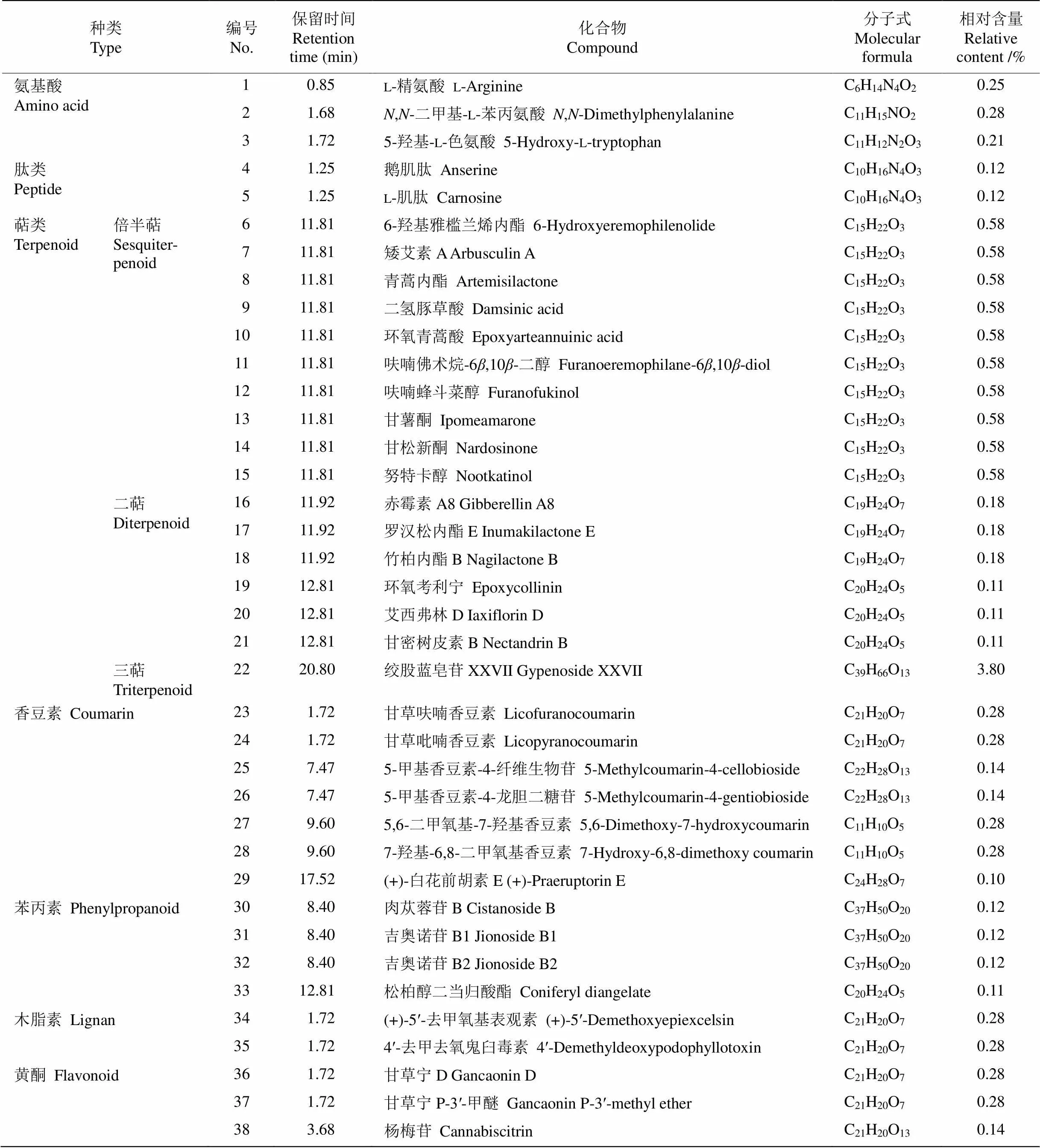
表1 杭白菊花水提物的化学成分和相对含量
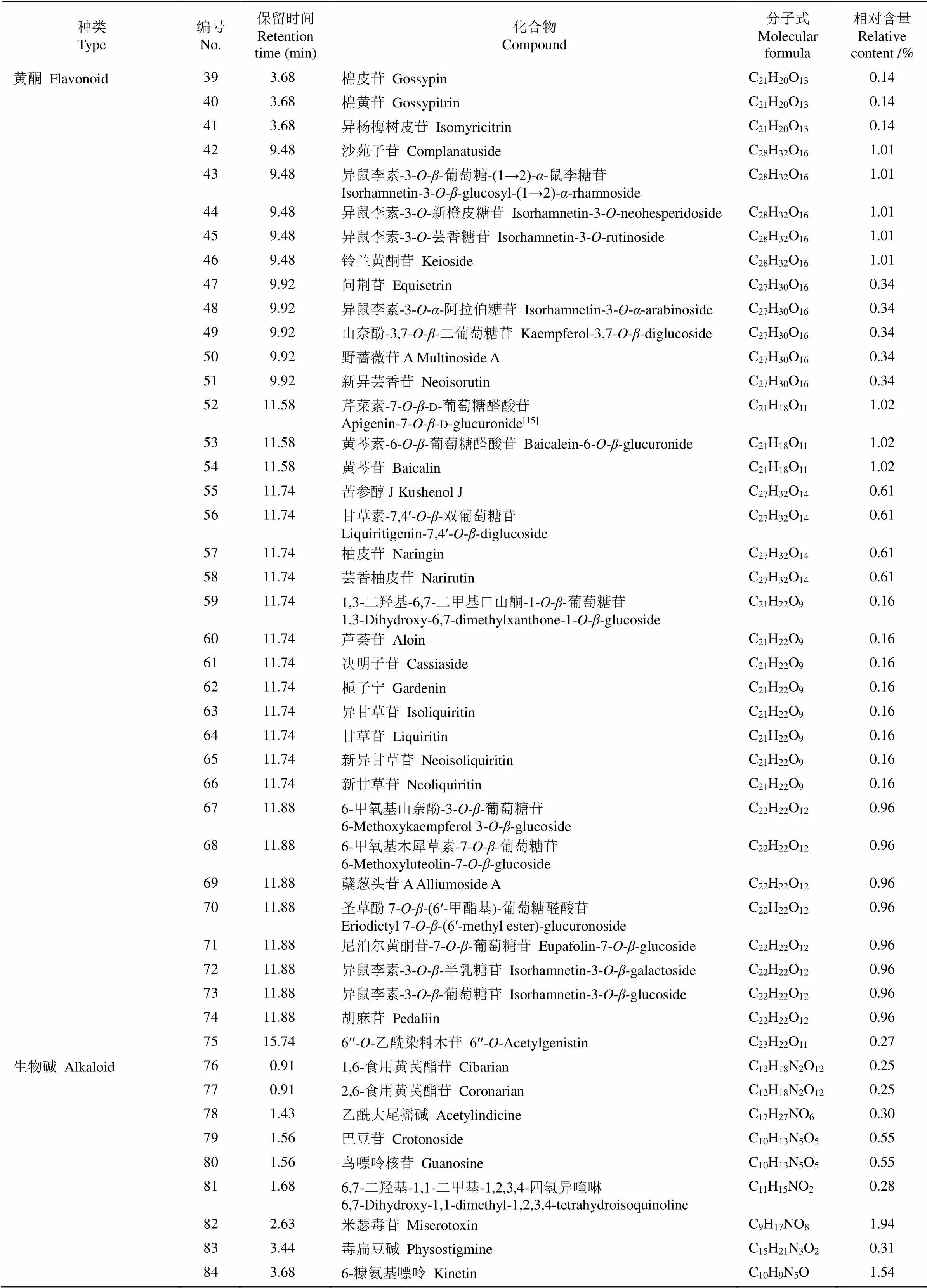
续表(Continued)
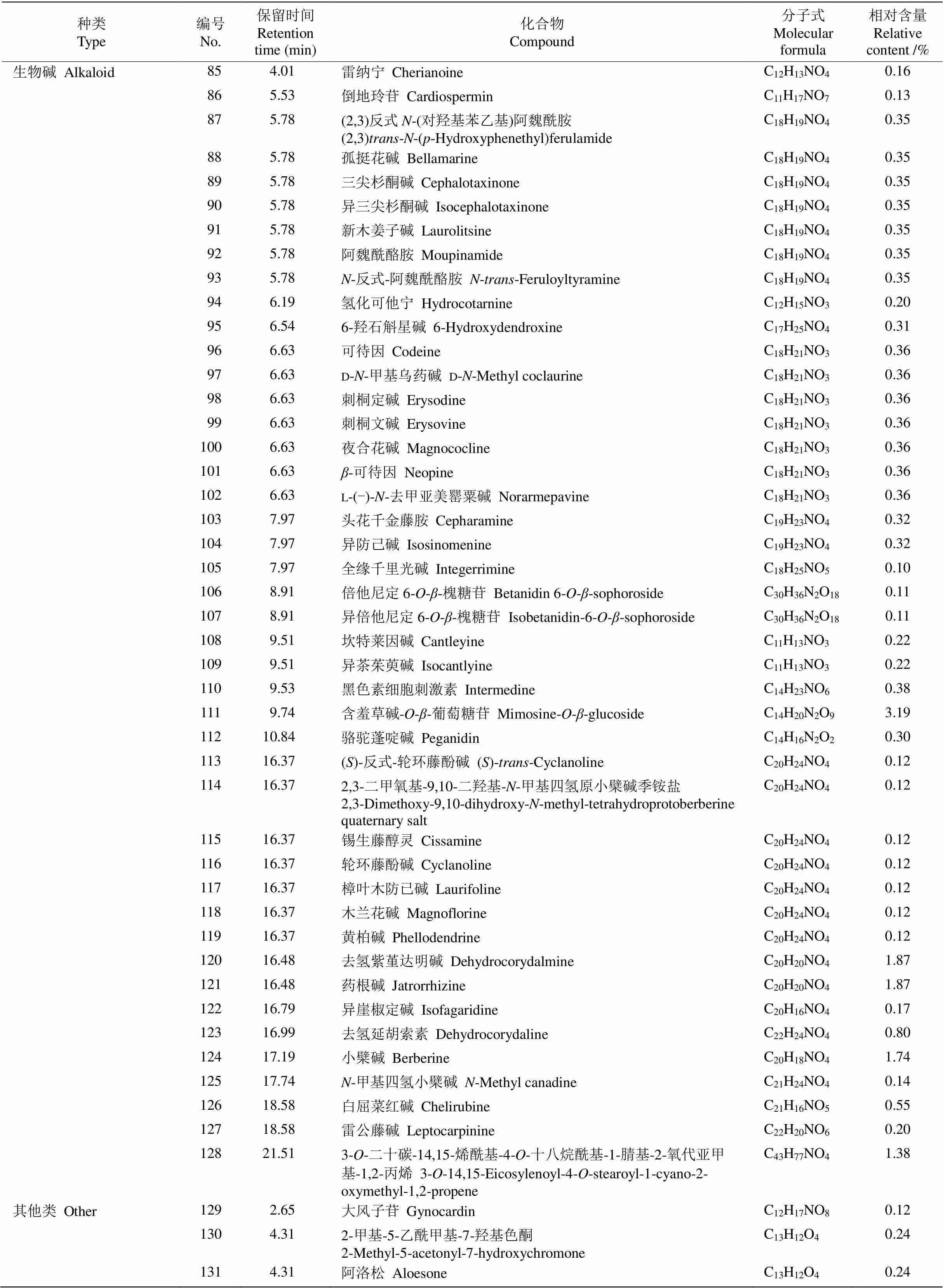
续表(Continued)
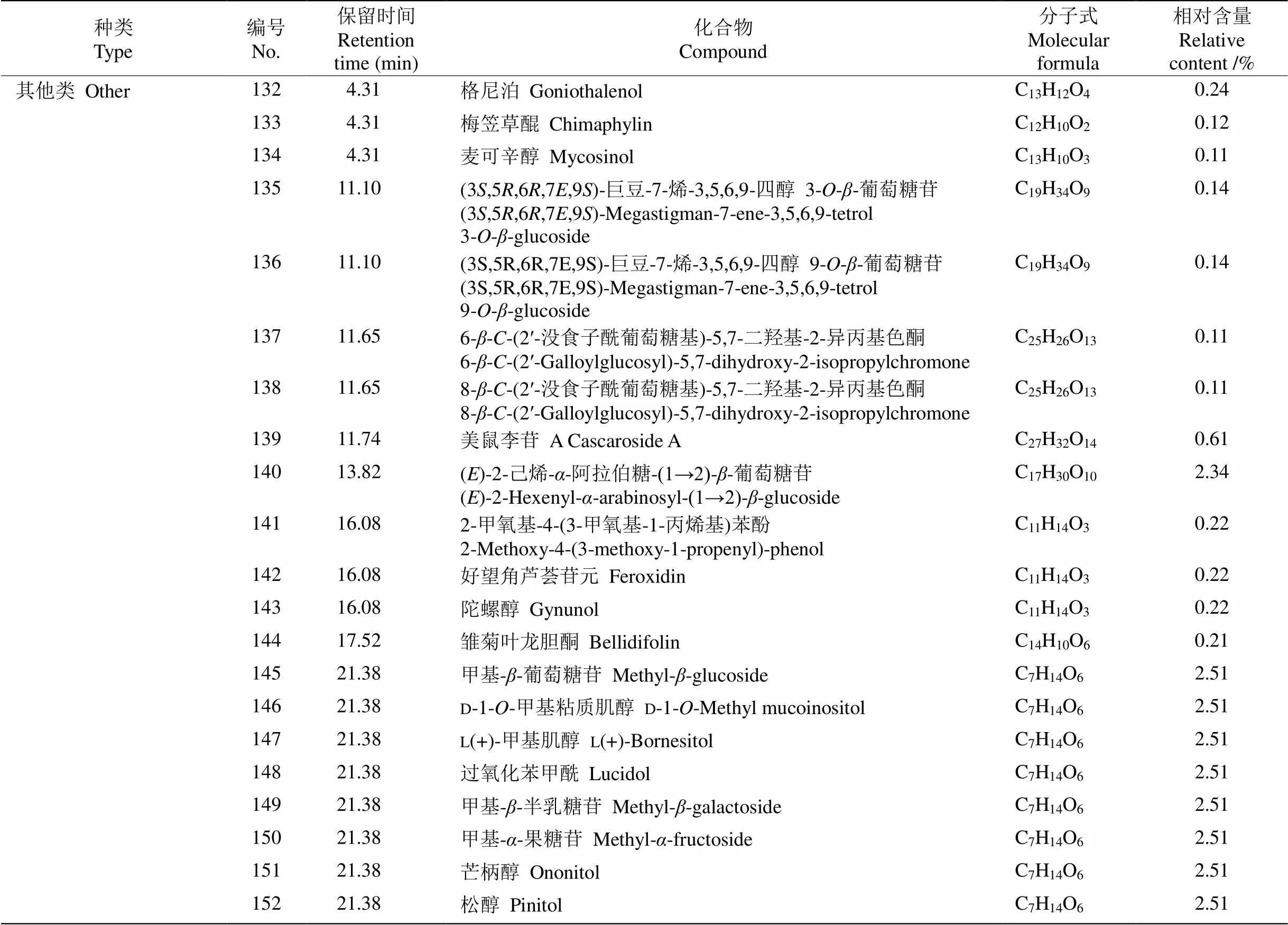
续表(Continued)
由表2可知,生物碱类和黄酮类成分是杭白菊花水提物中相对含量最高的2类成分,分别达26.57%和22.68%,是杭白菊花水提物的主要物质基础,对其功效的发挥具有重要贡献。黄酮类成分有40种,芹菜素-7---d-葡萄糖醛酸苷、黄芩素-6---葡萄糖醛酸苷、黄芩苷、沙苑子苷、异鼠李素-3---葡萄糖(1→2)--鼠李糖苷、异鼠李素-3--新橙皮糖苷、异鼠李素-3--芸香糖苷和铃兰黄酮苷相对含量较高,分别为1.02%、1.02%、1.02%、1.01%、1.01%、1.01%、1.01%和1.01%。还有多种甘草黄酮衍生物,如甘草宁D、甘草宁P-3′-甲醚、甘草素- 7, 4ʹ---双葡萄糖苷、异甘草苷、甘草苷、新异甘草苷和新甘草苷,总相对含量达1.82%。生物碱类成分有53种,含羞草碱---葡萄糖苷、米瑟毒苷、去氢紫堇达明碱、药根碱、小檗碱、6-糠氨基嘌呤和3--二十碳-14,15-烯酰基-4--十八烷酰基-1-腈基- 2-氧代亚甲基-1,2-丙烯等相对含量较高,分别为3.19%、1.94%、1.87%、1.87%、1.74%、1.54%和1.38%。
本研究还从杭白菊花水提物中检测到其他物质,包括3种氨基酸:l-精氨酸、,-二甲基-l-苯丙氨酸和5-羟基-l-色氨酸;2种肽类成分:鹅肌肽和l-肌肽,相对含量均小于1%;10种倍半萜类成分,相对含量均低于1%,其中有2种青蒿素衍生物(青蒿内酯和环氧青蒿酸);6种二萜类成分:赤霉素A8、罗汉松内酯E、竹柏内酯B、环氧考利宁、艾西弗林D和甘密树皮素B,相对含量均小于1%;1种三萜类成分,即绞股蓝皂苷XXVII,相对含量最高,达3.80%,是杭白菊花水提物的主要成分;7种香豆素类成分,相对含量均小于1%;4种苯丙素类成分,相对含量均较低;2种木脂素类成分相对含量均为0.28%。
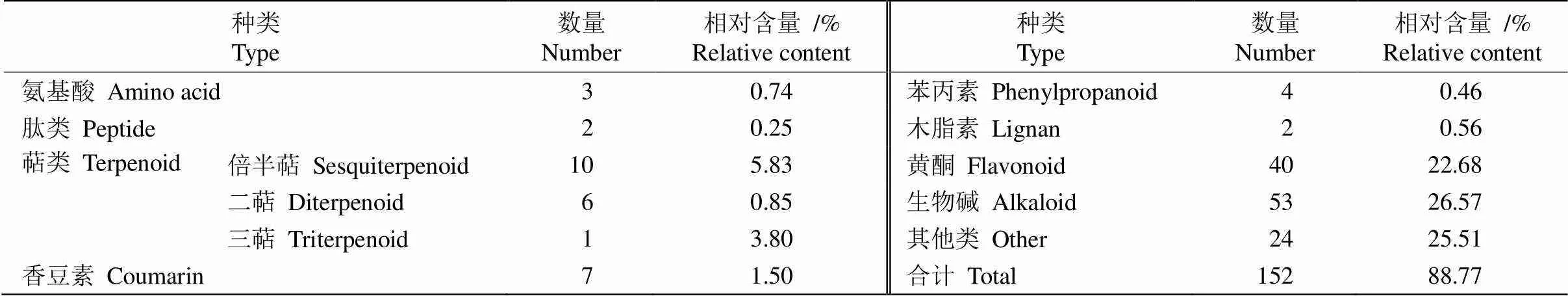
表2 杭白菊花水提物的化学成分种类和相对含量
3 结论和讨论
本研究利用超高压液相-高分辨质谱联用技术从杭白菊花水提物中鉴定出376种化学成分,相对含量0.1%以上的成分有152种,其中40种黄酮类和53种生物碱类成分,相对含量分别为22.68%和26.57%,是杭白菊花发挥功效的主要物质基础,这些黄酮类和生物碱类化合物具有多样化的生物活性,共同赋予了杭白菊花水提物抗菌、抗病毒、抗氧化、抗炎、抗肿瘤、保护心脑血管等功效。因此,杭白菊花水提物在保健品、功能食品、生物医药等领域的开发上具有良好的应用前景。
黄酮类化合物是一类植物中具有重要生理活性的成分,在植物的根、茎、叶、花、果实中均有分布,具有广泛的药理活性。本研究从杭白菊花水提物中检测出的黄酮类化合物,多以糖苷形式存在。芹菜素及其糖苷具有抗菌、抗病毒、抗肿瘤、心脑血管保护等多种生物活性[16];黄芩素及其糖苷如黄芩苷具有抗菌、抗病毒、抗氧化、抗炎、抗肿瘤、保肝、保护心脑血管、降血糖等广泛的药理作用[17–18];沙苑子苷具有清除羟自由基活性[19]。研究表明,杭白菊花水提物中存在多种异鼠李素糖苷, 如异鼠李素-3---葡萄糖(1→2)--鼠李糖苷、异鼠李素-3--新橙皮糖苷、异鼠李素-3--芸香糖苷、铃兰黄酮苷、异鼠李素-3---阿拉伯糖苷、异鼠李素- 3--半乳糖苷、异鼠李素-3---葡萄糖苷,总相对含量高达6.32%,接近总黄酮含量的1/3,这些异鼠李素糖苷具有抗氧化[20]、抗癌[21]、降血糖[22]等多种生理活性。杭白菊花水提物中还存在多种甘草黄酮衍生物,总相对含量达到1.82%,其中甘草素-7,4ʹ---双葡萄糖苷对急性肝损伤具有保护作用,异甘草苷和甘草苷均具有抗抑郁作用,异甘草苷还具有抗氧化活性[23]。
杭白菊花水提物中的生物碱,结构多样,具有多种药理活性。含羞草碱---葡萄糖苷是一种植物氨基酸,对人头颈鳞状癌细胞有抑制作用[24]。药根碱是一种四氢异喹啉生物碱,其结构与小檗碱类似,具有清除自由基、抗菌、抗肿瘤、降血糖等作用[25]。小檗碱最早是从传统中药黄连和黄柏中提取的一种异喹啉类生物碱,具有抗菌、抗病毒、抗炎、抗肿瘤、保护心脏、降血糖、降血脂等多种药理作用,临床上已被用于肠道感染疾病的治疗,取得显著的疗效[26]。
本研究还从杭白菊花水提物中检测到相对含量高达3.80%的三萜类绞股蓝皂苷XXVII,其不仅有神经系统保护活性,还具有抗肿瘤和降血脂的作用,已应用于肝癌药物的开发[27]。
[1] ZHONG A J, JIANG Z, LI X Z, et al. Research progress on chemical constituents and pharmacological activities of Chrysanthemi Flos [J]. Drugs Clinic, 2014, 29(7): 824–830. doi: 10.7501/j.issn.1674-5515. 2014.07.029.钟爱娇, 姜哲, 李雪征, 等. 杭白菊化学成分和药理活性的研究进展[J]. 现代药物与临床, 2014, 29(7): 824–830. doi: 10.7501/j.issn. 1674-5515.2014.07.029.
[2] Zhao F Q, Zhang Q Q, Yan Y, et al. Antioxidant constituents of chrysanthemum ‘jinsidaju’ cultivated in Kaifeng [J]. Fitoterapia, 2019, 134: 39–43. doi: 10.1016/j.fitote.2019.02.003.
[3] Chen W J, Zeng M N, Li M, et al. Four new sesquiterpenoids from(Ramat.) kitam flowers [J]. Phytochem Lett, 2018, 23: 52–56. doi: 10.1016/j.phytol.2017.11.009.
[4] Lin L C, Pai Y F, Tsai T H. Isolation of luteolin and luteolin-7-- glucoside fromRamat Tzvel and their pharmacokinetics in rats [J]. J Agric Food Chem, 2015, 63(35): 7700– 7706. doi: 10.1021/jf505848z.
[5] Xie Y, Yu H, Wang J F, et al. Simultaneous determination of nine phenolic acids in(Ramat) Tzvel. cv. Chuju samples by high performance liquid chromatography [J]. Chin J Anal Chem, 2013, 41(3): 383–388. doi: 10.3724/SP.J.1096.2013.20820.谢越, 俞浩, 汪建飞, 等. 高效液相色谱法同时测定滁菊样品中的9种酚酸 [J]. 分析化学, 2013, 41(3): 383–388. doi: 10.3724/SP.J.1096. 2013.20820.
[6] YU Q, JIANG Y, ZHOU D Y, et al. Content determination of active ingredients and flavonoids in extract from Chrysanthemi Flos [J]. Chin J Mod Appl Pharm, 2011, 28(6): 530–532,547. doi: 10.13748/j.cnki. issn1007-7693.2011.06.008.余琪, 姜艳, 周丹英, 等. 杭白菊提取物中活性成分及总黄酮的含量测定[J]. 中国现代应用药学, 2011, 28(6): 530–532,547. doi: 10. 13748/j.cnki.issn1007-7693.2011.06.008.
[7] WANG T T, WANG S K, HUANG G L, et al. Bioactive component content and antioxidant activity of chrysanthemum flower (Ramat) extract [J]. Food Sci, 2013, 34(15): 95–99. doi: 10.7506/spkx1002-6630-201315020.王婷婷, 王少康, 黄桂玲, 等. 菊花主要活性成分含量及其抗氧化活性测定[J]. 食品科学, 2013, 34(15): 95–99. doi: 10.7506/spkx 1002-6630-201315020.
[8] XU H M, JIN H H, WANG X J, et al. Study on fingerprints of Hangzhou white Chrysanthemi Flos and comparison of Hangzhou white Chrysanthemi Flos from different producing areas [J]. Chin J Inf TCM, 2019, 26(1): 76–79. doi: 10.3969/j.issn.1005-5304.2019.01.018.徐洪明, 金辉辉, 王昕佳, 等. 杭白菊指纹图谱研究及不同产地杭白菊质量比较[J]. 中国中医药信息杂志, 2019, 26(1): 76–79. doi: 10.3969/j.issn.1005-5304.2019.01.018.
[9] ZHANG J Z, ZHANG L, FU H W, et al. Determination of two flavonoids and fingerprint study on the stem and leaf of(Ramat.) Tzvel by HPLC [J]. Chin Pharm, 2010, 13(6): 796–799. doi: 10.3969/j.issn.1008-049X.2010.06.012.张洁枝, 张琳, 付红伟, 等. 杭白菊茎叶中两种黄酮HPLC定量分析及其特征指纹图谱研究[J]. 中国药师, 2010, 13(6): 796–799. doi: 10.3969/j.issn.1008-049X.2010.06.012.
[10] WANG S. Studies on quality evalution ofRamat. and preparation technology of its extracts [D]. Shenyang: Shenyang Pharmaceutical University, 2005: 9. 王硕. 菊花化学品质的比较及杭白菊提取物制备工艺的研究[D]. 沈阳: 沈阳药科大学, 2005: 9.
[11] HU B B. Development of fingerprint of Flos Chrysanthemi and determination of main flavone glycosides [D]. Hangzhou: Zhejiang University, 2005: 3–4. 胡碧波. 杭白菊指纹图谱及其主要黄酮苷成分分析[D]. 杭州: 浙江大学, 2005: 3-4.
[12] JIANG H D, HU B B, ZENG S. Fingerprint analysis for the quality assessment of Flos Chrysanthemi [J]. Chin Pharm J, 2005, 40(8): 578– 581. doi: 10.3321/j.issn:1001-2494.2005.08.006.蒋惠娣, 胡碧波, 曾苏. 杭白菊HPLC指纹图谱的评价[J]. 中国药学杂志, 2005, 40(8): 578–581. doi: 10.3321/j.issn:1001-2494.2005.08.006.
[13] ZHOU Y. Identification of phytochemicals from three plants by HPLC-ESI-MSn[D]. Jinhua: Zhejiang Normal University, 2015: 2–3. 周莹. HPLC-ESI-MSn快速鉴定植物中活性成分[D]. 金华: 浙江师范大学, 2015: 2–3.
[14] XIONG Y, CHANG M Y, ZHANG C H, et al. Fatty acids from[J]. J Trop Subtrop Bot, 2016, 24(3): 348–351. doi: 10.11926/j.issn.1005-3395.2016.03.014.熊英, 苌美燕, 章常华, 等. 猫爪草中的脂肪酸类化合物 [J]. 热带亚热带植物学报, 2016, 24(3): 348–351. doi: 10.11926/j.issn.1005- 3395.2016.03.014.
[15] LEE J S, KIM H J, LEE Y S. A new anti-HIV flavonoid glucuronide from[J]. Planta Med, 2003, 69(9): 859– 861.
[16] LIN L W, XIN Q. Progress in the research of pharmacology of apigenin [J]. Chin Trop Med, 2012, 12(8): 1023–1026. doi: 10.13604/j.cnki.46- 1064/r.2012.08.014.林丽文, 辛勤. 芹菜素药理作用的研究进展[J]. 中国热带医学, 2012, 12(8): 1023–1026. doi: 10.13604/j.cnki.46-1064/r.2012.08.014.
[17] ZHANG Y L, WANG C, ZHU L L, et al. Research progress in pharmacological action of baicalin [J]. Henan Trad Chin Med, 2019, 39(9): 1450–1454. doi: 10.16367/j.issn.1003-5028.2019.09.0358.张艳丽, 王聪, 朱雷蕾, 等. 黄芩苷药理作用研究进展[J]. 河南中医, 2019, 39(9): 1450–1454. doi: 10.16367/j.issn.1003-5028.2019.09. 0358.
[18] TIAN S, HONG T, ZHANG D, et al. Recent advances in pharmaco- logical effects and molecular mechanisms of baicalein [J]. HeilongjiangMed J, 2015, 28(6): 1195–1199. doi: 10.14035/j.cnki.hljyy.2015.06.008.田硕, 洪涛, 张多, 等. 黄芩素的药理作用及分子机制的最新研究进展[J]. 黑龙江医药, 2015, 28(6): 1195–1199. doi: 10.14035/j.cnki. hljyy.2015.06.008.
[19] LI H J. Chemical studies of seed of[J]. Lishizhen Med Mat Med Res, 2011, 22(3): 545–546. doi: 10.3969/j.issn. 1008-0805.2011.03.010.李洪娟. 沙苑子的化学成分研究[J]. 时珍国医国药, 2011, 22(3): 545–546. doi: 10.3969/j.issn.1008-0805.2011.03.010.
[20] JIN N Z, QI Y J, XIANG C J, et al. Study on antioxidant activity of isorhamnetin and isorhamnetin-3--glucoside [J]. Chin J Bio Inf, 2017, 15(2): 112–119. doi: 10.3969/j.issn.1672-5565.20161124001.金能智, 齐燕姣, 向春杰, 等. 异鼠李素和异鼠李素-3--葡萄糖苷的抗氧化活性分析[J]. 生物信息学, 2017, 15(2): 112–119. doi: 10. 3969/j.issn.1672-5565.20161124001.
[21] TAN Q M, HU D. Research on the antitumor activity of isorhamnetin [J]. Con Chem Ind, 2016, 45(4): 687–689. doi: 10.13840/j.cnki.cn21- 1457/tq.2016.04.008.谭琪明, 胡丹. 异鼠李素抗癌活性研究[J]. 当代化工, 2016, 45(4): 687–689. doi: 10.13840/j.cnki.cn21-1457/tq.2016.04.008.
[22] TAN Q M, HU D, HE J. Research of blood glucose lowering activity of isorhamnetin in seabuckthorn [J]. Asia-Pac Trad Med, 2016, 12(15): 13–15. doi: 10.11954/ytctyy.201615006.谭琪明, 胡丹, 何珺. 沙棘中异鼠李素降血糖活性研究[J]. 亚太传统医药, 2016, 12(15): 13–15. doi: 10.11954/ytctyy.201615006.
[23] GAO X Y, WANG W Q, WEI S L, et al. Review of pharmacological effects of Glycyrrhiza Radix and its bioactive compounds [J]. China J Chin Mat Med, 2009, 34(21): 2695–2700. doi: 10.3321/j.issn:1001- 5302.2009.21.001.高雪岩, 王文全, 魏胜利, 等. 甘草及其活性成分的药理活性研究进展 [J]. 中国中药杂志, 2009, 34(21): 2695–2700. doi: 10.3321/j. issn:1001-5302.2009.21.001.
[24] XIANG Y Z. l-mimosine inhibits head and neck squamous cell carcinoma cells proliferation and induces cells apoptosis [D]. Wuhan: Wuhan University, 2017: 6. 向银洲. 左旋含羞草碱抑制头颈鳞状细胞癌细胞增殖并诱导其凋亡的研究[D]. 武汉: 武汉大学, 2017: 6.
[25] WANG Q L, SUN D, HUANG J W, et al. Research progress of jatrorrhizine [J]. Lishizhen Med Mat Med Res, 2010, 21(7): 1844–1846. doi: 10.3969/j.issn.1008-0805.2010.07.140.王启龙, 孙达, 黄金文, 等. 药根碱的研究进展[J]. 时珍国医国药, 2010, 21(7): 1844–1846. doi: 10.3969/j.issn.1008-0805.2010.07.140.
[26] XING Y, LIU X, LIN Y, et al. Progress in pharmacological effects and clinical applications of berberine [J]. Chin J Pharm Tox, 2017, 31(6): 491–502. doi: 10.3867/j.issn.1000-3002.2017.06.001.邢宇, 刘鑫, 林园, 等. 小檗碱药理作用及其临床应用研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 491–502. doi: 10.3867/j.issn. 1000-3002.2017.06.001.
[27] ZHENG Y, LI N, ZHENG Z Z, et al. Advances in research on bioactivity and biotransformation of gypenoside [J]. Food Sci, 2018, 39(13): 324–333. doi: 10.7506/spkx1002-6630-201813048.郑溢, 李旎, 郑志忠, 等. 绞股蓝皂苷生物转化与活性的研究进展 [J]. 食品科学, 2018, 39(13): 324–333. doi: 10.7506/spkx1002-6630- 201813048.
Chemical Constituents of Water Extract fromFlowers by UHPLC-ESI-Orbitrap MS
XU Xiao-yu1, LI Cheng-xun1, ZHENG Kai-bin2*, LI Ai-ping1*
(1. Crop Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 2. Institute of Subtropical Agriculture, Fujian Academy of Agricultural Sciences, Zhangzhou 363005, Fujian, China)
In oreder to understand the effective substances of water extract fromflowers, its chemical constituents were identified by high-pressure liquid chromatography-high resolution mass spectrometry. The results showed that 376 chemical components were identified from flower water extract, and the relative content of 152 components were more than 0.1%. The components with high relative content included gypenoside XXVII, mimosine---glucoside, methyl--glucoside, d-1--methyl mucoinositol, l(+)-bornesitol, lucidol, methyl--galactoside, methyl--fructoside, ononitol, pinitol, ()-2-hexenyl--arabinosyl-(1→2)-- glucoside, miserotoxin, and so on. Therefore, the maim constituents in flower water extract ofwere flavonoids and alkaloids, which had 40 and 53 kinds with relative content of 22.68% and 26.57%, respectively, indicating that the main material basis for the performance offlowers.
; Flower; Water extract; Chemical constituent; LC-MS analysis
10.11926/jtsb.4256
2020–05–26
2020–07–10
福建省重大专项专题项目(2018NZ0003-2); 福建省农业科学院科技创新团队建设项目(STIT2017-2-11)资助
This work was supported by the Major Special Project in Fujian Province (Grant No. 2018NZ0003-2), and the Project for Scientific and Technological Innovation Team Construction of Fujian Academy of Agricultural Sciences (Grant No. STIT2017-2-11).
徐晓俞(1985~ ), 男, 助理研究员, 主要从事食用豆品质育种与天然产物研究。E-mail: 418577787@qq.com
E-mail: k03163@163.com; apl909@163.com

